Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista Científica de Investigación INFO-INIAF
versión impresa ISSN 2308-250X
Info INIAF v.1 n.8 La Paz 2016
ARTÍCULO
Desarrollo de un protocolo para el establecimiento in vitro de Kewiña (Polylepis besseri, Hieron) a partir de yemas apicales
Ariel Darwin Antelo Taborga1, Rozzana Medina León1, Delia Vargas Poma1, Víctor García1, Juan José Vicente Rojas1
1 Instituto Nacional de Innovación Agropecuaria y Forestal
e-mail: aridar_24@hotmail.com, rozzmedina@gmail.com, vicedu020@gmail.com, juanjose_vicente@yahoo.es
Resumen
La Kewiña (Polylepis besseri Hieron) es una especie nativa de alto valor regional, el rango altitudinal de distribución oscila entre los 2.200 y 4.400 msnm, siendo indispensable para la subsistencia de ecosistemas andinos y las poblaciones cercanas. Se emplean para la fabricación de viviendas, cercos, postes, entre otros; se constituye en una especie amenazada por la pérdida de su hábitat y su excesiva sobre explotación. Debido a su difícil propagación sexual se ha realizado la validación de protocolo de introducción y establecimiento, la cual muestra ser una alternativa favorable para la especie, con niveles de multiplicación aceptables y que garantizan las condiciones fitosanitarias. Los ensayos de introducción y establecimiento se realizaron en el laboratorio de Biotecnología de cultivos in vitro del Centro Nacional de innovación Toralapa - INIAF. La colecta del material vegetal de kewiña (Polylepis besseri, Hieron) se realizó en la comunidad de Puca Puca del municipio de Tiquipaya del departamento de Cochabamba. Se identificaron 16 accesiones de las cuales se obtuvo el material vegetal; 5 varetas de 20 cm por accesión, se determinó el mejor tiempo de desinfección y el mejor medio de cultivo para el establecimiento la cual fue el T4 (D2m2). De la cual se obtuvo después del proceso de desinfección y establecimiento de un total de 40 vitroplantas, 18 plantulas vivas, 11 contaminada con bacteria y 11 contaminada con hongo, siendo el (T4) el mejor tiempo de desinfección y mejor medio de cultivo. Como resultado de la fase I en base a T4 = D2m2 se trabajó con los 18 explantes y se realizó la comparación con 2 medios de cultivo de multiplicación, para la Fase II se emplearon 2 tratamientos: T5 ( D2m2M1); T6 (D2m2M2) cada tratamiento con 9 repeticiones de las cuales se obtuvo el mejor medio de cultivo T6(D2m2M2) donde La tasa de multiplicación del tratamiento T6 fue de 1 a 5, obteniendo 45 plántulas vivas.
Palabras claves: Polylepis, establecimiento, in vitro
Introducción
La kewiña forma bosques en las zonas más altas de Sudamérica y crece sin problemas a más de 4500 msnm. Encontrándose en Bolivia desde los 2100 msnm hasta los 5200 msnm. Los bosques de k'ewiña poseen una alta capacidad para almacenar agua en los suelos donde se desarrollan. En la región fitogeográfica andina de Bolivia, el género Polylepis se encuentra distribuido con cinco especies y ocho subespecies en las subregiones yungueña y puneña, según la altitud y el ombrotipo (Navarro 1997).
Estos bosques de Polylepis se desarrollan sobre laderas con pendiente moderada a fuerte, en suelos pedregosos, algunas veces profundos y fértiles debido a la materia orgánica aportada por estos mismos árboles.
La k'ewiña es empleada como leña, carbón, mangos para herramientas, construcciones rústicas. Así mismo esta especie es usada de modo medicinal, forraje para el ganado caprino y ovino, dado que incorpora gran cantidad de materia orgánica y como tiene gran capacidad de penetración y expansión de sus raíces es usada en la protección de cuencas hidrográficas. Se propaga mediante semillas, presentando un porcentaje de geminación muy bajo de 5 a 8 %. Debido a su difícil propagación sexual se ha realizado la validación de protocolo de introducción y establecimiento, la cual muestra ser una alternativa favorable para la especie, con niveles de multiplicación adecuados y que garanticen las condiciones fitosanitarias.
Materiales y métodos
Ubicación
El presente trabajo se realizó en el Laboratorio de Biotecnología y cultivo de tejidos del Centro Nacional de Innovación Toralapa - INIAF, carretera antigua a Santa Cruz km. 73, provincia Tiraque del Departamento de Cochabamba. La metodología empleada para el desarrollo del presente trabajo de investigación fue aplicada en la siguiente secuencia:
Metodología
Fase 0: Selección del material vegetal
Se realizó la Colecta del material vegetal de kewiña (Polylepis besseri, Hieron)de la comunidad de Puca Puca del municipio de Tiquipaya del Departamento de Cochabamba. De las cuales se identificó 16 accesiones de las cuales se obtuvo el material vegetal se sacaron 5 varetas de 20 cm. Aproximadamente por accesión.
Fase 1: Establecimiento
Paso 1: Desinfección fuera de cámara de flujo laminar.
Se lavó las muestras con detergente líquido comercial con un cepillo y realizar varios enjuagues hasta que quede libre de tierra.
Se realizó cortes pequeños aproximadamente de 5 cm de largo, colocando en un recipiente y aplicar, fungicida (captan) por 20 min.
Se trasladó a la cámara de flujo laminar.
Paso 2: Desinfección dentro de cámara de flujo laminar.
Se coloco las muestras en hipoclorito de sodio al 3% más tween 20, por 3 y 6 minutos.
Se enjuagaron 3 veces con agua destilada, las 2 primeras por 2 minutos y el último enjugue en ácido cítrico por la oxidación.
Se hizo el establecimiento correspondiente.
Se llevó a la cámara de crecimiento Con un fotoperiodo de 16 horas luz y 8 de oscuridad a una temperatura de 22-24°C.
El cuadro 1 se observan los dos tiempos de 3 – 6 minutos con hipoclorito al 3 %, que se usó para la desinfección del material vegetal.

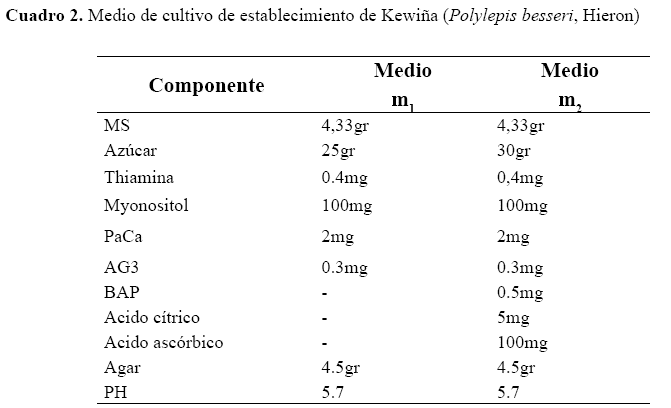
De esta manera los tratamientos obtenidos fueron los siguientes:
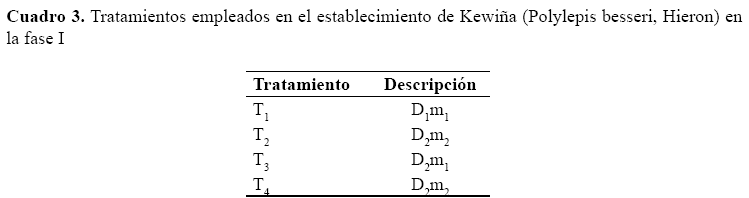
Fase 2: Multiplicación

Para este tratamiento se partió con 18 explantes del tratamiento de la fase 1 que es el tratamiento T4 (D2m2)
Donde; D- desinfección, m- medio de cultivo de fase 1, M - medio de cultivo de multiplicación.

Diseño experimental y análisis estadístico
Tanto para la fase I como II, el diseño empleado fue una distribución completamente aleatoria para el análisis estadístico debido a la relación de medias y varianzas, características de distribuciones de Poisson E(y)=V(y)=(V)=n (Devore, 2012), se ha empleado el modelo lineal generalizado bajo la distribución de Poisson mediante el programa Infostat-R, el modelo de análisis estadístico para la Fase I fue el siguiente:
ηij=E[y]=η+ τi
Donde; ηij = conteo observado en una unidad experimental que recibió el i-ésimo tratamiento, τi = efecto fijo del i-ésimo desinfectante y medio de cultivo.
Resultados
Fase I
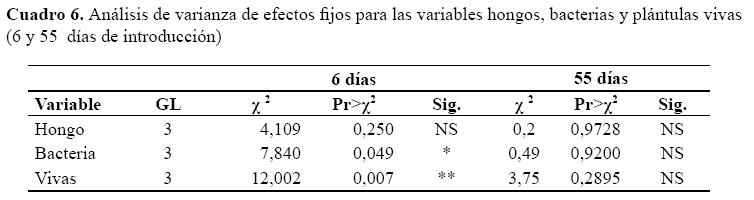
De acuerdo a la prueba de X2 bajo el modelo lineal generalizado, se evidencian efectos significativos entre los tratamientos en el conteo de bacterias y plantas vivas a los seis días de establecimiento (P<0,05), por otro lado para el conteo de plantas con presencia de hongos no se detectan diferencias estadísticas (P>0,05), las medias de cada tratamiento se presentan en el cuadro 7 y figura 1.
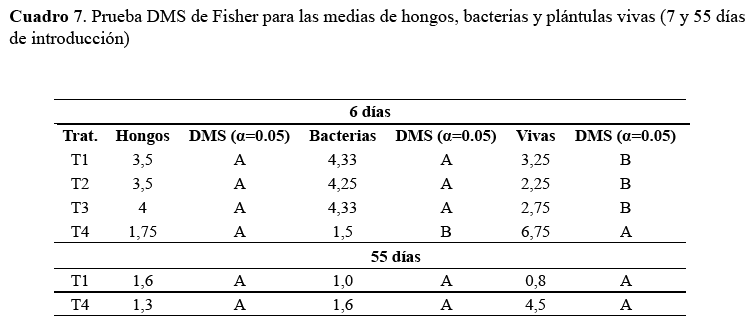
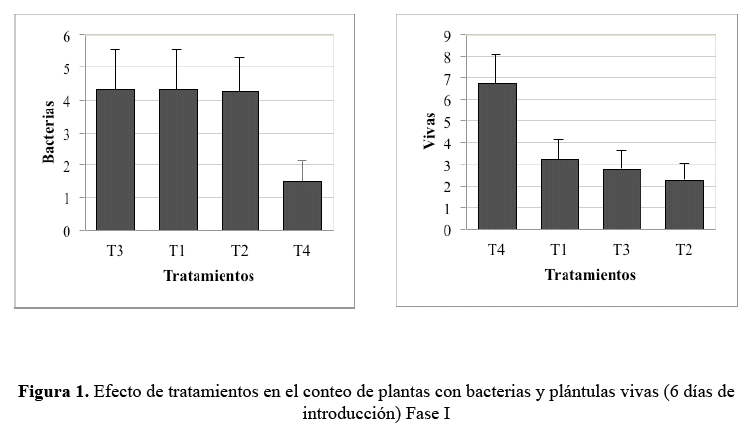
En cuanto a la segunda evaluación si bien los resultados favorecen a T4, no se obtiene significación estadística (P>0,05), se atribuye al bajo número de observaciones producto de la muerte de plántulas in vitro para los tratamientos T1, T2 y T3. Para T4, las medias en plántulas con hongos y bacterias y plántulas vivas se han mantenido similares a resultados de la primera evaluación (Cuadro 7).
En la figura 1 se puede observar que la incidencia de bacterias es menor en el tratamiento T4, por lo tanto es el que tiene mayor plántulas vivas, de acuerdo a los resultados obtenidos se determina que la mejor desinfección es con hipoclorito de sodio al 3 % durante 6 minutos, el mejor medio de cultivo de establecimiento es el medio 2 ya que presento mayor viabilidad y menor contaminación y oxidación.

Fase II

En el cuadro 8. se observa que con el medio 1 se tuvo una baja tasa de multiplicación porque se llegaron a vitrificar las plántulas por el alto contenido de BAP.
Se observó que el medio 2 que contenía 1.5 de BAP fue el medio más adecuado en la etapa de multiplicación ya que tuvo una buena respuesta de brotación, siendo el mejor tratamiento el T6 ya que obtuvo la mayor de tasa de brotación. La tasa de multiplicación se evaluó en todos los tratamientos y la tasa más elevada fue de 1:5 lo cual significa que de un brote de plántula se observaron 5 nuevas plántulas las evaluaciones se hicieron a los 30 días después de la primera multiplicación.
En la multiplicación de explantes no es suficiente solamente conseguir elevadas tasas de multiplicación, lo esencial es conseguir también calidad y homogeneidad de las partes producidas, tal como aseveran Pierik (1990) y Torres & Ferreira (1997) aspecto que además determina en gran parte el éxito de la siguiente etapa de enraizamiento.

Conclusiones
Fase 0 se recolectaron 16 accesiones de Kewiña (Polylepisbesseri, Hieron), de cada una se colectaron 5 varetas cada una de 20 cm aproximadamente.
Fase I Se determinó el mejor tiempo de desinfección y el mejor medio de cultivo para el establecimiento de kewiña (Polylepis besseri, Hieron) la cual fue el T4 (D2m2). De la cual se obtuvo después de todo el proceso de desinfección y establecimiento de un total de 40 vitroplantas, 18 plantulas vivas, 11 contaminada con bacteria y 11 contaminada con hongo.
Fase II. Como resultado de la fase I el T4 (D2m2) como el mejor se trabajó con los 18 explantes y se realizó la comparación con 2 medios de cultivo de multiplicación, T6 (D2m2M2) que tuvo una tasa de multiplicación de 1 a 5 teniendo 45 plántulas vivas.
Referencias citadas
BASFOR. 2002. Fichas técnicas de especies forestales. Escuela de Ciencias Forestales. Universidad Mayor de San Simón. COSUDE. Cochabamba, Bolivia. [ Links ]
Devore, J. 2012. Probabilidad y Estadística para Ingeniería y Ciencias. Octava Edición. CENCAGE-Learning. México D.F.
Navarro, G. 1997. Revista boliviana de ecología y conservación Ambiental No. 2. Cochabamba, Bolivia.
Pierik, M. R. 1990. Cultivo in vitro de las plantas superiores. 3ra ed por Eyerbe y Agasta, edit. Mundi Prensa Madrid España.
Torres, A.C & T.A. Ferreira.1997. Medio de cultivo: Curso de sistemas de micropropagación de plantas.
Torres A.C. Empresa Brasilera de pesquisa Agropecuaria. Centro Nacional de Pesquisa de Hortalizas. Ministerio de Agricultura y Abastecimiento. Ministerio de Ciencia y tecnología. [ Links ]












