Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Científica Agrociencias Amazonía
Print version ISSN 2307-9606
Rev.Cient.Agro.Amaz. no.3 Beni May 2014
ARTICULO
Analisis de expresion genica en tabaco trnsgenico expresando
molecula señal de defensa
Araujo-Burgos T.1 y Rao R.2
1 Laboratorio de Biotecnología Vegetal, Carrera de Ingeniería Agronómica, Universidad Autónoma del Beni 'José Ballivián', Trinidad, Bolivia.
Correo de contacto:agrotania@gmail.com
2 Departamento de Ciencias del Suelo, de la Planta, del Ambiente y de la Producción Animal,
Universidad de los Estudios de Nápoles Federico II, Nápoles, Italia
Resumen
Las moléculas señal juegan un rol importante en diferentes aspectos de la planta desde el crecimiento hasta la respuesta a algún tipo de estrés. Unadelasmejorestudiadaseslasistemina, molécula encontrada en el tomate la cual es liberada a partir de su precursor prosistemina como consecuencia de daño mecánico o ataque de insectos. Es la señal primaria para la defensa sistémica y un potente activador de la vía de los octadecanoides que genera ácido jasmónico y provoca la activación de varios genes defensivos de la planta. Para estudiar el papel de la prosistemina en la activación de genes de defensa del tabaco, se analizaron plantas transgénicas, la línea MZ119 con la expresión del ADNc de la prosistemina y PRx56 expresando una prosistemina incompleta sin la porción que codifica para la sistemina, en orden de evaluar la probable función de la terminal N del precursor. El análisis de expresión génica de las plantas se realizó mediante RT-PCR en Tiempo Real, el cual mostró que la prosistemina afecta la expresión de algunos genes relacionados con la defensa y el estrés (HSP, GST, Pin II y TobHypSys) similar en ambos transgénicos excepto para GST, indicando que la terminal N del precursor es también activa. Además, el nivel de sobre-expresión inducido por la prosistemina es similar al efecto del daño mecánico para HSP y Pin II. Incluso se demostró que las plantas transgénicas PRx56 presentaban resistencia moderada al ataque de Botritys cinerea. Todo esto sugiere que, la acumulación constitutiva del precursor de una molécula señal como la prosistemina, está asociado a cambios inesperados en la expresión de genes del tabaco.
Palabras claves: prosistemina, sistemina, genes de defensa
Abstract
Signal molecules play an important role in different plant aspects from plant growth until stress responses. One of the best known is the systemin, a molecule isolated from tomato which is released from its precursor prosystemin in response to herbivore attacks. It is the primary signal for systemic defense and also a potent activator of the octadecanoid pathway that generates jasmonic acid and provokes the activation of many plant defensive genes. In order to study the role of the prosystemin in the activation of defense genes in tobacco, transgenic plants were analyzed: MZ119 line expressing the full-length prosystemin cDNAand also PRx56 line expressing the deleted prosystemin missing the systemin encoding exon, to evaluate a possible function of the precursor N-terminal. Real time RT-PCR was used for the gene expression analysis in the transgenic tobacco plants. The analysis showed that prosystemin affects the expression of some stress and defense-related genes (HSP, GST, Pin II and TobHypSys) similar in both transgenic plants but GST, suggesting that the N-terminal is also active. Furthermore, the over-expression level induced by prosystemin of HSP and Pin II was similar to the effect of wounding. Then, a bioassay with the pathogenic fungus Botrytis cinerea showed a moderate resistance in the PRx56 tobacco plants. All these data imply that the constitutive accumulation of a signaling molecule precursor, such as the prosystemin, is associated with unexpected gene expression changes in tobacco.
Key words: prosystemin, systemin, defense genes
INTRODUCCION
Las plantas y los insectos han generando diversas interacciones que pueden ser beneficiosas o antagonistas, en particular implica la depredación de la planta por parte de los insectos fitófagos y la respuesta de defensa de ésta; los mecanismos de defensa de la planta pueden ser de diversos tipos, así se tiene la defensa directa, donde la planta reacciona influenciando la fisiología de los insectos fitófagos y su comportamiento. Esta puede ser a su vez de naturaleza mecánica (espinas, dureza tegumental, secreción de resinas y otros) o bioquímica que consiste en la síntesis de compuestos que entorpecen los procesos digestivos y de absorción de los nutrientes, lo que compromete el crecimiento y desarrollo de los fitopatógenos (Chen etal., 2005; Felton, 2005).
La sistemina es un péptido de 18 aminoácidos presente en el tomate y es una molécula señal liberada mediante acción proteolítica de su precursor, prosistemina (Figura 1); está involucrada en la respuesta local y sistémica inducida por la masticación de herbívoros y es un poderoso activador de la vía de los octadecanoides (Pearce etal., 1991; Ryan, 2000).
Cuando la sistemina se libera por inducción de insectos fitófagos, una compleja cascada de eventos se inicia en la membrana plasmática de plantas de tomate. La cascada termina con la activación de una fosfolipasa (PLA2), la cual libera acido linoléico, suministrando el sustrato para el primer paso de la vía de los octadecanoides (Ryan, 2000). Esta vía biosintética es la mejor caracterizada, iniciándose con la presencia de acido linoléico hasta la síntesis de acido jasmónico, una señal clave para la activación de genes de defensa en diversas especies de plantas (Walling, 2000; Stenzel et al., 2003). Sin embargo, el gen que codifica para sistemina no se ha encontrado en monocotiledóneas, lo cual sugiere que en dicotiledóneas el mecanismo de respuesta es más específico (Fürstenberg-Hägg etal., 2013).
Homólogos de la sistemina no se identificaron en tabaco, pero se aislaron dos péptidos ricos en hidroxiprolina, TobHypSys I y II (Pearce et al., 2001), que a pesar de que no comparten similar estructura con la sistemina del tomate, mostraron tener función parecida a ésta y un modo de acción relacionado con la vía de los octadecanoides (Ryan y Pearce, 2003) por lo que se denominaron sisteminas endógenas del tabaco. Ren y otros (2008) demostraron que estas proteínas inducían la síntesis de proteínas defensivas, activadas por la masticación. Sin embargo, un análisis proteómico en hojas de plantas de tabaco transformadas con el ADNc de prosistemina de tomate, mostró una acumulación de en cantidad y número de proteínas, las cuales estaban relacionadas con el estrés ambiental, estrés oxidativo y defensa contra patógenos (Rocco et al. 2008). También Malinowski y otros (2009) reportaron que un cultivo de células en suspensión provenientes de tabaco respondía positivamente a la sistemina.
Para estudiar el papel de la prosistemina de tomate en tabaco como promotor de los genes de defensa endógenos, además evaluar si el transgen modifica la resistencia contra estrés biótico y describir la posible función de la terminal N de la prosistemina en el mecanismo de señal, se analizaron plantas transformadas de tabaco. Así, se seleccionaron las líneas transgénicas MZ119 (expresando el ADNc de la prosistemina) y PRx56 (expresando una prosistemina incompleta sin el exón que codifica para la sistemina), ambas con una simple inserción del transgen.
MATERIALES Y METODOS
Aislamiento y control de ADN genómico.
Para aislar el ADN genómico, se usaron 100 mg de tejido foliar que fue congelado y molido en nitrógeno líquido, luego se usó el kit DNeasy Plant Mini Kit (Qiagen) según las instrucciones del producto. Después, el ADN genómico se cuantificó comparándolo con un ADN Lambda (Promega) de concentración conocida y se observó mediante electroforesis en gel de agarosa al 1 % matizado con bromuro de etidio.
La amplificación del ADN mediante PCR (Reacción en Cadena de la Polimerasa) se realizó en un volumen de 50 ul, compuesto por 25-100 ng de ADN; 0,4 uM de primers; 1,5 mM MgCl2; 100 uM dNTPs y 1U de la enzima Taq ADN Polimerasa en buffer 1X para PCR (Promega). En la tabla 1 se muestran los primers específicos utilizados para la amplificación de los genes de prosistemina de tomate. Las reacciones de PCR se efectuaron en el equipo Mastercycler Gradient (Eppendorf), utilizando los ciclos termales indicados en la tabla 1. Todos los productos de las amplificaciones se sometieron a electroforesis y se observaron en gel de agarosa al 2 % teñido con bromuro de etidio.
Aislamiento y control de ARN total. El ARN total fue aislado de 0,5 g de tejido foliar, congelado inmediatamente en nitrógeno líquido. Se utilizó el método estándar de extracción de ARN con fenol/cloroformo previamente descrito (Araujo-Burgos y Rao, 2013) hasta obtener 42 ul de solución de ARN total. Para controlar la cantidad y calidad del ARN, se utilizó un espectrofotómetro (Eppendorf Biophotometer), se diluyeron 2 ul de ARN 1:100 y su concentración se midió a 260 nm de longitud de onda. Además, la pureza del ARN se verificó mediante la relación A260/A280 y su calidad mediante electroforesis en gel de agarosa al 1,2 % con solución buffer desnaturalizante (400 ul formamida; 120 ul formaldehido; 80 ul TAE al 1 %; 1,2 ul bromuro de etidio; 20 ul Loading Dye 6X). Cuatro ug de ARN total mezclados con 20 ul del buffer se incubaron a 65°C por 2 min y se procedió a la electroforesis para visualizar las bandas de ARN. Verificada la calidad del ARN total, 10 ug de ARN total se trataron con la enzima RNase-free DNase I (BioLabs) según instrucciones del producto. Después se recuperó el pellet de ARN mediante precipitación con 10 volúmenes de NaAc 3M (pH 7,0) y dos volúmenes de etanol al 96 %, se enfrió la solución a -80°C por 10 min y se centrifugó a 14000 rpm por 15 min a 4°C. Obtenido el pellet, se lavó con un volumen de etanol al 70 %, se enfrió nuevamente a -80°C por 10 min y se centrifugó a 14000 rpm por 10 min, para finalmente resuspender el pellet de ARN en 20 ul de agua.
Transcripción inversa y análisis RT-PCR. Para la transcripción inversa se usaron 2 ug de ARN; el primer filamento de ADNc (ADN complementario) fue sintetizado con ayuda del kit RevertAidTM First Strand cDNAsynthesis kit (Fermentas), siguiendo las recomendaciones del fabricante. La calidad de la síntesis se comprobó mediante RT-PCR (Reverse Transcription - PCR) con los primers Elongation Factor 1-alpha (EF-1a) para Nicotiana tabacum (tabla 1), diseñados para anillarse en la zona inicial del gen del mismo nombre y entre dos exones consecutivos, con el fin de detectar errores de síntesis o presencia de ADN. Los primers utilizados para controlar la transcripción de los transgenes se indican en la tabla 1. La reacción para RT-PCR se preparó en 25 ul conteniendo 1 ul deADNc; 0,4 uM primers; 1,5 mM MgCl2; 100 |jM dNTPs y 0,5 U Taq ADN Polimerasa (Promega) en buffer 1X para PCR (Promega). Se realizaron 30 ciclos de amplificación en la termocicladora Mastercycler Gradient (Eppendorf), según el ciclo termal para cada par de primers y con el largo de amplicón correspondiente (tabla 1). Los productos de amplificación se observaron por electroforesis.
Análisis de expresión génica. La expresión génica se analizó mediante RT-PCR en Tiempo Real en el equipo 7900 Fast Real-Time PCR System (Applied Biosystem), procedimiento reportado anteriormente (Araujo-Burgos y Rao, 2013). Se hicieron tres réplicas biológicas por genotipo y tres repeticiones para cada evento de amplificación. Los primers específicos para el análisis de la expresión génica se indican en la tabla 2. El ciclo termal inició con 50°C por dos min y 95°C por cuatro min, luego 40 ciclos de 95°C por 15 segundos y un min a la temperatura de anillamiento (Ta) igual a 58°C para todos los primers. Además de las curvas de amplificación también se generaron las curvas de disociación en donde un simple pico agudo indica una amplificación específica, en tanto el pico se forma en el valor de Ta indicado para cada par de primers. La disociación se dió a 95°C por 15 segundos, 58°C por 15 segundos y una desnaturalización lenta a 95°C por 15 segundos. Los productos de amplificación también se controlaron por electroforesis (no mostrado) según el largo de amplicón reportado en la tabla 2.
Los datos se analizaron con el 7900HT Sequence Detection Systems Software, versión 2,3 (Applied Biosystem) y para realizar la cuantificación relativa de los genes se utilizó el Método Comparativo de Ct con la formula 2"AACt (Livak y Schmittgen, 2001). El gen Elongation Factor 1-alpha de N. tabacum fue el gen endógeno de referencia utilizado para normalizar los niveles de expresión de los genes objetivo en tabaco (Rotenberg et al., 2006) debido a que este gen demostró un nivel consistente de expresión en todas las muestras y en cada tratamiento. El genotipo no transformado (plantas NN) fue establecido como calibrador para realizar la cuantificación relativa de los genes en estudio. Los primers se diseñaron con ayuda del Primer Express 2,0 Software (Applied Biosystems) y se eligieron productos de amplificación pequeños, para incrementar la eficiencia de la PCR.
Material vegetal y condiciones de crecimiento.
Semillas provenientes de plantas transformadas (líneas MZ119y PRx56) y plantas no transformadas de tabaco (Nicotiana tabacum) cv Samsun (NN), se sembraron en recipientes conteniendo el medio MS30 agar (4,3 g mezcla de sales Murashige & Skoog con vitaminas, 30 g sacarosa, 8 g micro agar en 1 litro, pH 5,8), para las plantas transgénicas se adicionó 100 ug/mL de canami-cina y así seleccionar transformantes positivos homocigotos. Las plantas se cultivaron en cámara de crecimiento a 25°C, en semioscuridad los cinco primeros días y después de la germinación con 16 horas de fotoperiodo. Cuando las plantas tuvieron cuatro hojas, se transfirieron a suelo estéril y se cubrieron con cápsulas plásticas para simular las condiciones in vitro, para luego ser descubiertas paulatinamente. En los experimentos se utilizaron plantas de cuatro y cinco semanas de edad y para la extracción de ADN y ARN hojas de la porción media de la planta.
Tratamiento con daño mecánico. Hojas de plantas no transformadas de cuatro semanas de edad se cosecharon, congelaron en nitrógeno líquido y conservaron a -80°C hasta ser procesadas. En seguida, al resto de las hojas se les provocó daño mecánico con aguja de disección, rasgándolas seis veces a lo largo de la vena principal. Seis horas más tarde, tiempo reportado por Ren y otros (2008) para la respuesta al daño mecánico, las hojas dañadas se cosecharon en nitrógeno líquido y luego se extrajo el ARN total.
Bioensayo de resistencia a hongos fitopató-genos. Se usaron plantas de tabaco de cinco semanas de edad, cuatro plantas por genotipo. Botrytis cinerea se obtuvo del Laboratorio de Fitopatología de la Facultad de Agraria de la Universidad de Nápoles 'Federico II'. El hongo se inoculó con 20 ul de 106 esporas/mL en placas petri con Papa Dextrosa Agar y luego se incubaron a 25°C por 10 días hasta la esporulación. Después, se recolectaron las esporas lavando las placas con 8 mL de agua estéril. La concentración de esporas se determinó al microscopio con una cámara de recuento Bürker. La suspensión de esporas (106 esporas/mL) se preparó en buffer de germinación (glucosa 20 mM y KH2PO4 20 mM) y se usaron 10 ul para inocular las hojas entre las nervaduras, cuatro puntos por hoja. Las plantas se dejaron en cámara de crecimiento a 25°C, humedad relativa 90 % y 16 horas de fotoperiodo. El área lesionada se midió a los 4, 6 y 8 días después de la inoculación.
Análisis estadístico. Los datos obtenidos en todos los experimentos se analizaron, ya sea mediante one-way ANOVA, seguido por Tukey HSD post-hoc-test para comparaciones múltiples y en caso de dos poblaciones con el t-test. Todos los análisis estadísticos se realizaron con el software SPSS, versión 16,0.
RESULTADOS Y DISCUSION
Caracterización molecular de las líneas transgénicas de tabaco. La presencia de los transgenes en el ADN genómico de tabaco se controló mediante PCR visualizado en gel de agarosa (no mostrado). Luego, para el control de la transcripción por RT-PCR, se aisló el ARN de hojas de tabaco y se evaluó su calidad y concentración. Un ejemplo de electroforesis del ARN total utilizado para el análisis de RT-PCR se muestra en la figura 2.
Luego de la síntesis de ADNc (ADN complementario) a partir de ARN, se verificó la calidad del proceso mediante RT-PCR con un par de primers (NT-EF forward y reverse) que anillan al inicio de la secuencia transcrita del gen Elongation Factor 1-alpha (EF1-a) gen que contiene 1671 bp (pares de bases) y dado que la síntesis deADNccomienza en la terminal 3', entonces su uso evidencia que la retro-transcripción produjo filamentos largos. Asimismo, estos primers se diseñaron para anillarse sobre dos exones consecutivos y así detectar ADN contaminante, el ADNc genera un fragmento de 422 bp y un fragmento mayor es producido por la amplificación de ADN genómico, tal como se observa en el ejemplo de electroforesis en gel de agarosa del RT-PCR con los primers NT-EF (figura 3).
Para el control de la transcripción de los trans-genes, las líneas MZ119 (expresando la prosistemina completa) y PRx56 (con la prosistemina mutada) se analizaron por RT-PCR usando los primers indicados en la tabla 1, los primers Sysdel (amplicón de 208 bp) que se anillan en ambos transgenes (figura 4) y los primers Prosys (amplicón de 110 bp) para distinguir las plantas con el ADNc de la prosistemina completa (no mostrado).
Las dos líneas transgénicas no mostraron ninguna diferencia fenotípica evidente con las plantas no transformadas (figura 5), la expresión de ambos transgenes no afecta el fenotipo de la planta.
La prosistemina afecta la expresión de algunos genes relacionados con mecanismos de defensa de la planta. En el análisis de expresión génica, las plantas no transformadas (NN) se establecieron como calibrador del sistema y tomaron un valor arbitrario de RQ = 1. Así, la cuantificación relativa (RQ) de los genes objetivo se calcularon en comparación al calibrador y se determinó si su expresión aumentaba o disminuía en los genotipos transgénicos. Los productos de la amplificación se controlaron en gel de agarosa (dato no mostrado) y todos los fragmentos se correspondíeron el largo del amplicón esperado (tabla 2). Las curvas de disociación también confirmaron este resultado, ya que indicaban un solo producto amplificado para todos los genes (dato no mostrado) y la Ta experimental coincidía con la Ta calculada en la tabla 2.
Se evaluaron tres genes relacionados con la defensa, calmodulina (CaM), lipoxigenasa1 (Lox1) e inhibidor de proteasas II (Pin II), todos ligados a la vía de los octadecanoides, con CaM y Lox1 presentes al inicio de la vía y Pin II al final de la cascada de eventos. Luego, los genes RNA-binding protein (RBP), heat-shock protein (HSP), stromal ascorbato peroxidasa (SAP) y glutatión S-transferasa (GST), todos relacionados con la respuesta al estrés de la planta e identificados mediante análisis proteómico (Rocco etal., 2008).
Finalmente se analizó la expresión de las prosisteminas endógenas de tabaco conocidas como glicopéptidos ricos en hidroxiprolina (TobHypSys I y II) para verificar una posible activación cruzada entre especies.
Los resultados de la cuantificación relativa de todos los genes se reportan en la tabla 3, los dos genes que se activan en respuesta al ataque de insectos, CaM y Lox1 no mostraron diferencias en el nivel de expresión de las plantas transgénicas comparadas con el control. Sin embargo, en un estudio anterior, en donde se expresó la prosistemina de tomate en papa, se obtuvo un incremento once veces mayor en la expresión de Lox3 (Araujo-Burgos y Rao, 2013). Por otro lado, el gen para inhibidores de proteasas Pin II reportó una expresión tres veces mayor en ambas plantas transgénicas con diferencias significativas, este gen codifica para una proteína que inhibe la función de las proteasas en insectos dificultando su digestión. Estos datos coinciden con Ryan y Pearce (2003) que reportaron que la sistemina provoca una activación sistémica de genes de defensa mediante la amplificación de ácido jasmónico.
Igualmente, el gen GST involucrado en el estrés oxidativo y en mecanismos de desintoxicación celular como la eliminación de sustancias nocivas, y el gen HSP involucrado en la respuesta al estrés ambiental, ambos aumentan su expresión en plantas transgénicas (tabla 3), este resultado concuerda con el estudio proteómico de Rocco y otros (2008) quienes encontraron que plantas de tabaco expresando el gen prosistemina mostraban un gran número de proteínas relacionadas con la defensa de la planta y el estrés oxidativo. Al respecto, Scarpeci y otros (2008) afirman que la expresión de HSP se incrementa cuando las células son expuestas a altas temperaturas u otro tipo de estrés.
Sin embargo, los genes RBP y SAP no muestran cambios en el nivel de expresión. Además se puede ver que las dos líneas transgénicas MZ119 y PRx56 presentan una expresión génica similar en tres genes, pero es diferente para GST, esta diferencia sugiere que la terminal N de la prosistemina podría influir de algún modo en tabaco, específicamente para sobre-expresar este gen (tabla 3).
En la cuantificación relativa de las prosisteminas endógenas de tabaco (TobHypSys I y II) ambos genes con secuencias muy similares por lo que se analizaron en conjunto, se observó una sobre-expresión en las líneas transgénicas (tabla 3) en relación a las plantas no transformadas (p<0,05). Al respecto se sabe que, los precursores TobHypSys I y II son inducidos por masticación de herbívoros y juegan un rol importante en el mecanismo de defensa de la planta (Rocha-Granados et al., 2005; Ren et al., 2008). También se reportó que plantas de tabaco sobre-expresando el precursor TobHypSys-A presentaban resistencia a Helicoverpa armigera a través de la inducción de inhibidores de proteasas y polifenol oxidasa (Ren y Lu, 2006).
En general, los datos indican que la expresión de la prosistemina de tomate en tabaco, aumenta la transcripción de genes relacionados con el estrés y con la defensa de la planta. Tales efectos se verifican en ambas líneas transgénicas, sin embargo se pudo observar una diferencia en el gen GST, lo cual sugiere que la terminal N del precursor también podría contribuir a la activación de algunos genes y que la respuesta no obedece solamente a la liberación del péptido sistemina. Por último, es difícil especular si tal activación de TobHypSys en el tabaco transgénico es un efecto directo de la expresión de la prosistemina o es una respuesta del tabaco a la activación de genes relacionados con el estrés. Los datos sugieren que las plantas de tabaco son capaces de procesar la prosistemina de tomate. De todos modos, la posible presencia de otros productos generados del procesamiento múltiple de este precursor, aún no ha sido investigada.
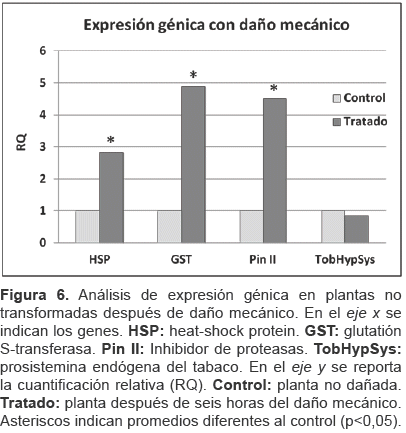
Los transgenes provocan un efecto parecido a la respuesta a daño mecánico. Para evaluar si los efectos provocados por la expresión de la prosistemina tenían relevancia biológica, se estudiaron los genes que mostraron sobre-expresión significativa en el análisis previo (HSP, GST, Pin II y TobHypSys). Así, se hizo el análisis de expresión génica después de seis horas de haber provocado daño mecánico, simulando la masticación en plantas no transformadas. El análisis mostró que los genes HSP, GST y Pin II se sobre-expresan después del daño mecánico (figura 6), por el contrario TobHypSys no fue diferente, esto podría ser explicado mediante la evidencia de que este gen alcanza su máxima expresión en hojas dañadas a las 24 horas (Ren et al., 2008).
Luego, se compararon los valores RQ del experimento con daño mecánico, simulando la masticación, en plantas no transformadas y los valores RQ de los genes sobre-expresados en plantas transgénicas (tabla 4).
Los genes HSP y Pin II mostraron un nivel de expresión similar en todos los tratamientos. Estos datos indican que los transgenes pueden provocar una alteración en el nivel de expresión parecido a la respuesta a daño mecánico (6 horas después) para algunos genes.
Resistencia mejorada contra Botrytis cinerea.
Como el análisis de expresión génica reportó sobre-expresión de genes relacionados con la respuesta de la planta a patógenos como GST y HSP, es así que se realizó un bioensayo de resistencia al ataque del hongo B. cinerea. En la figura 7 se muestra un ejemplo de hojas inoculadas con el fitopatógeno después de ocho días de incubación.
La figura 8 indica la lesión provocada por B. cinerea en los tres genotipos. Las líneas MZ y PRx presentaron un área de lesión menor que las plantas control NN, no obstante el análisis estadístico señaló que sólo la línea PRx56 presentaba diferencias significativas a los 4 y 6 días después de la inoculación (p<0,05). El área lesionada de las plantas PRx y MZ, a los 8 días no es diferente, mientras que MZ no es diferente a NN, en tanto PRx y el control NN si muestran diferencias significativas (p<0,05).
Los datos indican un incremento en la resistencia a B. cinerea en la línea PRx56, en tanto la diferencia entre MZ119 y las plantas control parece incrementarse con el tiempo, comportamiento que no pudo evaluarse en más puntos en el tiempo debido al significativo daño en las hojas.
CONCLUSIONES
El presente estudio demuestra que las plantas de tabaco que expresan una molécula señal como la prosistemina de tomate, tienen una modificación en la expresión de genes relacionados con la defensa de la planta, similar al efecto provocado por daño mecánico. Esto se confirma con la resistencia moderada mostrada por plantas transgénicas frente al hongo fitopatógeno B. cinerea. También, se reporta que la terminal N del precursor es activo, pero talvés con función diferente en tabaco que en tomate. Por último, la expresión de una molécula señal puede generar cambios inesperados en la expresión de genes y consecuentemente la producción de proteínas imprevistas en plantas transgénicas.
AGRADECIMIENTOS
Las autoras expresan su agradecimiento al Dr. Giandomenico Corrado por sus consejos invaluables durante todo el experimento y a la Dra. Micchelina Ruocco por su colaboración en el bioensayo con el hongo fitopatógeno.
REFERENCIAS BIBLIOGRAFICAS
Araujo-Burgos T. y Rao R., 2013. Expresion del gen prosistemina de tomate en papa (Solanum tuberosum). Agrociencias Amazonia Vol. 1(1): 11 -25.
Balandin T., van der Does C., Albert J.M., Bol J.F., Linthorst H.J., 1995. Structure and induction pattern of a novel proteinase inhibitor class II gene of tobacco. Plant Molecular Biology 27(6): 1197-1204. [ Links ]
Chen H., Wilkerson C.G., Kuchar J.A., Phinney B.S., Howe A.W., 2005. Jasmonate-inducible plant enzymes degrade essential amino acids in the herbivore midgut. Proceedings of the National Academy of Sciences, USA 102(52): 19237-19242.
Felton G.W., 2005. Indigestion is a plant's best defense. Proceedings of the National Academy of Sciences, USA 102(52): 18771-18772. [ Links ]
Fürstenberg-Hägg J., Zagrobelny M., Bak S., 2013. Plant Defense against Insect Herbivores. International Journal of Molecular Science 14: 10242-10297. [ Links ]
Kumagai F., Hasezawa S., Yohsuke T., Nagata T., 1995. The involvement of protein synthesis elongation factor 1 a in the organization of microtubles in the perinuclear region during the cell cycle transition from M phase to G1 phase in tobacco BY-2 cells. Bot. Acta 108: 467-473. [ Links ]
Livak K.L. y Schmittgen T.D., 2001. Analysis of relative gene expression data using Real-Time quantitative PCR and the 2"AACt method. Methods 25: 402-408. [ Links ]
Malinowski R., Higgins R., Luo Y., Piper L., Nazir A., Bajwa S.V., Clouse S.D., Thompson P.R., Stratmann J.W., 2009. The tomato brassinosteroid receptor BRI1 increases binding of systemin to tobacco plasma membranes, but is not involved in systemin signaling. Plant Mol. Biol. 70: 603-616. [ Links ]
McGurl B., Pearce G., Orozco-Cárdenas M., Ryan C.A., 1992. Structure, expression and antisense inhibition of the systemin precursor gene. Science 255: 1570-1573.
Naqvi S.M., Park K.S., Yi S.Y., Lee H.W., Bok S.H., Choi D., 1998. A glycine-rich RNA-binding protein gene is differentially expressed during acute hypersensitive response following Tobacco Mosaic Virus infection in tobacco. Plant Mol. Biol. 37(3): 571-576. [ Links ]
Park S.M. y Hong C.B., 1998. Comparison of the structure and expression pattern for a low molecular weight heat-shock protein cDNA clone from Nicotiana tabacum. Mol. Cells 8(5): 594-599 [ Links ]
Pearce G., Strydom D., Johnson S., Ryan C.A., 1991. A polypeptide from tomato leaves induces wound-inducible proteinase inhibitor proteins. Science 253(5022): 895-897.
Pearce G., Moura D.S., Stratmann J., Ryan C.A., 2001. Production of multiple plant hormones from a single polyprotein precursor. Nature 411: 817-820. [ Links ]
Ren F., Lu Y.T., 2006. Overexpression of tobacco hydroxyproline-rich glycopeptide systemin precursor A gene in transgenic tobacco enhances resistance against Helicoverpa armigera larvae. Plant Science 171: 286-292. [ Links ]
Ren F., Lian H., Chen L., 2008. TobpreproHypSys-A gene expression and defense protein activity in the tobacco wounding response. Journal of Plant Biology 51(1): 48-51. [ Links ]
Rocco M., Corrado G., Arena S., D'Ambrosio C., Tortiglione C., Sellaroli S., Marra M., Rao [ Links ]
R., Scaloni A., 2008. The expression of tomato prosystemin gene in tobacco plants highly affects host proteomic repertoire. Journal of Proteomics 71: 176-185. [ Links ]
Rocha-Granados C. del M., Sánchez-Hernández C. Sánchez-Hernández C., Martínez-Gallardo N.A., Ochoa-Alejo N., Délano-Frier J.P., 2005. The expression of the hydroxyproline-rich glycopeptide systemin precursor A in response to (a)biotic stress and elicitors is indicative of its role in the regulation of the wound response in tobacco (Nicotiana tabacum L.). Planta. 222: 794-810. [ Links ]
Rotenberg D., Thompson T.S., German T.L., Willis D.K., 2006. Methods for effective real-time RT-PCR analysis of virus-induced gene silencing. Journal of Virological Methods 138: 49-59. [ Links ]
Ryan C.A., 2000. The systemin signaling pathway: differential activation of plant defensive genes. Biochimica et BiophysicaActa 1477: 112-121. [ Links ]
Ryan C.A. y Pearce G., 2003. Systemins: a functionally defined family of peptide signals that regulate defensive genes in Solanaceae species. Proceedings of the National Academy of Sciences, USA 100: 14577-14580. [ Links ]
Scarpeci T.E., Zanor M.I., Valle E.M., 2008. Investigating the role of plant heat shock proteins during oxidative stress. Plant Signaling and Behavior 3(10): 856-857. [ Links ]
Stenzel I., Hause B., Mauncher H., Pitzschke A., Miersch O., Ziegler J., Ryan C.A., Wasternack C., 2003. Allene oxide cyclase dependence of the wound response and vascular bundle-specific generation of jasmonates in tomato-amplification in wound signalling. The Plant Journal 33: 577-589. [ Links ]
Takahashi Y. y Nagata T., 1992. ParB: an auxin-regulatedgeneencodingglutathioneS-transferase. Proceedings of the National Academy of Sciences, USA 89: 56-59. [ Links ]
Veronesi C., Fournier J., RickauerM., MaroldaM., Esquerre-TugayeM.T., 1995. Nucleotidesequence of an elicitor-induced tobacco lipoxygenase cDNA. Plant Physiology 108: 1342-1342. [ Links ]
Walling L.L., 2000. The myriad plant responses to herbivores. Journal of Plant Growth Regulation 19: 195-216. [ Links ]
YamakawaH., MitsuharaI., Ito, N.,SeoS., Kamada H., Ohashi Y., 2001. Transcriptionally and post-transcriptionally regulated response of 13 calmodulin genes to tobacco mosaic virus-induced cell death and wounding in tobacco plant. FEBS Journal 268(14): 3916-3929. [ Links ]
Yoshimura K., Yabuta Y., IshikawaT., Shigeoka S., 2000. Expression of spinach ascorbate peroxidase isoenzymes in response to oxidative stresses. Plant Physiology 123(1): 223-234. [ Links ]