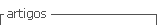Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares em SciELO
Similares em SciELO
Bookmark
Revista Ventana Cientifica
versão impressa ISSN 2305-6010
Rev. Vent. Cient. v.1 n.7 Tarija maio 2014
ARTICULOS ORIGINALES
Estudio del efecto modulatorio del
neuroesteroide \ allopregnanolona en la memoria en ratas hembras
Modulatory effect study of the allopregnanolone
neurosteroid in female rats memory
Camargo Arce Lorena1, Cabrera Ricardo Jorge2, Escudero Carla3
1 Docente Investigadora, Facultad de Medicina. Universidad Autónoma Juan Misael Saracho,
Tarija - Bolivia. 2Director Instituto de Investigaciones Biomédicas Universidad de Mendoza,
Mendoza - Argentina.
Investigadora Instituto de Investigaciones Biomédicas Universidad de Mendoza,
Mendoza -Argentina
Correo electrónico: Iorenacamargo22@gmail.com
Resumen
Los esteroides neuroactivos y neuroesteroides producen sensibilización a neurotransmisores modulando mecanismos implicados en aprendizaje y memoria, conducentes a cambios adaptativos comportamentales de los animales. El aprendizaje se considera una estrategia para obtener información sobre el entorno y sufre modulación por hormonas.
Objetivos: Estudiar efecto modulatorio del neuroesteroide Allopregnanolona sobre procesos neurofisiológicos del aprendizaje punitivo en ratas. Efectos de administración intrahipocampal de Allopregnanolona en ratas ovariectomizadas.
Con el test Step Down se valoró memoria evitativa en 44 ratas hembras Sprague Dowley, constituyendo 8 grupos, 20 ratas sometidas a control de ciclo estral y 24 ratas OVX con o sin estrógeno y progesterona; según los grupo recibieron allopregnanolona intrahipocampal 30 minutos antes del training y 24 horas después se realizó el test controlándose el tiempo de permanencia del animal en plataforma (tiempo de latencia).
La administración de estrógeno y progesterona tiene efecto amnésico en ratas OVX, los resultados sugieren que Alio podría tener un efecto mejorador de la memoria en ratas OVX impregnadas con E y P. Podría ser a través de la modulación de sistemas de receptores específicos, glutamatérgico y gabaérgico, lo cual sería fundamental en el control del aprendizaje, retención y la posterior evocación en el corto y largo plazo.
Palabras clave: Neuroesteroides, memoria, allopregnanolona.
ABSTRACT
Neuroactive steroids and neurosteroids produce sensitization to neurotransmitters modulating mechanisms implied in learning and memory, conducive to adaptative behavior changes of the animáis. Learning is considered a strategy to obtain information on the environment and it suffers modulation for hormones.
Objectives: To study modulatory effect of the Allopregnanolone (Alio) neurosteroid has more than enough neurophysiological processes of the punitive learning in rats. Effects of Alio intrahippocampal administration in ovarectomiced (OVX) rats.
With Step Down test of memory avoided was valued 44 Sprague Dowley female rats, in 8 groups, 20 rats for control of estral cycle and 24 rats OVX with or without estrogen (E) and progesterone (P); according to the group they received intrahippocampal Alio 30 minutes before the training and 24 hours later it was carried out the test being controlled the time of permanency of the animal in platform (latency time).
E and P administration has amnesic effect in OVX rats, the results suggest that Alio could have an improvement effect on memory in OVX impregnated with E and P. Could be through the modulation of systems of specific receivers, glutamatergic and gabaergic, that which would be fundamental in the control of learning, retention and the later evocation in the short and long reléase term.
Keywords: Neurosteroids, memory, allopregnanolone
ASPECTOS CONCEPTUALES DE LA MEMORIA
Aprendizaje y memoria
Aprendizaje y memoria son dos procesos cerebrales estrechamente relacionados que originan cambios adaptativos en el comportamiento de los organismos. Cuando aprendemos podemos utilizar al menos dos tipos de estrategias cognitivas. Una de ellas da lugar a la memoria implícita, un tipo de memoria inconsciente y rígida, que difícilmente se expresa en situaciones diferentes a la original. Es una memoria de hábitos que radica en las mismas regiones cerebrales que procesan la información sensorial y motora, principalmente la neocorteza y los ganglios básales. La otra estrategia cognitiva origina la memoria explícita o declarativa, una memoria consciente y flexible que puede expresarse en situaciones y contextos variados, diferentes a los del aprendizaje original. Es una memoria de carácter relacional, dependiente de la región del cerebro conocida como sistema hipocampal y basada en información almacenada en la corteza y otras regiones cerebrales (De Iceta, M 2002).
Contenidos de la memoria
Existen dos sistemas de procesamiento de la información: una memoria declarativa, dependiente fundamentalmente del hipocampo, versus una memoria no declarativa. Esta última consiste en habilidades que no requieren de la participación del hipocampo, pero sí de otras estructuras como el neoestriado en el caso de los hábitos y destrezas motoras, el cerebelo en el condicionamiento de la musculatura esquelética, la amígdala en el condicionamiento emocional y la neocorteza posterior en el caso priming (Passing, VC 1994).
Sólo la memoria declarativa puede tener una dimensión temporal (Memoria de corto y largo plazo), no así la no declarativa. En el caso de este último tipo de memoria, se produce un aprendizaje permanente en función de la práctica, el cual no se olvida más. La memoria episódica alimentaría a la semántica. Es decir, los conceptos serían la consecuencia de un sinnúmero de exposiciones a un determinado episodio (Passing, VC 1994).
Dimensión temporal de la memoria
La memoria estaría compuesta por 3 subsistemas. El primero frecuentemente denominado "memoria sensorial", involucra una serie de sistemas en paralelo. Luego la información es almacenada en un sistema temporal y de capacidad limitada (memoria de corto plazo), el cual controla el paso de la información hacia y desde el tercer componente, un almacenamiento permanente o de largo plazo (Passing, VC 1994).
Esta dicotomía memoria de corto/largo plazo también tiene una base neuroanatómica subyacente y estaría reflejando la participación de diferentes procesos neurales en el almacenamiento de la información (Passing, VC 1994).
Hipocampo y memoria
El hipocampo, situado en la parte medial del lóbulo temporal, constituye una estructura cerebral que juega un papel crucial en la memoria. Es necesario para la formación de memoria declarativa (explícita) estable en humanos, y el equivalente en roedores (memoria espacial, o relacional/contextual) (Passing, VC 1994).
El hipocampo se divide en tres estructuras:
Cuerno de Amón. En un corte coronal se distinguen cuatro componentes; de éstos, CA1 es vecino del subículo y CA4, del giro dentado (Castro-Sierra, E et al 2005).
Giro dentado (GD). Está en contacto con los cuatro componentes del CA y el prosubículo (Castro-Sierra, E et al 2005).
Subículo. Es una corteza transicional, la menos arcaica del hipocampo. Se divide en cuatro partes: prosubículo vecino a CA1, subículo, presubículo y parasubículo, vecino a la corteza entorrínica (Castro-Sierra, E et al 2005).
Existe consenso general de opinión en cuanto a que el papel fundamental del hipocampo es formar nuevas memorias (recuerdos) relativas a eventos experimentados (memoria episódica o autobiográfica). Algunos investigadores, sin embargo, prefieren considerar el hipocampo como parte de un sistema mayor de memoria lobular temporal medial responsable de la memoria declarativa. Esta memoria incluiría, además de la memoria episódica, la memoria de los acontecimientos. Otra función hipocámpica muy importante sería la de almacenar memorias semánticas o conceptuales (Castro-Sierra, E et al 2005).
Aprendizaje espacial
El hombre puede reconocer estímulos que ha visto antes, realizar asociaciones entre ellos e incluso orientarse de acuerdo con las relaciones que establece entre los estímulos. La mayoría de los animales también se orientan en el espacio para organizar sus conductas en relación con el entorno en que se encuentran en cada momento (Vicens, P et al 2003).
Los animales pueden utilizar diferentes tipos de señales para encontrar una meta, el tipo de estrategia depende de la naturaleza y relevancia de las claves disponibles (Vila J, Nieto J y Rosas JM 2003).
El interés por el aprendizaje espacial, que había decaído durante los años sesenta, se recuperó con la publicación de la teoría del mapa cognitivo de O'Keefe y Nadel en 1978. Estos autores superan la diferenciación tradicional entre aprendizaje de lugar y aprendizaje de respuesta, que engloban bajo la denominación de estrategias táxicas, y proponen una nueva estrategia independiente: la estrategia cartográfica (Vila J, Nieto J y Rosas JM 2003a).
Aprendizaje y memoria espacial se relacionan con la capacidad de adquirir y retener asociaciones de las características del ambiente, lo que permite al organismo desenvolverse en el espacio. La memoria espacial consiste en múltiples mecanismos especializados en codificar, almacenar y recuperar información acerca de rutas, configuraciones y localizaciones espaciales (Vicens, P 2003).
Estudios en vertebrados no primates realizados por 0 'Keefe, Olton y Sherry, apoyan fuertemente la participación del hipocampo en el comportamiento espacial y en el subsecuente recuerdo de la información espacial (De Iceta, M 2002).
Aprendizaje asociativo
El aprendizaje consiste en el establecimiento de asociaciones entre eventos. Estas asociaciones no sólo se establecen entre estímulos y respuestas, sino también entre varios estímulos, incluso, admite la posibilidad de asociaciones jerárquicas E-[R-E]. De este modo, cualquier evento puede asociarse con otro a condición de que sea un buen predictor de su posible aparición y el interés de los investigadores recae en la identificación de las reglas de error que rigen el establecimiento de estas asociaciones (Vila J, Nieto J y Rosas JM 2003a).
Aprendizaje aversivo
El advenimiento de la denominada neurociencia afectiva y su renovado interés por los aspectos motivacionales y emocionales implicados en los procesos cognitivos y el comportamiento, procesos tradicionalmente estudiados por los psicólogos del aprendizaje animal, han renovado el interés por el aprendizaje de evitación y sus relaciones con el miedo y la ansiedad (Vila J, Nieto J y Rosas JM 2003b).
El aprendizaje de evitación se define como el establecimiento de una contingencia negativa entre una determinada respuesta y una consecuencia aversiva, de forma que si el sujeto no emite dicha respuesta, se producirá la aparición de la consecuencia aversiva (El), mientras que la consecuencia no aparecerá si emite la respuesta de evitación (Vila J, Nieto J y Rosas JM 2003b).
Se ha reconocido a la amígdala como un componente clave en el control neural de los mecanismos de emoción y memoria (Gargiulo PA, Viana MB, Graeff FG, de Souza Silva MA and Tomaz C 1996). El núcleo acumbens recibe aferencias de la amígdala, hipocampo y corteza prefrontal, sus eferencias se dirigen al hipotálamo, sistema límbico y ganglios básales, por tanto está implicado en: aprendizaje, memoria, comportamiento espacial, comportamiento dirigido a una meta, motivación y memoria de trabajo (Gargiulo PA, Martínez G, Ropero C; Funes A, Landa Al 1999), que permite organizar la secuencia en la respuesta de evitación activada por un estímulo aversivo.
Modulación por neuroesteroides
Los neuroesteroides son una subclase de esferoides que pueden sintetizarse en el sistema nervioso central (SNC) de novo a partir del colesterol independientemente de las fuentes periféricas. Esferoide neuroactivo se refiere a esferoides que, independientemente de su origen, son capaces de modificar actividades neurales. Este término se propuso para todos los esferoides sintéticos y naturales que pudieran alterar rápidamente la excitabilidad de las neuronas mediante su unión al receptor de membrana de la misma manera cómo actúan los neurotransmisores excitadores o inhibidores (Martín-García E, Darbra S, Pallares M. 2007).
Esferoides y neuroesteroides son sintetizados del colesterol por la acción una serie de reacciones enzimáticas mediadas por enzimas P450 y no P450 (Mellon, SH and Griffin, LD 2002). De estas enzimas depende la producción en tejido nervioso o endocrino de los esferoides: pregnenolona (Preg), pregnenolona sulfato PregS), dehidroepiandrosterona (DHEA), DHEA sulfato (DHEAS), androstendiol, progesterona, 17 OH progesterona, 5a dihidroprogesterona, 3a, 5a tetrahidroprogesterona o Allopregnanolona (Allo), androstendiona, testosterona, estrona y estradiol (Mellon, SH and Griffin, LD 2002).
Dentro de los mecanismos de acción de los esferoides neuroactivos y neuroesteroides se incluyen las acciones genómicas y no genómicas, las acciones no genómicas han sido ampliamente estudiadas y ha sido demostrado que actúan a través de receptores de neurotransmisores, como los GABAA, NMDA, AMPA, kainatos y receptores sigma (Zheng, P 2009).
En la última década ha cobrado gran interés el estudio de los esteroides que actúan en el SNC, con el fin de prevenir, revertir o frenar el deterioro de la función neuronal. A consecuencia de sus múltiples mecanismos de acción, los esteroides neuroactivos pueden representar una aproximación terapéutica para el tratamiento de enfermedades asociadas al envejecimiento (Mellon, SH and Griffin, LD 2002).
Neuroesteroides en el aprendizaje y memoria
La acción de algunos neuroesteroides sobre la memoria se ha documentado ampliamente. Los neuroesteroides ejercen un rol muy importante en los procesos de aprendizaje y memoria, y la mayor parte de ellos son neuroprotectores (Pascual-Leone, AM y Medina, JM 2010).
La mayoría de estudios indican que neuroesteroides como Preg, DHEA, DHEAS y PregS son capaces de suprimir los déficit de memoria producidos de forma farmacológica o natural (en el caso del envejecimiento), también son capaces de inducir una mejora de la ejecución de la memoria en ratas jóvenes sin deterioro cognitivo (Martín-García E, Darbra S, Pallares M. 2007).
Dosis bajas de PregS inyectadas directamente en el hipocampo revierten el deterioro en la adquisición del aprendizaje provocado por la coadministración de alcohol y nicotina. Se ha sugerido que la acción promnésica producida por el PregS estaría relacionada con la modulación positiva de los receptores NMDA. En este sentido, el PregS bloquea los déficit en la retención inducidos por los antagonistas competitivos del receptor NMDA, D-AP5 y CPP en la tarea de evitación activa en el test en forma de Y y en la tarea de evitación pasiva, respectivamente (Martín-García E, Darbra S, Pallares M. 2007).
Otros autores han descrito que el PregS reduce la amnesia provocada por el etanol, lo que sugiere la importancia de la modulación negativa de los receptores GABAA por parte de la PregS, aunque el etanol también ejerce una modulación negativa sobre los receptores NMDA del glutamato.
Efectos: promnésicos de PregS y proamnéscos de Allo
De forma general, los neuroesteroides que son antagonistas del receptor GABAA pueden mejorar la memoria, mientras que los agonistas pueden producir deterioro cognitivo. Por ejemplo, la PregS inyectada en el núcleo basal magnocelular (NBM) produce una mejora, y la Alio, un deterioro de la memoria espacial en ratas. Consistente con este resultado también se ha visto que la administración intracerebroventricular (ICV) de Alio deteriora la memoria en ratas, mientras que la de PregS la aumenta. Estudios conductuales han demostrado efectos promnésicos de PregS en las pruebas de evitación pasiva (administración subcutánea) y activa (infusión ICV o local en la amígdala, el hipocampo, el septo o los cuerpos mamilares). Además, también se ha descrito que la administración intrahipocampal (IH) de PregS revierte la disfunción previa de memoria en el test de Morris y en el test del laberinto en Y en ratas viejas con deterioro cognitivo (Martín-García E, Darbra S, Pallares M. 2007).
Estos efectos facilitadores o disruptores de la memoria por parte de los neuroesteroides GABA- y GABA+, respectivamente, se deben con probabilidad a la acción moduladora que las neuronas gabaérgicas ejercen sobre el sistema colinérgico. En este sentido se ha descrito, utilizando la técnica de microdiálisis intracerebral, que las inyecciones ICV de PregS producen un aumento de la liberación de acetilcolina en las principales zonas de proyección del sistema colinérgico central, como por ejemplo en el neocórtex (área de proyección del NBM) y en el hipocampo (área de proyección del septo medial), pero no en las interneuronas colinérgicas del estriado. Tanto la vía que conecta el prosencéfalo basal con la corteza cerebral como la vía septohipocampal se han implicado en la regulación de los procesos cognitivos (atención y memoria), mientras que las interneuronas del estriado se han implicado en los procesos motores. También se ha demostrado que el aumento de los niveles de liberación de acetilcolina cortical inducidos por la infusión de PregS en el NBM correlaciona con la mejora en la ejecución de la memoria espacial en animales. Este efecto se atribuye, pues, a la disminución de la inhibición gabaérgica del NBM provocada por el PregS. De forma opuesta se ha visto que Alio ICV produce una disminución de la liberación de acetilcolina en el córtex (Martín-García E, Darbra S, Pallares M. 2007).
El estudio de los efectos promnésicos de los neuroesteroides implica determinar sobre qué procesos cognitivos actúan, si lo hacen sobre la adquisición, la retención o la recuperación de la información. Parece ser que, de forma general, los neuroesteroides facilitan los procesos de retención. En general, los neuroesteroides no son eficaces cuando se administran antes de la fase de adquisición, excepto en el caso de revertir el deterioro cognitivo inducido por determinados agentes farmacológicos. Una excepción podría ser la tarea de aprendizaje apetitivo, que se facilita en ratones macho después de la administración ICV de PregS (Martín-García E, Darbra S, Pallares M. 2007).
En cambio, se ha sugerido que el efecto negativo de los neuroesteroides GABA+ podía ser más exclusivo sobre los procesos de aprendizaje que sobre los de memoria, ya que la administración de Alio provoca una disminución del aprendizaje espacial en el test de Morris y en otras tareas de reconocimiento espacial cuando se inyecta antes de la sesión de adquisición, mientras que estos autores no encuentran efectos de inyecciones post adquisición (Martín-García E, Darbra S, Pallares M. 2007).
De todas formas, algunos estudios muestran que la administración de Alio puede deteriorar la memoria espacial sin afectar a la memoria no espacial (Martín-García E, Darbra S, Pallares M. 2007).
En los experimentos animales se ha demostrado que la administración sistémica de progesterona aumenta los niveles de sus metabolitos dihidroprogesterona y tetrahidroprogesterona en el cerebro (Pascual-Leone, AMy Medina, JM 2010).
Ciclo estral
Las ratas son poliéstricas continuas, el ciclo estral dura 4-5 días (Marcondes, F. K., Bianchi, F. J. and Tanno, A. P. 2001.
Fases del ciclo estral.
Variaciones de las hormonas sexuales durante las diferentes fases del ciclo estral de la rata Sprague Dawley.
Proestro
Dura aproximadamente 12 horas, los ovarios están en plena producción folicular, en el proestro temprano los niveles de estrógeno (E) son máximos y se mantienen elevados con una meseta hacia la mitad del estadio (Puerta, M 1994). Las paredes vaginales se engrasan, se tornan secas y comienzan a producir la cornificación de las células de la mucosa. El frotis vaginal muestra células grandes, redondeadas y con núcleo (Marcondes, F. K., Bianchi, F. J. and Tanno, A. P 2001).
Estro
Dura 9 a 15 horas. Se produce la ruptura del folículo ovárico y la subsecuente ovulación. Los E circulantes provocan el deseo de apareamiento. El estro se caracteriza por cambios conductuales en el animal. Aumenta la producción de FSH y LH en los 2 días siguientes. Al finalizar este estadio se encuentran los niveles séricos más bajos de E (Puerta, M 1994). Es el periodo de receptividad de la rata. En el frotis vaginal, a medida que el estro avanza, las células del proestro se convierte en informes, transparentes, descamadas y anucleadas (Marcondes, F K., Bianchi, F. J. and Tanno, A. P 2001).
Diestro 1
Se divide en dos etapas (Zheng, P 2009): La primera etapa (Metaestro I) dura 15 horas, se produce el pico de LH y la consecuente ovulación múltiple y espontánea (Marcondes, F K., Bianchi, F J. and Tanno, A. P. 2001). El pico de LH determina el final de la producción de E, hay formación de cuerpos lúteos, los que empiezan la producción de progesterona (P) (Puerta, M 1994).
La segunda etapa (Metaestro II) dura 6 horas, la vagina se ve húmeda y los óvulos liberados se encuentran en el oviducto. En el frotis, junto con las células descamadas aparecen células sanguíneas de la línea blanca (Marcondes, F. K., Bianchi, F J. and Tanno, A. P 2001).
Diestro 2
Dura 57 horas, en esta etapa temprana los niveles de E siguen en aumento. Los cuerpos lúteos producen abundante P (Marcondes, F K., Bianchi, F J. and Tanno, A. P 2001). Al finalizar este periodo, la P empieza a declinar desbloqueando la producción de FSH y LH, esto inicia nuevamente el ciclo con el desarrollo de nuevos folículos (Puerta, M 1994). El frotis muestra una mezcolanza de todas las células anteriores con predominancia de unas u otras según el momento de evolución del diestro (Marcondes, F. K., Bianchi, F. J. and Tanno, A. P. 2001).
Los procesos neurales de aprendizaje y memoria, esenciales para la adaptación del individuo al medio, pueden ser modulados por diferentes sistemas endógenos, neurales o endocrinos, aumentando la probabilidad de interacción flexible entre el individuo y su entorno (Ruiz MJ. 2007).
En el presente trabajo se revisan los efectos de los esferoides neuroactivos endógenos a lo largo del ciclo estral normal y efectos de Alio administrada IP sobre los procesos de aprendizaje y memoria en la rata.
MATERIALES Y MÉTODOS
A continuación se describen los procedimientos y metodología utilizados en la presente investigación.
Animales y condiciones de cría
Se constituyó ocho grupos de experimentación, con un total de 44 ratas Sprague Dawley.
Edades Estudiadas
Se seleccionó ratas hembras, de 60 a 70 días de edad, entre 220 y 280 gramos de peso.
Condiciones de cría
En el bioterio del Instituto de Investigaciones Biomédicas de la Universidad de Mendoza (IMBIOMED), ciudad de Mendoza-Argentina, las ratas fueron mantenidas bajo condiciones estándar de laboratorio, con ciclos de 12 horas luz/oscuridad, temperatura entre 20 y 23° C, disponen de comida y
Agua ad libitum. El cambio de lecho y limpieza de jaulas se realizó tres veces por semana. Estas condiciones se mantuvieron durante todo el periodo de experimentación.
Preparación del animal Procedimientos quirúrgicos Ovariectomía (OVX)
Tras anestesiar al animal se realiza una incisión anteroposterior en piel del abdomen, de 2 cm en flanco izquierdo, avulsión de tejido celular subcutáneo y músculo hasta llegar a la cavidad peritoneal, se procede a individualizar el ovario izquierdo, se liga con hilo de lino y se procede a la sección del ovario, se repara los tejidos en dos planos, muscular y piel. De la misma manera se procede con el ovario derecho, realizando una incisión de 2 cm en flanco derecho.
Inmediatamente después de la cirugía los animales disponen de agua y alimento ad libitum. Luego de una semana de recuperación se someten a la segunda cirugía para canulación intracerebral.
Canulación bilateral en hipocampo
Luego de anestesiar al animal, se coloca en el aparato estereotáxico para iniciar el procedimiento de implante de las cánulas en la región CA1 del hipocampo. El procedimiento inicia con una incisión coronal de 2 cm en piel de la cabeza, se retrae la piel y luego el periostio, identificándose la sutura bregmática como punto central y de acuerdo al Atlas de Pellegrino (Nanfaro F, Cabrera RJ, Bazzocchini V, Laconi M, Yunes R 2010) se utilizan las siguientes coordenadas: - 3,5 mm anteroposterior, a 3 mm lateral izquierdo a la sutura sagital y + 2,5 mm de profundidad se implanta la cánula de acero inoxidable, Figura 2. Otra cánula es implantada a 3 mm lateral derecho a la sutura sagital y + 2,5 mm de profundidad. Ambas cánulas son fijadas con acrílico autocurable para reparaciones a un tornillo que para tal efecto se coloca a 1mm por detrás y lateral izquierdo a la sutura bregmática, al mismo tiempo que al hueso. Se deja un mandril en cada cánula durante 24 horas para mantener su permeabilidad.
Después de la cirugía los animales disponen de agua y alimento ad libitum. Se realiza control de las cánulas en forma diaria hasta el día del experimento.
Luego de una semana de recuperación se procede a los distintos tipos de evaluaciones comportamentales

Anestesia
Las ratas fueron anestesiadas con hidrato de doral al 8%, vía intraperitoneal, 1 ml/100 gramos de peso, para OVX y una semana después se volvió a anestesiarlas para canulación bilateral en Hipocampo.
Medidas Preventivas
Para prevenir infecciones, todos los animales recibieron Penicilina G Benzatínica 0.2 mi vía intramuscular, inmediatamente después de cada cirugía (Nanfaro F, Cabrera RJ, Bazzocchini V, Laconi M, YunesR2010).
Ciclaje a ratas No Ovariectomizadas (no OVX)
Se realizó a través de frotis vaginal para observación en microscopio óptico y reconocimiento de cada tipo de células: leucocitos, células nucleadas y células cornificadas.
Una semana después de la canulación se inició el control de ciclo de las 20 ratas no OVX, para establecer un ciclo estral normal y la selección en el periodo correspondiente al ciclo, para administración de Alio o líquido cefalorraquídeo artificial (LCRA).
Grupos Experimentales
Las 44 ratas se repartieron en ocho grupos experimentales, constituidos de la siguiente manera:
Grupo Proestro + Alio: 4 Ratas en proestro, cicladas, reciben Alio vía intrahipocampal (IH)
Grupo Estro: 6 Ratas en estro, cicladas, reciben LCRA vía IH
Grupo Diestro + Alio: 5 Ratas en diestro 1, cicladas, reciben Alio vía IH
Grupo Diestro: 5 Ratas diestro 2, cicladas, reciben LCRA vía IH
Grupo OVX + E + P + Alio: 6 Ratas ovariectomizadas (OVX), impregnadas con estrógeno (E) y progesterona (P) vía subcutánea (SC), reciben Alio vial H
Grupo OVX + E + P: 6 Ratas OVX, impregnadas con E y P vía se, reciben LCRA vía IH
Grupo OVX + Alio: 6 Ratas OVX, sin impregnación, reciben Alio vía IH
Grupo OVX: 6 Ratas OVX, sin impregnación, reciben LCRA vía IH.
Comportamiento: Aprendizaje punitivo
Se utiliza el test Step Down (SD) para evaluar memoria de corto plazo con estímulos aversivos en ratas. Una semana después de preparado el animal (canulación intracerebral y OVX), se realiza el experimento en tres etapas, con un intervalo de 24 horas entre cada una.
El experimento se realiza previa exposición del animal a la sala de comportamiento, con temperatura adecuada y el handling correspondiente que permita el reconocimiento del lugar, objetos y persona durante el training y el test, reduciendo el efecto del estrés.
Pre-training: adaptación al ambiente durante 30 minutos, handling 180 segundos, se coloca al animal en la plataforma de la caja del test, cronometrando el tiempo de demora en bajar completamente a la rejilla, se le permite exploración de la caja durante 180 segundos.
Training: adaptación al ambiente durante 30 minutos, handling 180 segundos, se coloca al animal en la plataforma de la caja del test, cronometrando el tiempo de demora en bajar completamente a la rejilla y se procede a la descarga eléctrica, de 0,5 miliampers, durante 3".
Test: adaptación al ambiente durante 30 minutos, handling 180 segundos, se coloca al animal en la plataforma de la caja del test, se observa la conducta y cronometra el tiempo de demora en bajar completamente a la rejilla, que se registra como tiempo de latencia, dando un máximo de 180 segundos si no desciende de la plataforma.
Valoración. La valoración del aprendizaje de la rata en el modelo experimental SD está representada por el tiempo de latencia registrado durante el Test.
Administración de esferoides y neuroesteroides
Se realiza la administración de la siguiente manera:
Estrógeno 25 ug vía SC 48 horas antes del training en la rata
Progesterona 1 mg vía SC 5 horas antes del training del animal
Alio, micro-inyección de 1 ul guiada a través de cánulas implantadas en hipocampo dorsal (IH)
Reconocimiento morfológico
A la conclusión del experimento, se procedió al sacrificio del animal por decapitación en guillotina, realizándose una craneotomía para extraer el cerebro, sección del cuerpo calloso y separación de los hemisferios, reconocimiento de estructuras, individualización de hipocampos y comprobación de canulación sobre hipocampo.
Estadística
Los efectos de las condiciones experimentales se evaluaron mediante el programa Prism 3, la estadística seleccionada fue el test de "T" ya que se comparan estados hormonales endógenos (OVX; OVXep; Proestro; Diestro 1) o bien las variables causadas por la administración del neuromodulador (Alio) sobre el patrón de aprendizaje en el test SD. Como posthoc test se utilizó student's Neuman Keues para varianzas heterogéneas, determinando de esta manera diferencias significativas entre los grupos experimentales.
RESULTADOS
Se planificaron 6 ratas para cada grupo de experimentación, por diferentes razones se eliminaron animales de algunos grupos, por ejemplo: complicaciones durante la preparación de los animales por la anestesia o complicaciones postoperatorias; canulación incorrecta; reemplazándolos en algunos casos para completar la muestra por grupos, Tabla 1.
a) Efecto de la administración vía IH (CA1, CA2-hipocampo dorsal) de Alio previa impregnación con E+P en ratas OVX y en ratas cicladas.
La OVX no modificó la capacidad de aprendizaje. Así mismo la administración de Alio vía IH, no modificó este parámetro (t= 2.055 df: 10 P= 0.067= NS) Figura 3.
b) Efecto de administración IH de Alio en ratas OVX que no fueron impregnadas con E+P previa a la administración de Alio.
Sin embargo cuando los animales OVX recibieron una impregnación con E (25 ug/rata) 48 horas previas al experimento y P (1 mg/rata) 5 horas previas, un efecto proamnésico fue observado en el grupo OVX (t= 21.79 df: 10P<0.0001). La administración de Alio revirtió el efecto proamnésico, recuperando la capacidad de aprendizaje observada anteriormente (t=46.93 df: 10 P<0.0001) Figura 4.
c) Efecto de E+P+Allo administrados a ratas OVX, sobre la memoria en el modelo experimental Step Down.
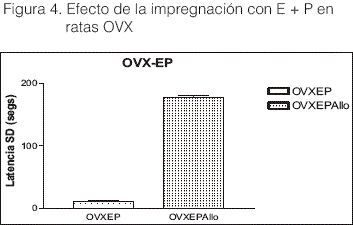
Como puede observarse en la Figura 5, frente a niveles bajos de E y altos de P luteal en el diestro 1, la administración de Alio IH, no modificó la capacidad de aprendizaje (t= 0.186 df: 8 P<0.856=NS).
d) Efecto sobre la memoria de las variaciones hormonales endógenas en la rata hembra durante el ciclo estral, en el modelo experimental Step Down: efecto de la administración IH de Alio
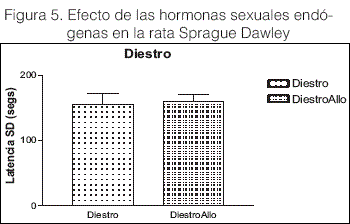
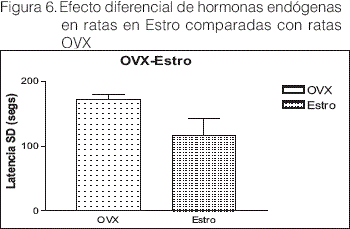
Los animales en relación con el ciclo estral y tomando la situación del estro endógeno (concentraciones séricas de E y P postovulatoria), enfrentados con los niveles séricos bajos de E y P en ratas OVX, no se observaron diferencias significativas (t=2.055 df: 10 P=0.067=NS), Figura 6. Sin embargo cuando al grupo OVX se impregnó con una dosis alta de E (25 ug/rata se) y P (1 mg/rata SC) y se los comparó con niveles endógenos de animales en ciclo de proestro, un efecto comparativo opuesto fue observado en ambos grupos, ya que cuando se les administró Alio IH no se observaron cambios en la capacidad de aprendizaje en el grupo OVX impregnado, mientras que en el grupo proestro un fuerte efecto proamnésico altamente significativo fue observado (t=29.50 df: 8 P<0.0001), Figura 7.
e) Diferencias en el efecto entre hormonas endógenas de la fase de estro, en la que se encuentra aumentada la concentración de Estrógenos en la rata y la ausencia de hormonas en ratas OVX.
f) Diferencias en el efecto entre hormonas endógenas de la fase de proestro, en la que se encuentra en aumento la concentración de Estrógenos y disminuye la concentración de Progesterona en la rata y la ausencia de hormonas en ratas OVX.
DISCUSIÓN
De acuerdo a bibliografía revisada y descripción del modelo de aprendizaje SD, se realizó la valoración de memoria espacial, asociativa y aversiva. La preexposición del animal a la sala de conducta y a la caja de SD, facilita el aprendizaje, un efecto de aprendizaje perceptivo o priming, siendo el aprendizaje espacial en ratas de naturaleza eminentemente asociativa (Vila J, Nieto J y Rosas JM 2003a). Esta capacidad de adquirir y retener asociaciones de las características del ambiente (Vicens, P et al 2003), le permitió al animal desenvolverse durante el handlig y el training. En el training se observó la respuesta natural de la rata, que tuvo una consecuencia aversiva, la aplicación de la descarga eléctrica (Vila J, Nieto J y Rosas JM 2003b). El aprendizaje aversivo valorado como tiempo de latencia en el test, fue la respuesta al estímulo aversivo, representada por el temor del animal a la aparición de la consecuencia aversiva y la conducta de evitación que desarrolla expresada al mantenerse por más tiempo sobre la plataforma. Este aprendizaje fue el observado en el grupo OVX y el grupo OVX+Allo, según resultados en la Figura 3.
La administración de Alio IH está fundamentada en las funciones del hipocampo en la formación de nuevas memorias relacional/contextual (declarativa) en roedores (Passing, VC 1994), relativas a eventos experimentados.
En los animales OVX que recibieron impregnación con E y P, se evidencia efectos proamnésicos en la Figura 4, podría deberse a los metabolitos 3a de la P éstos se comportan como moduladores alostéricos positivos de los receptores GABAA, que puede producir un aumento en la función del receptor que posee mayores propiedades inhibidoras en el cerebro afectando el aprendizaje, además del efecto tranquilizante (Martín-García E, Darbra S, Pallares M. 2007). Alio revierte el efecto proamnésico de E y P, aunque se le atribuye efecto disruptor de la memoria espacial, en el momento de aplicación de Alio al animal se somete al aprendizaje aversivo, este neuroesteroide no afecta la memoria no espacial (Martín-García E, Darbra S, Pallares M. 2007), facilitando el desarrollo de la memoria aversiva.
En los grupos en estro y OVX comparados en la Figura 6, la no observancia de diferencias significativas podría deberse a que en estro es el momento en que coinciden los valores más bajos de ambas hormonas ováricas, Figura 1.
El efecto mejorador de Alio en la memoria de las ratas del grupo proestro+Allo, figura 7, podría deberse a la modulación del sistema de neurotransmisión glutamatérgica a través de la sensibilización de los receptores para este neurotransmisor, controlando la conducción sináptica y expresando sus propiedades excitatorias en el cerebro.
Finalmente, podemos aseverar que la administración de los esferoides sexuales E y P tiene efecto amnésico en ratas OVX, los resultados sugieren que Alio podría tener un efecto mejorador de la memoria en el test SD en ratas OVX-EP y que éste podría ser mediado modulando redes neuronales que involucran al sistema de neurotransmisión excitatoria glutamatérgico. Sin embargo esta última observación requiere mayor número de experimentos.
Alio podría estar jugando un importante rol como gatillo regulatorio específico de algunas redes neuronales que controlan los mecanismos neuroquímicos y neuroendocrinos hipocampales de la memoria. Una de las posibilidades sería a través de la modulación sistemas de receptores específicos, lo cual sería clave en el control de la incorporación de la información, retención y la posterior evocación en el corto y largo plazo.
BIBLIOGRAFÍA
Castro-Sierra E, Chico Portee de León F, Gardillo Domínguez LF, Portugal Rivera A (2005). Neurotransmisores del Sistema Límbico, Hipocampo, GABAy Memoria. Primera parte. [ Links ]
De Iceta M. Autor de la Revisión (2002): Neurobiología de las Interacciones Estrés-memoria. Artículo: Kim JJ, Diamond DM. Thestres-sed hippocampus, synaptic plasticity and lost memories. Nature Reviews: Neuroscience, vol. 3: 453-62. [ Links ]
Gargiulo PA, Viana MB, Graeff FG, de Souza Silva MA y Tomaz C (1996). Effects on Anxiety and Memory of Systemic and Intra-Amygdala Injection of 5 HT3 Receptor Antagonist BRL 46470A. Neuropsychobiology; 33; 189-195. [ Links ]
Marcondes, F.K., Bianchi, E.J. y Tanno, A. P (2001). Determination of the Estrous Cycle Phases of Rats: Some Helpful Considerations. Dpto. Ciencias Fisiológicas, Facultad de de Odontología de Piracicaba, Universidade Estadual de Campinas, Av. Limeira, 901, CEP 13414-903, Piracicaba, SP, Brazil. [ Links ]
Martín-García E, Darbra S. y Pallarès M (2007). Implicación de los Neuroesteroides en la Conducta Normal y Patológica. REV NEUROL; 44: 661-76 [ Links ]
Mellon SH. y Griffin LD (2002). Neurosteroids: Biochemistry and Clinical Significance. TRENDS in Endocrinology & Metabolism. Vol. 13 N° 1. January/February [ Links ]
Nanfaro F, Cabrera RJ, Bazzocchini V. y Laconi M, Yunes R (2010). Pregnenolone Sulfate Infused in Lateral Septum of Male Rats Impairs Novel Object Recognition Memory. Área de Farmacología, Facultad de Ciencias Médicas, Universidad Nacional de Cuyo (IMBECU-FCM-CONICET), Argentina. [ Links ]
Pascual-Leone AM y Medina JM (2010). Acción de las Hormonas a Nivel Cerebral. Instituto de España. Real Academia Nacional de Farmacia. Monografía XXIX. Madrid. Capítulo 3: Acciones neuro-protectoras de las hormonas ováricas en modelos animales. [ Links ]
Passing VC (1994). Los Sistemas de Memoria. Hipocampo y Memoria Espacial. Departamento de Fisiología y Biofísica, Facultad de Medicina, Universidad de Chile. Revista de Psicología, Volumen V. Años [ Links ]
Puerta, M (1994). Los Esferoides Sexuales Femeninos y el Equilibrio Energético. Perfiles Plasmáticos. Departamento de Fisiología Animal, Facultad de Ciencias Biológicas, Universidad Complutense de Madrid. [ Links ]
Ruiz, MJ (2007). Tesis doctoral: Facilitación del Aprendizaje y la Memoria de una Tarea de Referencia Espacial en el Laberinto Acuático de Morris por Autoestimulación Eléctrica Intracraneal, en Ratas Winstar. Departamento de Psicología y de Metodología de Ciencias de la Salud. Facultad de Psicología. Instituto de Neurociencias. Universitát Autónoma de Barcelona. Bellaterra. Barcelona. [ Links ]
Vicens P, Redolat R y Carrasco MC (2003). Aprendizaje Espacial y Laberinto de Agua: Metodología y Aplicaciones. Psicothema. Universitat Rovira i Virgili y Universitát de Valéncia.Vol. 15, n°4,pp. 539-544 [ Links ]
Vila J, Nieto J y Rosas J.M. (2003). Investigación Contemporánea en Aprendizaje Asociativo. Estudios en España y México. Capítulo Aprendizaje asociativo y aprendizaje espacial: historia de una línea de investigación (1981-2001) Rodrigo T y Prados J. Universitát de Barcelona. [ Links ]
Vila J, Nieto J y Rosas JM (2003). Investigación Contemporánea en Aprendizaje Asociativo. Estudios en España y México. Capítulo Aprendizaje de evitación. Maldonado A. y Cándido A. Universidad de Granada. [ Links ]
Zheng, P (2009). Neuroactive Steroid Regulation of Neurotransmitter Reléase in the CNS: Action, mechanism and posible significance. [ Links ]