Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares em SciELO
Similares em SciELO
Bookmark
Revista de Actualización Clínica Investiga
versão impressa ISSN 2304-3768
Rev. Act. Clin. Med v.40 n.40 La Paz jan. 2014
ARTICULO
POTENCIAL DE HIDROGENIONES- pH
Dr. Mansilla Canela Gonzalo1
RESUMEN
En todo organismo vivo, se producen sustancias acidas y álcalis a partir del metabolismo de hidratos de carbono, lípidos y proteínas. El ion hidrógeno es la sustancia resultante más importante de estos procesos metabólicos y está presente en todos los compartimentos corporales, y es el responsable del nivel de acidez o alcalinidad de los líquidos y tejidos corporales.
La concentración de hidrogeniones se expresa por el valor de pH, que indica el estado ácido o alcalino de una solución. Esta información se complementa con el valor de pK, que indica el equilibrio químico de la sustancia acida en su capacidad de liberar sus iones ácidos y básicos. El uso del pK y los valores de dióxido de carbono y bicarbonato a través de la ecuación de Henderson-Hasselbach, complementan la interpretación del valor de pH y el estado de acidez o alcalinidad, en función de la respuesta de los mecanismos reguladores de la concentración de hidrogeniones así como de los sistemas de amortiguadores fisiológicos.
PALABRAS CLAVE
pH. pK. Ácidos. Bases.
INTRODUCCIÓN
En los organismos vivos se producen continuamente sustancias acidas y básicas, como resultado de reacciones metabólicas, del catabolismo de las proteínas, y del catabolismo de otras moléculas, que afectarían el estado ácido base del sistema interno y en consecuencia la función corporal, de no mediar un sistema de regulación y equilibrio
Entre las substancias resultantes de este metabolismo, la concentración de hidrógeno (H+) en los diferentes compartimentos del organismo es una de las variables biológicas más importantes que está en estrecha relación con el nivel de acidez o alcalinidad de la sangre.
La producción de hidrógeno es cuantiosa y permanente. Cambios relativamente pequeños en su concentración pueden producir trastornos graves en múltiples órganos y enzimas; llegando a ser incompatibles con la vida con niveles extremos de acidez o alcalinidad.1, 2
DEFINICIÓN DE ACIDO
Por definición, ácido es toda sustancia capaz de ceder ion hidrógeno a la solución en la que se encuentra \ Por ejemplo, el ácido clorhídrico (HCI), es capaz de ceder iones de hidrógeno y también de cloruro a su diluyente.

Por su lado, la capacidad del cloro para captar hidrogeniones le otorga la definición de base.
En la ecuación resultante, por lo tanto, se observa que un ácido está compuesto por hidrogeniones y una base conjugada.
De acuerdo a la afinidad entre el hidrógeno y la base conjugada correspondiente, se obtendrá mayor o menor cantidad de hidrogeniones libres en la solución. Por ejemplo, para el caso de ácidos fuertes, la afinidad entre su hidrógeno y su base conjugada es baja, por lo que el ion hidrógeno se libera fácilmente en esta solución, desplazando el equilibrio de la ecuación hacia la derecha, como es el caso del ácido clorhídrico.3'4'5

Por el contrario, los ácidos débiles muestran alta afinidad entre su ion hidrógeno y su base conjugada, por lo que en solución se libera poca cantidad de ion hidrogeno, desplazando el equilibrio de la ecuación hacia la izquierda, como es el caso del ácido carbónico.3'4'5

Para ambas situaciones, es decir para los ácidos fuertes y débiles, la cantidad total de hidrogeniones (libres + combinados) es la acidez titulable. Sin embargo, el estado de hidrógeno que tiene repercusión biológica es la concentración de hidrogeniones libres, susceptibles de reaccionar químicamente con otras moléculas.5
CONCENTRACIÓN DE HIDROGENIONES
La concentración de H+ libres en la sangre se puede expresar en diferentes formas. En las personas sanas la concentración de hidrogeniones alcanza hasta 40 nanomoles/l de plasma. Este valor, comparado con el de otros cationes, es relativamente pequeño.5
Por ejemplo, en un litro de plasma se concentra hasta 142 millones de nanomoles de Sodio, deduciéndose que la concentración de hidrogeniones en plasma es aproximadamente la millonésima parte de la cantidad de otros cationes.6
En razón de que resulta difícil en la práctica rutinaria expresar la concentración de hidrogeniones en una unidad de medida de fácil manejo, el químico danés S0ren Peter Lauritz S0rensen, desarrolló el concepto de pH el año 1909, como el potencial del hidrógeno, definiéndolo como el logaritmo negativo de la concentración de hidrogeniones.
En su trabajo original, Sorensen expresó: "...en la forma de un poder negativo de 10...[y] emplearé el nombre de "exponente de ion hidrógeno" y el símbolo pH para el valor numérico del exponente de este poder".7
En este sentido, para una concentración de hidrogeniones de 0.00000001 M, matemáticamente se expresa:
[H+] = O.OOOOOOO1
[H+] = 10-8
[H+] = 10-p8
p[H+] =(-log[10S]=8)
pH = 8
Por lo tanto en la práctica rutinaria, una concentración de hidrogeniones de 0.00000001 M, ó de 1x10-8 M, se expresa simplemente como un valor de pH de 8.8
LA ESCALA DE VALORES DEL PH
A partir de la definición de pH, se ha calculado su valor para diferentes substancias. Para el caso del agua, solvente universal, se sabe que es un electrólito débil, a partir del cual, sólo una pequeña parte se disocia en los iones que la componen su molécula.8

El punto de equilibrio entre los iones Hidronio (H3O, ion ácido del agua) e Hidroxilo (OH", ion básico del agua) se da a una concentración de 10"7moles/L, respectivamente. Por lo tanto, aplicando la definición de pH, se expresa que el valor de pH 7 es un valor neutro entre acidez y alcalinidad.
De la misma forma, la capacidad teórica de disociación del agua en sus dos iones, marca los límites de la escala de valores posibles del pH.

Figura N° 1.- Valor de pH en función de la relación de concentración de Hidronio e Hidroxilo.
El producto de la concentración de Hidronio e Hidroxilo, en cualquier relación de disociación siempre será de 10-14 moles/L, lo que limita la escala posible de valores de pH. 8
Cualquier valor de pH mayor a 7 se expresara como tendencia a la alcalinidad.
Cualquier valor de pH menor a 7 se expresará como tendencia a la acidez. 8
VALOR DE PK
Todo compuesto ácido presenta un equilibrio químico, expresado como constante de equilibrio K. Este equilibrio puede ser expresado con la ecuación:

Aplicando el valor logarítmico de las concentraciones de estos iones, en forma similar al pH, se determina el valor de pK.3
Este valor de pK, expresa la fuerza de disociación de un ácido o de su base conjugada.
El valor de pK es inversamente proporcional al valor de pH. Es decir que cuanto más fuerte es el ácido, el valor de pH será más bajo y el valor de pK será más alto, en función de que libera mayor cantidad de hidrogeniones.
Por el contrario, cuanto más débil es el ácido, el valor de pH será más alto y el valor de pK mas bajo, en función de que libera menor cantidad de hidrogeniones.3
Realizando el despeje de fórmula de de la concentración de hidrogeniones se obtiene

Realizando el despeje de oxidrilos de la ecuación se obtiene

Finalmente aplicando los valores p = -Log, se obtiene la ecuación de Henderson Hasselbach
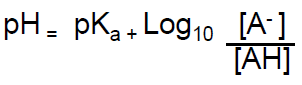
Esta ecuación se usa para determinar el valor de pH de una solución buffer o tampón, cuando se conoce su constante de equilibrio y la concentración del ácido y de la base conjugada.3
FISIOLOGIA DEL ION HIDROGENO
Diariamente se producen entre 10.000 a 15.000 mmoles de hidrógeno, cuyo origen principal es el metabolismo celular de compuestos que contienen carbono. A pesar de esta alta producción de hidrogeniones, el metabolismo se mantiene en equilibrio, y el valor de pH de la sangre mantiene un rango constante.9
El ácido más importante producido en el organismo es el ácido carbónico, originado a partir del metabolismo de carbohidratos y grasas. Este ácido se forma por la hidratación del CO2 producido en esta vía del metabolismo, originándose aproximadamente 13.000 mEq diarios. En razón de que el CO2 es eliminado por el pulmón, el ácido carbónico se considera como "ácido volátil".9
Por otro lado, el metabolismo de proteínas y aminoácidos genera diferentes ácidos, entre los más importantes se nombran los ácidos fosfórico, clorhídrico, y sulfúrico. Este grupo de ácidos no pueden ser eliminados por la ventilación pulmonar, pero sí por los ríñones, por lo que son denominados "ácidos fijos".9
CONTROL RESPIRATORIO DE LA CONCENTRACIÓN DE HIDROGENIONES
El dióxido y agua producidos a partir del metabolismo de carbohidratos y grasas, se transforman en ácido carbónico (H2CO3) ácido débil que se disocia en hidrógeno libre (H+) y bicarbonato (HCO3-).
![]()
Una vez que estas substancias llegan al pulmón, la reacción se invierte reconstituyéndose el ácido carbónico que libera posteriormente dióxido de carbono y agua. El dióxido de carbono producido es eliminado mediante el proceso respiratorio.
![]()
Mientras el intercambio gaseoso a nivel pulmonar sea eficaz para eliminar CO2 y mantener una PCO2 estable, así como una concentración de H2CO3 constante, los niveles de liberación y fijación del ion hidrógeno se mantendrán en rangos fisiológicos, de manera que no se alterará la carga neta de ácidos ni el equilibrio ácido-base del organismo.1,5
CONTROL RENAL DE LA CONCENTRACIÓN HIDROGENIONES
El riñon participa en la regulación del equilibrio ácido básico por dos mecanismos principales.6
El primer mecanismo renal es la regulación de la cantidad de bicarbonato urinario, ya que puede excretar los excesos de este ion o reabsorber el bicarbonato filtrado.

Figura N°2.- Regulación renal de bicarbonato
El segundo mecanismo renal, es su capacidad de excretar hidrogeniones en la forma de H3PO4 o de NH4+. Durante este proceso se genera nuevo bicarbonato, lo que hace posible el reemplazo de aquel que se consumió al tamponar los ácidos fijos. La acidosis tiende a aumentar la excreción urinaria de hidrogeniones y la retención de bicarbonato; mientras que la alcalosis tiene los efectos contrarios.

Figura N°3.- Excreción renal de hidrogeniones
Las funciones compensatorias renales son lentas, ya que demoran entre 12 y 72 horas en alcanzar su máxima eficiencia. Por lo tanto, el riñon participa en la regulación del equilibrio ácido-base a largo plazo.15
ALTERACIONES DEL EQUILIBRIO ACIDO BASE
Las alteraciones del equilibrio ácido base se expresan por modificaciones del valor de pH de la sangre.
El resultado de los mecanismos de control de la concentración de hidrogeniones y los sistemas tampón, mantienen el valor de pH sanguíneo en un margen estrecho de normalidad, entre 7.35 y 7.45.
Cuando el valor de pH es menor a 7.35 se define como acidosis; cuando el valor es mayor a 7.45 se define como alcalosis.
De acuerdo al origen de la alteración, se clasifica en;
acidosis metabólica.
alcalosis metabólica.
acidosis respiratoria,
alcalosis respiratoria.
Tanto la acidosis y alcalosis metabólicas, implican alteración en la regulación o equilibrio del bicarbonato. Por el contrario la acidosis y alcalosis respiratorias implican alteración en la regulación o equilibrio del ácido carbónico.
Estas alteraciones pueden producirse, además en forma mixtas, en las que hay combinación en grado variable de alteraciones respiratorias y metabólicas. Sin embargo, en todas las alteraciones ácido-básicas está involucrada la ventilación alveolar: en las de tipo respiratorio como determinante primario y en las metabólicas, como mecanismo compensatorio 9,10,11.
Notas
1 Médico Pediatra. Hospital Boliviano Holandés, Consultor Salud Infantil.
BIBLIOGRAFÍA
1. Ruiz Márquez MJ, Ortiz García C, Sánchez Luque JJ, Peña Agüera A. Trastornos del Equilibro Acido Base. Laboratorio del Hospital Clínico Universitario "Virgen de la Victoria" de Málaga. Campus Universitario Teatinos, s/n. URL disponible en: http://www.google.com/url?sa=t&source=web&cd=1&ved=0CCkQFjAA&url=http%3A%2F%2Fwww.medynet.com%2Fusuarios%2Fjraguilar%2FManual%2520de%2520urgencias%2520y%2520Emergencias%2Facidbase.pdf&ei=WiR0Uu78MbPHsASSwoCwBg&usg=AFQjCNHwXiFGk8sZdftOZ-9o-OJnmDcHvw Accedido en fecha 24 de octubre del 2013 [ Links ]
2. Regulación del Equilibrio ácido base. En: Riñon y líquidos corporales. URL disponible en: http://ocw.unican.es/ciencias-de-la-salud/fisiologia-humana-2011-g367/material-de-clase/bloque-tematico-4.-fisiologia-del-rinon-y-liquidos/tema-5.-regulacion-del-equilibrio-acido-base/regulacion_del_equilibrio_acido_base.pdf Accedido en fecha 24 de octubre del 2013 [ Links ]
3. Gonzales Núñez V. pH y equilibrios acido base. Introducción. Conceptos previos. URL disponible en: http://212.128.130.23/eduCommons/ciencias-biosanitarias/bioquimica-ph-equilibrios-acido-2013-base/contenidos/1%20lntroduccionConceptosPrevios_2 Accedido en fecha 24 de octubre del 2013012.pdf [ Links ]
4. Velásquez Monroy ML, Ondorica Vargas MA. Ácidos, bases, pH y soluciones reguladoras. URL disponible en: http://www.bioquimica.dogsleep.net/Teoria/archivos/Unidad24.pdf Accedido en fecha 26 de octubre del 2013 [ Links ]
5. Moreno R. Equilibrio ácido - base. En Aparato respiratorio Fisiología y clínica [en línea] Santiago de Chile: Universidad Católica de Chile; 2007. URL disponible en: http://escuela.med.puc.cl/publ/AparatoRespiratorio/06EQAcidoBase.html Accedido en fecha 27 de octubre del 2013
6. Vianchi ME., Borda G., Young M. Equilibrio Acido Base. pH[em línea]. Cátedra de fisiología humana. URL disponible en: http://med.unne.edu.ar/enfermeria/catedras/fisio/cap%203%20PH.pdf Accedido en fecha 27 de octubre del 2013
7. Jensen WB. The symbol for pH. Ask the historian. J. Chem. Educ, 2004, 81, 21. URL disponible en:http://www.che.uc.edu/jensen/VV.%20B.%20Jensen/Reprints/102.%20pH.pdf Accedido en fecha 27 de octubre del 2013 [ Links ]
8. Parámetros físico químicos: pH. [en línea]. URL disponible en: http://www.uprm.edu/biology/profs/rnassol/manual/p2-ph.pdf Accedido en fecha 28 de octubre del 2013
9. Aronson PTHier SO. El Riñon. En: Smith LH, Thier SO, Editores. Fisiopatología. Principios biológicos de la enfermedad. 2da edición. Buenos Aires: Editorial Médica Panamericana; 1988:629-636. [ Links ]
10. Moreno R. Alteraciones del equilibrio acido-base. En Aparato respiratorio Fisiología y clínica [en linea] Santiago de Chile: Universidad Católica de Chile; 2007. URL disponible en http://escuela.med.puc.cl/publ/AparatoRespiratorio/13TrastornosAcidos.html
11. Saínz Menéndez B. Alteraciones del Equilibrio Acido Básico. Revista Cubana de Cirugía. 2006; 45:0-1O.[Links] URL disponible en: http://bvs.sld.cu/revistas/cir/vol45_1_06/cirH106.html Accedido en fecha 28 de octubre del 2013