Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares em SciELO
Similares em SciELO
Bookmark
Revista de Actualización Clínica Investiga
versão impressa ISSN 2304-3768
Rev. Act. Clin. Med v.33 La Paz jul. 2013
ARTICULO
Ensayos Clinicos
Molina Beltrán Isel Alejandra 1
1 Univ. Tercer Año Facultad de Odontología UMSA
RESUMEN
El ensayo clínico es un estudio de carácter experimental, que se basa en una organización cuidadosa y ética del procedimiento a ejecutar en uno o más grupos de personas, que se someten voluntariamente a la aplicación de un medicamento, cuyo efecto se quiere demostrar como beneficioso para determinada enfermedad, o pretende compararse con otro de igual o menor efectividad, debiendo probarse en varias fases de aplicación, el beneficio en mención.
Así, las fases obligatorias de investigación utilizadas en el ensayo clínico, se inician con estudios realizados en animales de experimentación, para determinar las bondades o desventajas del medicamento, luego, se procede a su aplicación en humanos, siempre y cuando se haya verificado en el protocolo previo, que las desventajas son mínimas para la vida o salud de los humanos, en quienes se procederá a su aplicación y observación, delimitando los efectos colaterales, advertencias sobre su uso, etc, para finalmente ser comercializado, etapa en la que inicia el proceso de observación posttratamiento.
El ensayo clínico es un procedimiento altamente valorable en la investigación, que de igual forma se somete a procedimientos rigurosos de control técnico y ético, para garantizar el respeto a la vida de los sujetos de experimentación.
PALABRAS CLAVE
Ensayo clínico. Metodología de la investigación. Efecto farmacológico. Medicamento.
INTRODUCCION
El ensayo clínico es un estudio de carácter prospectivo, de tipo experimental, donde el investigador prueba la utilidad de un nuevo enfoque de manejo clínico terapéutico, preventivo o de diagnóstico, entablando en algunos casos comparaciones sobre la utilidad de uno o más medicamentos. Del mismo modo este tipo de estudio permite identificar la eficacia de una droga, exponiendo las características farmacodinámicas y terapéuticas de la misma, así como el perfil de reacciones adversas posibles.1
Los ensayos clínicos, en la investigación científica se iniciaron en el año 1747, con las observaciones de Lind y Lister en 1870, comenzando el proceso de aleatorización en 1923 con Fisher.1
Luego de las atrocidades cometidas en la Segunda Guerra mundial, donde se realizaron experimentos con desacato a la dignidad humana, nacen los Comités de Bioética, así como una serie de regulaciones en el desarrollo de las investigaciones biomédicas, que limitaron las arbitrariedades investigativas en sujetos de investigación y animales, llevando a la orientación organizada del diseño de los ensayos clínicos, que permiten la investigación normada, respetuosa y organizada, garantizando los resultados obtenidos, así como la integridad de los participantes de la investigación.2
Es en este sentido, la norma establece ciertos procedimientos obligatorios y procesos de control, que se encuentran sujetos a regulaciones internacionales,
por lo que el uso de placebo, antes utilizado en este tipo de estudios como estándar de control, ahora se restringe a situaciones particulares, siendo igualmente observadas, la razón y el origen de las fuentes de financiación.3
CLASIFICACION DE LOS ENSAYOS CLINICOS
Los ensayos clínicos, tienen una gran variedad de clasificaciones, proponiéndose las siguientes:
1. Por su metodología y diseño:
Pueden ser:
a. Abierto: En este tipo de ensayo clínico el investigador está informado sobre el tratamiento que va a efectuar, y el individuo voluntario conoce el tipo de tratamiento al cual está siendo sometido. Puede ser utilizado para equiparar dos tratamientos que presenten similitud, determinando el grado de eficacia de cada uno de ellos, garantizando que no se pondrá en riesgo a vida o salud del paciente.1,2,4,5.
b. No controlado /controlado: Pretende cotejar el efecto y el valor de una o más intervenciones.2,4.
c. Aleatorio/ No aleatorio: Se caracteriza por la distribución equilibrada de las características de los pacientes, con la finalidad de conseguir que la variabilidad de grupos pueda ser comparable.2,4.
d. Paralelo/cruzado: En el ensayo clínico paralelo cada grupo de pacientes, recibe simultáneamente un solo tratamiento, a diferencia del ensayo clínico cruzado, el individuo en estudio recibe de forma sucesiva cada uno de los tratamientos en estudio.2,4.
e. Ensayo clínico a simple ciego: Caracterizado por el desconocimiento pleno del individuo voluntario acerca del tratamiento al cual va a ser sometido, es decir, no sabe si es parte del grupo experimental o parte del grupo de control del experimento clínico, o en algunos casos poco comunes el investigador suele ser quien desconoce la distribución del tratamiento.4,5.
f. Ensayo clínico a doble ciego: Son empleados para reducir los prejuicios no intencionales, como la contribución al efecto placebo, el cual elude la evaluación de los grupos de comparación, por lo que en este tipo de ensayo, el investigador y el individuo voluntario, desconocen la distribución de los grupos de tratamiento.1,4,5.
g. Ensayo clínico a triple ciego: Es realizado en aquellos casos donde las variables clínicas pueden ser analizadas de manera diferente, por lo cual el investigador, el individuo partícipe y el investigador estadístico, no conocen el tratamiento.4,5.
2. Por su fase de ejecución Pueden ser de:
a. Fase I:Generalmente inicia después de haber concluido el estudio farmacológico y de toxicidad en animales, estableciendo en esta fase la primera administración del medicamento en voluntarios sanos, administrando dosis primero únicas, posteriormente múltiples hasta alcanzar una óptima dosis terapéutica, todos los voluntarios sanos preferentemente adultos jóvenes partícipes de esta fase, quienes son hospitalizados estando en constante supervisión en caso de existir alguna reacción extraña.1,6,7.
b. Fase II: Se caracteriza por establecer la primera administración del medicamento en los pacientes, para valorar su eliminación en el organismo. Es necesario dividir a esta segunda fase en, un ensayo fase II temprano, que consiste en estudiar la capacidad terapéutica y efectos secundarios y un ensayo fase II tardío que se enfoca en la eficacia del medicamento y en disminuir las manifestaciones en enfermedades específicas.1,6,7.
c. Fase III: Tiene como propósito abastecer información que posibilite un análisis estadístico de seguridad y efectividad del medicamento y por su certeza determinante, puede llegar a involucrar a cantidades excesivas de pacientes, con el objetivo de realizar lo mejor posible, una equiparación del fármaco que está en estudio, buscando diagnosticar manifestaciones de toxicidad. En caso de resultar el medicamento apropiado eficaz y seguro, el fabricante puede proceder a pedir una solicitud para acceder a una licencia y poder comercializarlo.1,6,7.
d. Fase IV: Conocida como estudios post comercialización o de fármacovigilancia, que se caracteriza por un seguimiento constante aun después de haber salido al mercado, para evaluar posibles efectos indeseables y rastrear algún grado de toxicidad o reacciones adversas que en su momento fueron imprevisibles, además pretende analizar su evolución a largo plazo y observar nuevas características que puedan jugar a favor o en contra del fármaco y a su vez también del paciente.1,6,7.
3. Por su lugar de ejecución
a. Unicéntrico: Elaborado por un investigador o un equipo de investigación en un centro hospitalario o extra- hospitalario. Presenta dos limitaciones, el tamaño de la muestra y los recursos.2,6.
b. Multicéntrico: Es elaborado en dos o más centros hospitalarios con un solo protocolo y un coordinador que se encarga de desarrollar todos los datos y el análisis de los resultados.2,6,8.
CARACTERISTICAS DE UN ENSAYO CLINICO
Una de las características de los ensayos clínicos es que el protocolo solo puede ser transcrito por traductores médicos, traductores de textos médicos y licenciados en distintas ramas biomédicas, los cuales a su vez deban tener experiencia, dedicación a tiempo completo, y comprensión del estudio efectuado en laboratorio como del producto en investigación.9,10.
DISEÑO DE UN ENSAYO CLINICO
El diseño de un ensayo clínico mantiene la estructura sistemática del proceso de investigación científica a través del método científico, por lo tanto los componentes serán:9,10.
1. La pregunta de investigación:
Durante el diseño de la pregunta de investigación se debe tener en cuenta previamente la existencia de estudios antecedentes que delimiten la complejidad propia de la idea, de manera que se pueda establecer con claridad y precisión lo que se pretende en la investigación. No deben utilizar términos ambiguos ni abstractos y debe resumir el contenido en estudio, de este modo, no se puede decir que existe solo una manera de formular todos los problemas de la investigación, porque cada uno de ellos requiere de un análisis en particular.11.
2. El muestreo: En este tipo de investigación, las muestras deben tener un carácter representativo, tomando en cuenta que la totalidad de los elementos de la población tengan la misma posibilidad de ser elegidas de manera aleatoria, siendo rigurosos en la selección de los sujetos para evitar sesgos en el estudio.
3. El análisis estadístico: Es una formalidad básica para cualquier tipo de preparación que intente estimar la eficacia de algún medicamento, trata de investigar que la hipótesis nula sea positiva, estableciendo dos tipos de errores cuando existe una disconformidad bastante significativa en los tratamientos. El error tipo I, ocurre cuando se elaboran repetidas veces las pruebas estadísticas para comprobar diferencias significativas, es decir que afirma las diferencias entre dos grupos de tratamiento cuando en realidad éstas no existen. El error tipo II, es consecuencia del uso de una muestra pequeña de pacientes para realizar la investigación afirmando que no existen diferencias entre los grupos de tratamiento cuando en realidad sí existen.1,2
Cuando los grupos de estudio influyan en algún pronóstico se limitan a dos tipos de análisis:
-Análisis de subgrupos: se caracteriza por un rediseño del análisis general en diferentes subgrupos de la población en estudio, la cual ha sido seleccionada por una determinada característica. Generalmente la regresión múltiple es simultánea a las variables seleccionadas2.
- Selección de la prueba estadística: Se precisa preguntar el resultado terapéutico de una intervención al paciente para demostrar si los efectos son reales o no, debiendo necesario el conocimiento del valor p, los niveles de significancia, la razón de ventajas, riesgo atribuible, riesgo relativo, etc.2,12.
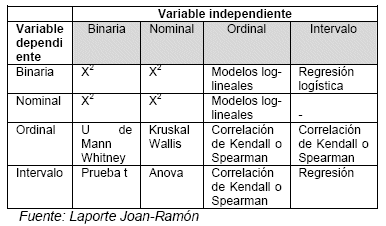
La siguiente tabla, extraída de Laporte Joan-Ramón, muestra con claridad el tipo de análisis a ser elegido en cada caso en particular.2.
BIBLIOGRAFIA
1. Naranjo C. Usoa. E. Busto. Cap.2. Fundamentos de la farmacología cinética. Toronto: OMS, febrero,1991,17-35. [ Links ]
2. Laporte. R. Cap.3. El ensayo clínico controlado. (libro en línea). 2da Edición, 231-257. URL disponible en: http://www.icf.uab.es/llibre/pdf/cap-3.pdf Accedido en fecha: 4 de Junio del 2013. [ Links ]
3. García F. Guallar.A. Olav M. Bakke.X.El uso y abuso del placebo en ensayos clínicos con medicamentos. Disponible en: Biblioteca Bioquímica y Farmacia. UMSA. Editorial. Barcelona, 1998, 31-36. [ Links ]
4. Diferentes tipos de ensayos clínicos. URL. Disponible en: http://scientific-european-federation-osteopaths.org/es/tipos-ensayos-clinico. Accedido en fecha: 4 de Junio del 2013. [ Links ]
5. Grupo Galilea. URL. Disponible en: http://seguroensayosclinicos.com/noticia-tipos-ensayos-clinicos.php. Accedido en fecha: 4 de Junio del 2013. [ Links ]
6. Sáenz. D. Campos. M. Bayés .C. Martín. S. Barbanoj. M. Ensayo clínico: Investigación experimental, fases de investigación clínica y diseño experimental. URL. Disponible en: http://www.binasss.sa.cr/pdf Accedido en fecha: 31 de mayo del 2013. [ Links ]
7. García M. Terleira. A. Portoles. A. Cap.61. Farmacología básica y clínica. 17ma edición. Editorial. España; 2005,1029-1041. [ Links ]
8. Institutos nacionales de la salud.URL. Disponible en: http://www.nlm.nih.gov/medlineplus/spanish/clinicaltrials.html. Accedido en fecha: 4 de Junio del 2013. [ Links ]
9. Ros. F. Ética de los ensayos clínicos.URL. Disponible en: http://www.aceb.org. Accedido en fecha: 8 de Junio del 2013. [ Links ]
10. Murguerza. P. ¿Quién debería traducir los protocolos de los ensayos clínicos?. Manual de traducción Inglés - Español de ensayos clínicos. Barcelona.2012, 22-23. [ Links ]
11. Hernández. R. Fernández. C. .Baptista. L. Metodología de la investigación.Cap.2. Planteamiento del problema: objetivos, preguntas de investigación y justificación del estudio.2da Edición. Editorial. México,1998,10-20. [ Links ]
12. Hernández. R. Fernández. C. Baptista. L. Metodología de la investigación. Cap.8. ¿Cómo seleccionar una muestra?. 2da Edición. Editorial. México,1998,203-232. [ Links ]