Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista Institucional de Ciencias, Tecnología e Innovación Investig@ UMSA
versión impresa ISSN 2220-7139
Investig@ UMSA v.1 n.1 La Paz 2010
ARTÍCULO
RECUPERACIÓN DE ORO Y PLATA POR EL PROCESO ELECTROLITICO TIPO ZADRA
GOLD AND SILVER RECOVERYBYA ZADRA TYPE ELECTROLYTIC PROCESS
Chambi Viraca Luis C.
Instituto de Investigaciones Metalúrgicas y de Materiales, Facultad de Ingeniería, Universidad Mayor de San Andrés, La Paz, Bolivia: lchambi@umsa.bo
Artículo recibido en: septiembre de 2010
Manejado por: Rodny Balanza
Articulo aceptado en: diciembre de 2010
RESUMEN
Una alternativa de recuperación de oro y plata a partir de soluciones ricas, es el procedimiento electrolítico empleando la celda tipo ZADRA. El presente trabajo ha sido aplicado en forma directa a unas soluciones proveniente del proceso de lixiviación en presencia de cianuro de sodio. La composición química de la solución sometida a la electrolisis directa en Celda tipo Zadra es; 33.75 mg Au/l; 5.5 mg Ag/l; 375 mg Fe/l y 1727.5 mg S/l, las deposiciones logradas por este procedimiento son del 98% y 99% para el oro y plata respectivamente.
Palabras Clave: Celda Zadra; Extracción; Oro; Plata
ABSTRACT
One alternative forgold and silver recovery from Au-rich brines is the Zadra electrolytic process. The present work deals with the direct application of the Zadra process to brines obtained as a result of leaching gold containing ores with sodium cyanide. The chemical composition of the solution subjected to electrolysis was 33.75 mg Au/l, 5.5 mg Ag/l, 375 mg Fe/l and 1727.5 mg S/l. The gold and silver achieved electro - deposition were 98% and 99% respectively.
Keywords: Zadra Cell; Electrolytic Extraction; Gold; Silver.
INTRODUCCIÓN
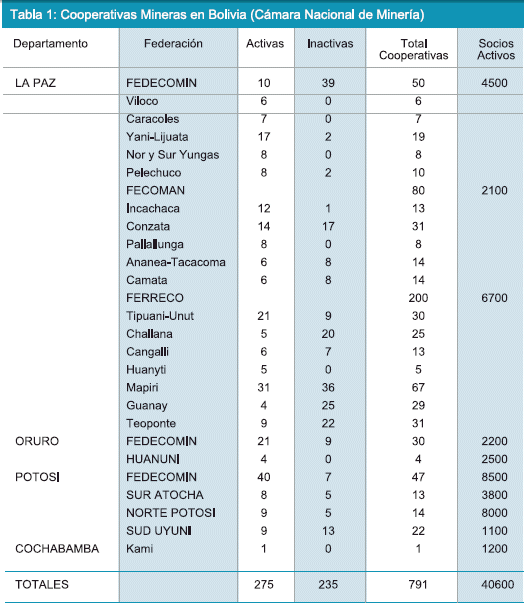
El Departamento de La Paz es catalogado como una región minera aurífera y en ella se han establecido cooperativas mineras dedicadas a la extracción de oro que recuperan de yacimientos mineros de tipo aluvional y yacimientos primarios. La Tabla 1 muestra algunas cooperativas registradas y en actual etapa de trabajo en Bolivia, en el Departamento de La Paz las cooperativas están agrupadas en tres organizaciones sindicales como son FEDECOMIN, FECOMAN y FERRECO (Cámara Nacional de Minería).
La ley 21060 promulgado el año 1986, entre uno de sus objetivos fue la relocalización de mineros que trabajaron en el sector de la minería tradicional de Bolivia, esta relocalización se debió a la crisis minera como consecuencia de la caída de los precios de los minerales en el mercado internacional, por ese motivo se establecieron cooperativas mineras para trabajar en el sector aurífero del Departamento de La Paz que hasta ese entonces no mostraron interés por la explotación y recuperación de oro, aunque la explotación de oro fue promovida desde tiempos de la colonia. Fue a partir de ésta ley que la explotación y recuperación de oro se intensificó en los centros mineros del Departamento de La Paz que mostraron contenidos de oro y plata expectables.
La explotación de yacimientos de tipo primario y secundario, fue realizada con equipo de diseño rústico como canaletas y bateas, posteriormente con la subida de los precios del oro en el mercado internacional, les permitió a algunas cooperativas con una buena organización sindical, mejorar y mecanizar sus ingenios para incrementar la producción aurífera permitiendo generar empleos directos e indirectos.
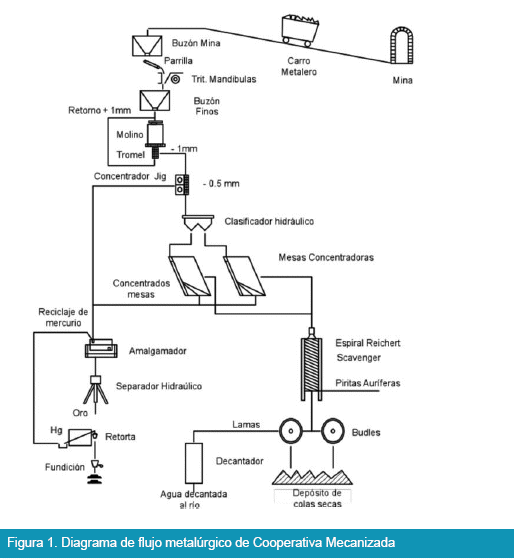
Las cooperativas mecanizadas cuentan con los equipos que se muestran en la Figura 1 como un modelo general, los cuales son destinados para la recuperación de oro libre en forma exclusiva, la implementación de este tipo esquemas metalúrgicos se debió principalmente a los precios altos del oro registrado desde los años 2005 al 2009, además a que contaron con una buena organización sindical.
En la Figura 1, muestra que algunos procedimientos de recuperación de oro no son nada amigable con el medio ambiente y principalmente con la salud de los trabajadores y de sus familiares, debido a que en el circuito de tratamiento utilizan mercurio para poder colectar el oro y una posterior etapa de quema del mercurio en bateas fue practicada sin control.
Las cooperativas con mejor equipamiento muestran instalaciones de similares características al señalado en la Figura 1, por su parte las cooperativas pequeñas que poseen pocos equipos tienden a tener la misma línea de equipamiento en sus ingenios cuyo propósito es lograr recuperar la mayor cantidad de oro libre.
Actualmente la recuperación de oro es buena y pareciera que todo les favorece, por ejemplo precios altos del oro en el mercado internacional 900$us/OT, el gobierno actual muestra su apoyo a este sector, por lo tanto, es el momento de mostrar algunas alternativas técnicas (Alarcón, 2003).
El presente trabajo de investigación de tipo aplicativa se fundamenta principalmente en aplicar el proceso de electrolisis en celda de tipo Zadra y en la Figura 1 se puede observar varios aspectos, como: El oro que se recupera es de granulometría gruesa; el oro de granulometría fina no es posible su recuperación; la recuperación de oro se hace mediante amalgamación el cual es perjudicial debido a que el mercurio se atomiza por la presencia de elementos como azufre, arsénico, etc.; la recuperación de oro sólo alcanza el 40% aproximadamente, debido a que no todo el oro esta liberado y los minerales de veta traen gran cantidad de piritas con contenidos altos en oro del cual es difícil su recuperación con el procedimiento de la Figura 1.; existe una contaminación por efecto del mercurio y la presencia de lamas, estos productos se constituyen en contaminantes debido a que salen del circuito con dirección al río en forma no controlada.
El presente trabajo pretende mostrar una alternativa para incrementar la recuperación de oro-plata y el proceso electrolítico grande tipo Zadra se hace amigable para el tratamiento de minerales de oro y plata por su efectividad y cuidado que son aplicable a soluciones ricas en oro y plata principalmente, para el cual debe estar resuelto la etapa de concentración gravimétrica y la etapa de lixiviación.
ASPECTOS TEÓRICOS
Lixiviación de oro y plata
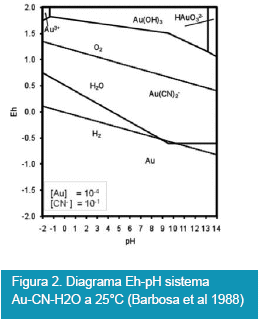
El proceso hidrometalúrgico de cianuración de oro y plata (Barbosa et al. 1988), se rige por la termodinámica el cual es resumido en los diagramas Eh-pH (potencial-potencial de hidrógeno). La estabilidad del proceso de cianuración de oro y plata fue reportada por Barbosa y Monhemius en los siguientes diagramas de áreas de predominancia mostradas en las Figuras 2 y 3.
En estas figuras se muestran la factibilidad de cianuración de oro y plata en rangos de pH mayores a 9.21 con concentración molal de :
Au y Ag igual a 10-4molal y CN--=10-1molal
Figura 2. Diagrama Eh-pH sistema Au-CN-H2O a 25°C (Barbosa et al 1988)
Las siguientes reacciones demuestran la posibilidad de lixiviar oro y plata por cianuración (Habashi, 1980):
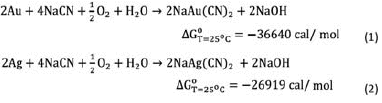
Las energías libres de Gibbs fueron determinados tomando como referencias la base de datos del software HSC 6.0 (Roine et al. 2006), este programa computacional está basado en una buena información termodinámica.
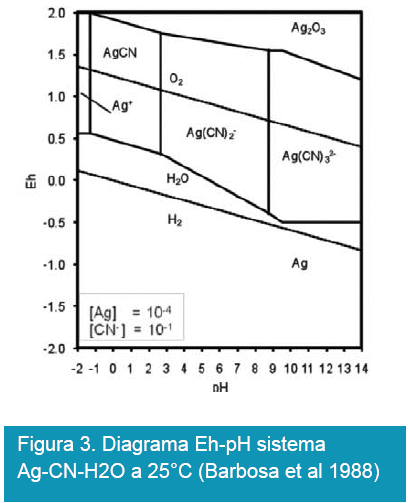
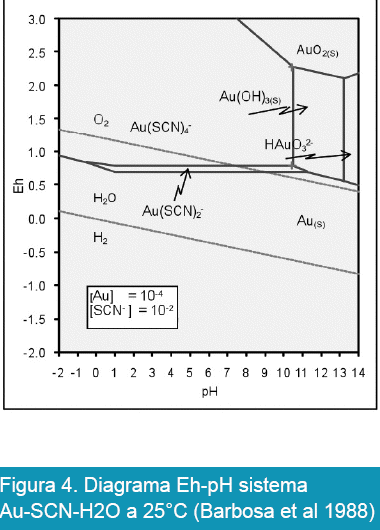
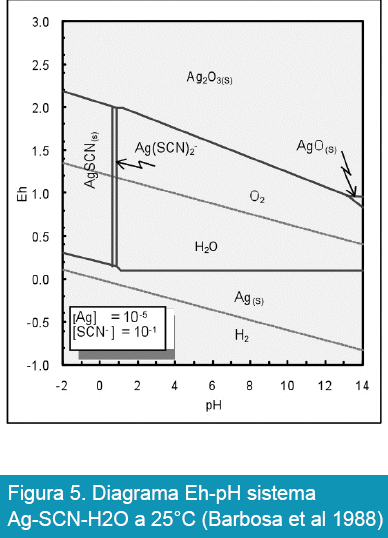
Por otra parte, la posibilidad de recuperar los metales preciosos por cianuración se complica cuando en los minerales se presentan compuestos de azufre, ésta imposibilidad se puede observar en las Figuras 4 y 5.
En la Figura 4 se puede observar la imposibilidad de realizar el proceso de cianuración del oro en presencia de azufre a menos que se pueda bajar el pH hasta valores inferiores a 8, sin embargo a estos valores la presencia de HCN se incrementa de acuerdo con la siguiente expresión:
![]()
Donde Ka = 10 921 es la constante de equilibrio de la siguiente reacción:
![]()
Por otra parte, en la Figura 5 también se puede observar la alternativa de recuperación de plata por cianuración en presencia de azufre, esta posibilidad es mayor comparando con la recuperación de oro, lo anterior se debe principalmente a las propiedades termodinámicas de la plata que son más favorables respecto al oro.
Electrólisis
La electrolisis de oro y plata a partir de soluciones también se basa en los anteriores diagramas mostradas en las Figuras 2 y 3 y las semireacciones que se desarrollan en el proceso electrolítico son:

Al utilizar la Ley de Hess, para las anteriores reacciones, se tiene la inversa de la reacción de Elsner, dada en la reacción (1):
![]()
De la misma forma se tendrá la inversa de la reacción (2) para la electrolisis de plata:
![]()
Las reacciones (10) y (11) son las que se consideran en el proceso de electrólisis en celda convencional y en la electrólisis realizada en la celda tipo Zadra.
El trabajo de investigación anteriormente realizado es "Electroobtención de oro a partir de soluciones cianuradas" (Valda, 1987), en este estudio, las pruebas fueron efectuados a escala de laboratorio considerándose como una investigación básica. La solución de oro registró una ley de oro de 6 mg/l considerado como licor pobre, las pruebas experimentales fueron realizados en celda electrolítica convencional cuyos resultados de recuperación reportados fue del 80.91% de oro cuando se trabajó a una temperatura de 30°C, sin embargo no explicaron los resultados de sus pruebas experimentales.
Un segundo trabajo titulado "Desarrollo de un sistema de electrorecuperación de oro plata desde soluciones diluidas de cianuración de minerales" (García et al. 1992), consistiendo de pruebas a escala laboratorio y escala piloto. Para las pruebas de laboratorio prepararon una muestra sintética cuya composición fue de 30 mg/l de Au, 215 mg/l de Ag y 500 mg/l de Cu, los experimentos fueron efectuados en un conjunto de celdas con cátodos de lana de acero similar a la celda Zadra, adicionalmente realizaron pruebas a nivel industrial con minerales procedente de la mina El Espinillo La Rioja Argentina, en sus experimentos encontraron muchas dificultades como la formación de lamas los cuales fueron floculados con cal, sin embargo el ión calcio les interfería en la electrólisis y para resolver el problema generado usaron carbonato de sodio para precipitar el calcio y su recuperación subió hasta valores del 95% pero al transcurrir el tiempo esta recuperación bajo al 50% el cual atribuyeron a la presencia de las lamas.
MÉTODOS
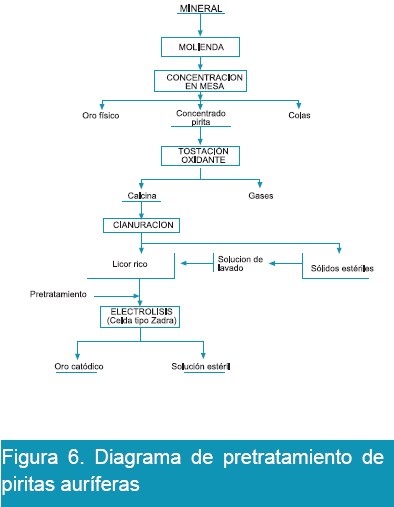
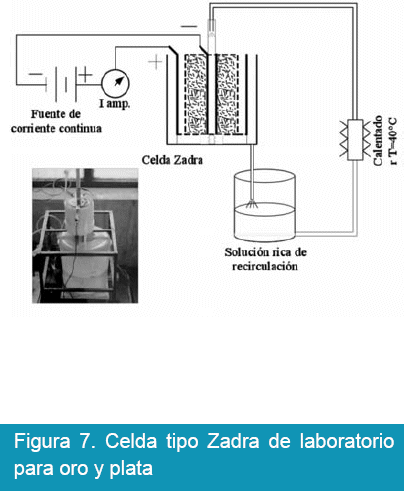
Para desarrollar el trabajo experimental se ha seguido el esquema mostrado en la Figura 6. En ella se muestra los pasos consecutivos para lograr en lo posible tenores altos de oro y plata en solución, ésta solución rica es destinada a tratamiento por electrólisis en celda tipo Zadra, cuya disposición de los equipos de electrólisis de celda de tipo Zadra se muestra en la Figura 7.
Como se puede observar en la Figura 6, en la etapa de tratamiento gravimétrico se recupera oro libre, concentrado de pirita y colas de descarte. El concentrado de pirita fue sometido a tostación oxidante para eliminar azufre y liberar el oro, la calcina fue sometida a lixiviación por agitación en solución de NaCN en un rango de pH entre 9.5 a 10.5, el cianuro libre fue controlado por titulación con nitrato de plata estandarizada. La solución rica fue directamente destinada para su tratamiento por el proceso electrolítico en celda tipo Zadra
La celda tipo Zadra, como se puede observar en la Figura 7, fue construido en PVC (cloruro de polivinilo) de 3 plg. de diámetro y 12 cm de alto, el cual se encuentra enchapada de acero inoxidable que sirve como ánodo, el cátodo está conformado por viruta de acero inoxidable confinado dentro de una malla tubular de 2 plg. también de acero inoxidable. La solución rica es alimentada por un tubo de % plg. instalado en el eje axial del cátodo. La solución fluye en contracorriente con un caudal de 428.5 ml/min hacia el rebalse acoplado a la celda tipo Zadra, y es alimentado a un deposito acondicionador que tiene la finalidad de controlar la temperatura y el contenido de oro, para luego recircular la solución a la celda electrolítica.
RESULTADOS Y DISCUSIÓN
El mineral está constituido por piritas auríferas y es procedente de la Cooperativa Minera Aurífera Cotapata localizada a 20 km de la ciudad de La Paz, la composición aproximada de oro es de 112.04 g/t (este tenor alto fue determinado por pruebas fire assay en los laboratorios del IIMETMAT y SGS La Paz). La mineralogía de la muestra mineral (Alarcón 2003) se muestra en la Tabla 2.
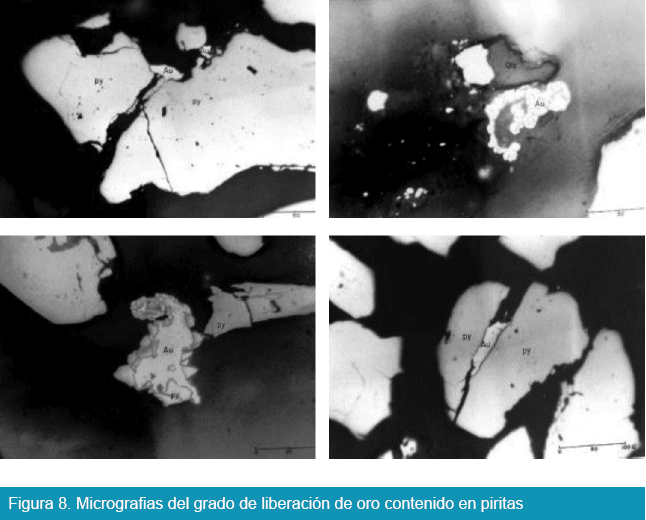
El grado de liberación de oro se puede observar en las micrografías de la Figura 8.
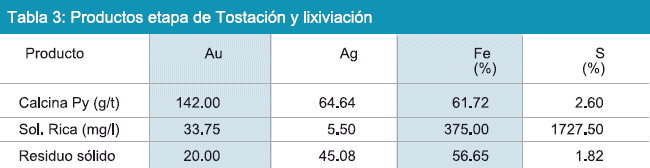
En la Figura 8, se observa pirita que se encuentra como base de oro liberado. Con este criterio el mineral fue sometido a molienda y recuperación de oro físico por procesos gravimétricos como una etapa preliminar, obteniéndose tres productos; oro físico, concentrado y colas finales según la establecido en la Figura 6. El material que se sometió a tostación oxidante fue el concentrado y el producto de este proceso se destinó a cianuración (no siendo objetivo de éste trabajo analizar la concentración gravimétrica ni los procesos de tostación y cianuración). La composición química de los productos de la etapa preliminar, se muestra en la Tabla 3.
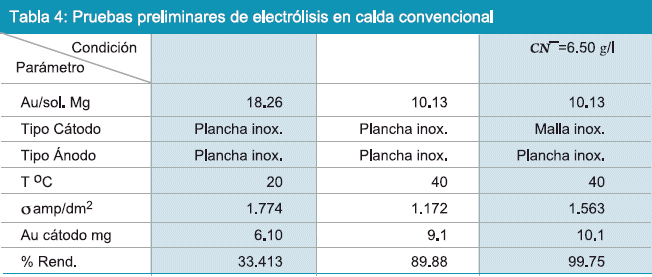
La solución rica obtenida del proceso de cianuración, muestra un contenido de 33.75 mg/l de oro, éste producto se destinó a la celda tipo Zadra, para el cual fueron realizadas pruebas preliminares en celda convencional cuyo objetivo fue determinar parámetros técnicos para aplicación en celda tipo Zadra. Los resultados de éstas pruebas se muestran en la tabla 4. En la Tabla 4, se puede observar tres pruebas realizadas en celda convencional, el rendimiento del proceso de electrólisis llega al 33.41 % cuando la prueba fue realizado sin la adición de exceso de CN niNa+ estos rendimientos suben hasta 89.88% cuando fue agregada a la solución 0.40g Na+ y 99.75% cuando se agregó 6.50g CN a 40°C. Para las pruebas en celda tipo Zadra se ha tomado en cuenta los anteriores parámetros y se usó viruta de acero como cátodo cuya composición se detalla en la Tabla 5.
Los parámetros utilizados para realizar las pruebas en celda tipo Zadra, se resumen en la Tabla 6.
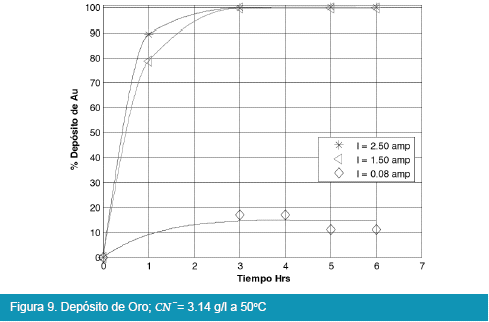
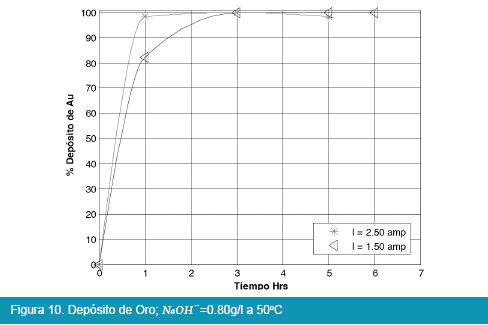
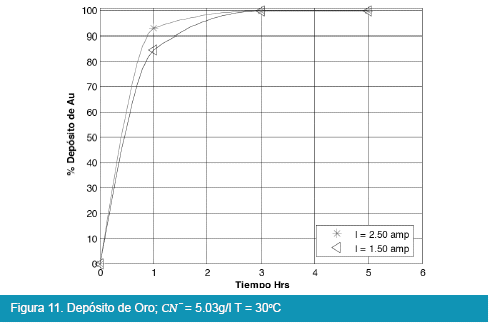
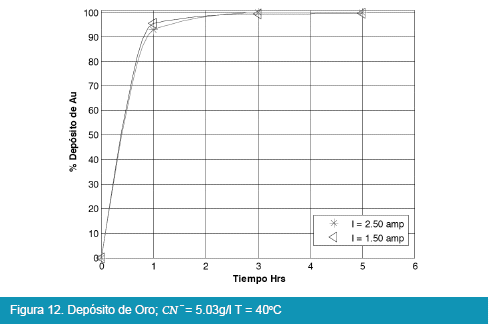
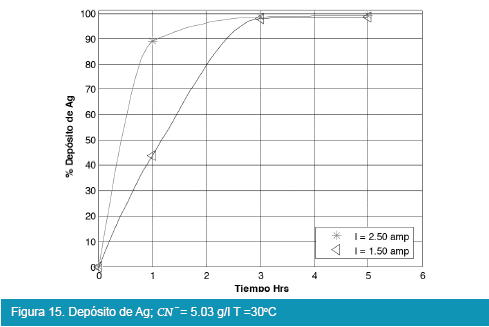
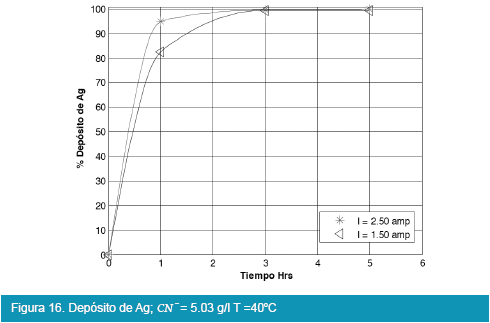
Los resultados de las pruebas en celda tipo Zadra se muestran en las siguientes figuras:
De los anteriores resultados, el proceso de electrolisis en celda tipo Zadra, para el caso del oro, llega a rendimientos del 98% en un tiempo óptimo de tres horas de electrolisis con un caudal de recirculación de la solución de 25.71 l/hr. La intensidad de corriente más adecuada para la electrolisis es de 1.5 a 2.5 amp. llegando a depositar hasta el 98%, y no así cuando se trabaja a una intensidad de corriente igual a 0.08 amp.
Por otra parte también se ha observado la deposición de complejos cianurados de hierro como ferrocianuros y ferricianuros férricos los cuales adquirieron una coloración azul tanto en el cátodo como en el ánodo, estos compuestos han sido de difícil separación en el tratamiento de limpieza del oro depositado.
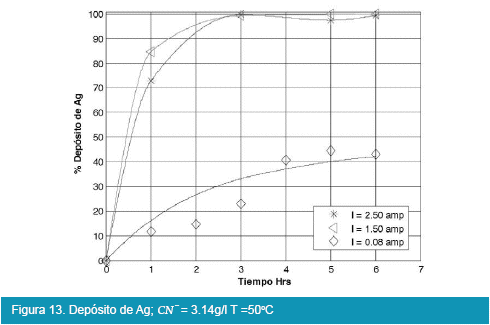
Los resultados de la electrodeposición de plata se presentan en las siguientes figuras:
De las Figuras 13, 14, 15 y 16, para el caso de la deposición de plata utilizando viruta de acero inoxidable de la celda tipo Zadra, llega a rendimientos del 99% en un tiempo óptimo de tres horas de electrolisis, en similitud con la electrólisis del oro.
Comparando las Figuras 9, 10, 11 y 12 con las Figuras 13, 14, 15 y 16 que corresponden a la electrólisis de oro y plata respectivamente, la temperatura es un factor determinante para la electrodeposición de oro, es así que un rango aceptable de temperatura es de 30 a 40°C con recuperaciones en oro que llegan a valores del 98 %.
CONCLUSIONES Y PROYECIONES
En la composición mineralógica del mineral, el oro está constituido por 90% de pirita y 1 0% está asociado con cuarzo y otros constituyentes. El grado de liberación de la muestra a tamaños -75um alcanzó al 83.34%, por lo tanto la muestra fue molida a -105um posibilitando la aplicación del procesos gravimétricos como etapa preliminar.
La solución rica, procedente de cianuración contiene tenores como 33.75 mgAu/l, 5.5 mgAg/l, 375 mgFe/l, 1727.5 mgS/l y 17.7 milimhos/cm de conductividad, en estas condiciones fueron realizadas pruebas de electrólisis en celda convencional lográndose deposiciones en el rango de 33.4 a 97% de oro.
En la realización de las pruebas de electrolisis en celda tipo Zadra, fueron considerados el tiempo de electrólisis, la intensidad de corriente, la temperatura y el efecto de adición de reactivos como el cianuro de sodio e hidróxido de sodio, alcanzando recuperaciones del 98% de oro y 99% de plata con una intensidad de corriente de 1.5 Amp. y 30 a 40°C de temperatura, en 3 hrs. de electrólisis y con un flujo de solución de 25.71 l/hr, siendo las mejores condiciones de trabajo para la electrolisis en celda tipo Zadra.
El efecto del cianuro de sodio e hidróxido de sodio, mejoran la recuperación de oro y plata cuyos resultados llegan al 98% de oro cuando fue adicionado hidróxido de sodio y al 93% de recuperación de oro cuando fue adicionado cianuro de sodio, estos resultados son muy buenos comparados a cuando se trabaja sin la adición de los anteriores reactivos lográndose recuperaciones del 79% de oro. El comportamiento de la recuperación electrolítica de la plata es similar al caso del oro.
El efecto de los contaminantes como el caso del calcio, hierro y azufre, en la electrolisis en celda de tipo Zadra no han mostrado una incidencia significativa, aunque en el proceso tanto en celda convencional como en celda de tipo Zadra se ha observado deposiciones posiblemente de complejos de hierro-cianuro el cual no fue estudiado, sin embargo debe ser una condición necesaria controlar hierro y el azufre para trabajar en los procesos de cia-nuración y electrolisis, este aspecto está fundamentado en los diagramas Eh-pH.
El proceso de electrolisis en celda tipo Zadra para la recuperación de oro y plata es técnicamente factible y aplicable a soluciones procedentes de la etapa de cianuración. Sin embargo deben ser realizados, anteriormente, los procedimientos gravimétricos, tostación y lixiviación.
El proceso de electrolisis en celda tipo Zadra, también puede ser aplicado en pequeña escala lo cual ayudaría a las Cooperativas y Empresas mineras pequeñas dedicadas a la extracción de oro y plata a mejorar su producción.
AGRADECIMIENTOS
El autor desea agradecer al Instituto de Investigaciones Metalúrgicas UMSA por financiar y permitir la realización del presente estudio, a la Cooperativa Minera Cotapata por prestarnos toda la colaboración y entregarnos un mineral muy seleccionado en contenido de oro.
BIBLIOGRAFÍA
Alarcón, B. H. (2003). Caracterización mineralógica y grado de liberación de oro. Informe de resultados, Instituto de Geología y Medio Ambiente. Universidad Mayor de San Andrés, La Paz. [ Links ]
Barbosa, O., Monhemius, A. J. (1988). Thermochemistry of Thiocyanate systems for leaching Goldand Silverores. Precious Metals '89. The Minerals, Metals & Materials Society. 40, 307-339. [ Links ]
García, J. A., Núñez, E. A., Montenegro, C. A., Meissl, R. J., De La Iglesia, D.
(1992). Desarrollo de un sistema de electrorecuperación de oro y plata desde soluciones diluidas de cianuración de minerales. Pp. 261-265. VII Congreso Nacional de Metalurgia, Universidad de Concepción, Concepción.
Habashi, F. (1980). Principles of Extractive Metallurgy. Pp. 24-42. Hydrometallurgy. La-val University. Gordon and Breach, Science Publishers, Canada. [ Links ]
Roine, A., Mansikka-aho, J., Björklund, R (2006). HSC Chemistry 6.0. Outokumpu Technology Research Oy. [ Links ]
Valda, M. F. (1987). Electroobtención de oro a partir de soluciones cianuradas. Tesis de Grado, Carrera de Ingeniería Metalúrgicas, Universidad Mayor de San Andrés, La Paz. [ Links ]