Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista Médico-Científica Luz y Vida
versión impresa ISSN 2219-8032
Rev. Méd.-Cient. Luz Vida v.2 n.1 Cochabamba 2011
ARTÍCULO DE REVISIÓN
BIOLOGÍA DE ALTURA / ALTITUDE BIOLOGY
GASOMETRÍA ARTERIAL Y ADAPTACIÓN EN LA ALTURA
ARTERIAL BLOOD GAS ANALYSIS AND HEIGHT ADAPTATION
Hinojosa-Campero Walter Emilio1
Correspondencia / correspondence: Walter Emilio Hinojosa-Campero
e-mail: walhinojosa@yahoo.com
Recibido para publicación / Received for publication: 27/08/2011
Aceptado para publicación / Accepted for publication: 12/09/2011
RESUMEN
Se hace una revisión detallada de la gasometría arterial en la altura, tomando en cuenta las variables conocidas de todo reporte gasométrico, en función de los cambios de Presión Barométrica, a diferentes altitudes, comparando con los datos gasométricos a nivel del mar y los reportes gasométricos de montañistas en ascenso, respirando aire ambiente en altitudes extremas.
Así mismo, se establecen algunas bases para determinar la adaptación del ser humano a distintas altitudes, las consecuencias fisiológicas de ello, y los conceptos de una adecuada interpretación y significación clínica de un reporte gasométrico como tal.
Palabras Clave: Gasometría arterial, Altitud extrema, Adaptación y significación clínica.
ABSTRACT
It was conducted a detailed review of arterial blood gas analysis at altitude, taking into account well known variables of arterial blood gas report, depending on the barometric pressure changes at different altitudes. It was compared arterial blood gas analysis data at sea level and reports of climbers on the rise, breathing air at extreme altitudes.
Likewise, it was established some basis for determining the human adaptation to different altitudes, the physiological consequences of this, and the concepts of appropriate interpretation and clinical significance of Arterial blood gas analysis itself.
Keywords: Arterial blood gas analysis, Extreme altitude, Adaptation and clinical significance.
Es indudable, que la medición de los gases en sangre arterial, tiene como base un influjo directo de principios básicos de la Física y la Química. La Presión Barométrica (PB) actúa como un Director de Orquesta, ordenando la presión parcial de los gases tanto en el medio ambiente como a nivel alveolar pulmonar. El concepto que debe primar es que para una determinada Presión Barométrica, la Presión de O2 y CO2 será distinta, sin que eso signifique, por comparación, que a latitudes y altitudes diferentes, los sujetos que viven por encima de los 3000 mts sobre el nivel del mar (3000 mts. s.n.m.) se encuentran en un estado relativo de hipoxia. Dicho concepto debe ser repensado, ya que la composición del aire, es porcentualmente el mismo, tanto a nivel del mar como en la punta del Illimani. Lo que varía indudablemente es la presión barométrica y por ende la presión parcial de los gases.1,2
Tabla 1. Valores de Presión barométrica, Presión parcial de O2 y temperatura, de acuerdo a la altitud.

mts: metros; s.n.m.: sobre el nivel del mar; mmHg: milímetros de mercurio; °C: grado centígrado.
Paul Bert (1878) ya describió con precisión que los trastornos producidos por la altura sobre el organismo, tienen su punto de partida en una menor Presión Barométrica, lo que genera una menor presión inspiratoria de oxígeno, con una disminución leve de la saturación de O2 en la Hemoglobina y una menor tensión de O2 en los gases arteriales.
PIO2 = FIO2 (PB - 47)
West JB y col, publicó la relación de cambios barométricos y la FIO2, en una escala de pies y mts desde los 1000 mts hasta los 9000 mts s.n.m. misma que se transcribe:3
Tabla 2. Cambios en la Presión barométrica y la PO2 inspirada con la altitud.
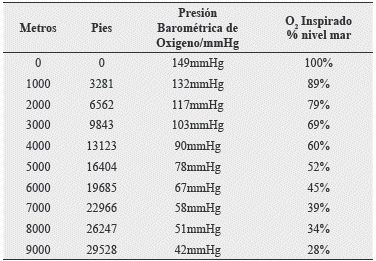
Fuente: West JB, Schoene RB, Milledge JS, High Altitude Medicine and Physiology. 4th ed. London-Great Britain: Hodder Arnold; 2007.
GASOMETRÍA ARTERIAL EN LA CIUDAD DE LA PAZ
La ciudad de La Paz, se encuentra a un a altura de 3577 mts s.n.m., referencia citada por el Instituto Boliviano de Biología de Altura (IBBA),5 tomando en cuenta la altitud de la Plaza Murillo, con una PB de 490 mmHg y una FIO2 de 0,21 (21%) y Nitrógeno 79%, con variaciones climáticas muy especiales, donde resalta la escasa humedad del medio ambiente, tal como se demuestra en la siguiente tabla:
Tabla 3. Valores máximos, mínimos y humedad relativa de acuerdo a la estación.

El clima prácticamente seco de La Paz, hace que los problemas de vías respiratorias superiores tengan su peculiaridad, con manifestaciones clínicas compatibles con la sequedad de las mucosas rinofaríngeas.
COMPARACIÓN DE VALORES GASOMÉTRICOS EN LA PAZ Y A NIVEL DEL MAR
Tabla 4. Comparación valores gasométricos: La Paz vs Nivel del Mar.
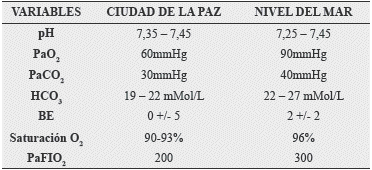
Fuente: Parámetros Biológicos Normales, IBBA, VIII Juegos Deportivos Bolivarianos; 1977.
De sólo observar el cuadro comparativo, se puede inferir que tanto la Presión Parcial de O2 y CO2 están por debajo de los encontrados a nivel del mar, así como el bicarbonato sérico, que también se encuentra disminuido, sin embargo, los valores en la altura, están en estricta relación con la PB a nivel de La Paz, por lo tanto los valores citados son una expresión indudable, de las constantes físicas que gobiernan el desplazamiento de los gases medio ambiente hasta llegar al alveolo y su posterior transferencia al sistema capilar arteriolar, luego de sucedido el intercambio gaseoso vital, para la conservación y el equilibrio del estado acido base en la altura.
La PaO2 para el nativo de la altura, es una constante normal para su hábitat, sin juzgar a priori, si el sujeto se encuentra hipoxémico o no, ya que el organismo humano en sujetos nativos aclimatados y/o adaptados, conlleva parámetros gasométricos normales, con un pH dentro la normalidad y una PaCO2 disminuida, debido a una mayor eliminación de CO2 secundaria a una leve hiperventilación, que en los adaptados y aclimatados, deja de ser importante, con frecuencias respiratorias tan normales como en los sujetos que viven a nivel del mar. La PaCO2 de 30, refleja el equilibrio entre los elementos ácidos y básicos, si consideramos la disminución del Bicarbonato, como un mecanismo de compensación en la altura. No debemos olvidar una premisa de oro:
"Toda compensación respiratoria, conlleva a una respuesta metabólica"1,2
En otras palabras, si disminuye el CO2, la compensación hará que el bicarbonato disminuya en proporción de la disminución del CO2. Lo propio ocurrirá en los trastornos metabólicos, toda elevación del Bicarbonato, conlleva como respuesta compensatoria la elevación del CO2. De manera simplista y facilitadora para el aprendizaje, cito en uno de mis textos,1 la llave para el entendimiento de las compensaciones, la cual se basa en una frase:
"SIGA LA FLECHA" si disminuye el numerador, debe disminuir el denominador de la ecuación de H. Hasselbach para conservar la relación 20/1.
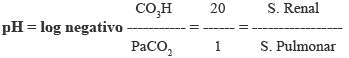
Ejemplo: Caso de Alcalosis Respiratoria = al disminuir la PaCO2, la compensación será: La disminución del bicarbonato.
PaCO2 = 40mmHg, la disminución de la misma a 30mmHg, hará que el Bicarbonato sérico descienda en 5 mMol/L, tal cual acontece en los sujetos que viven a nivel de la ciudad de La Paz. Ya que el Bicarbonato a nivel del mar es de 25 a 27 y en la ciudad de La Paz es de 19 a 22 mMol/L.
La regla dice: Por cada 10 mmHg que desciende el CO2, el Bicarbonato debe bajar en 5 mMol /l cuando el proceso esta compensado. (1mmHg = 0.5 mMol de Bicarbonato)6
Al parecer, los habitantes de la altura estarían aclimatados con un proceso de Alcalosis respiratoria compensada, lo cual al parecer es completamente falso ya que NINGUNA compensación en los desequilibrios acido base alcanza un pH normal, sin embargo en la altura, el pH sérico se encuentra perfectamente normal, lo que denota que el habitante de la altura, no esta compensado, ni mucho menos en alcalosis respiratoria, sino adaptado con una fisiología muy propia y acondicionada para vivir en la altura, con una capacidad pulmonar total inclusive superior a los habitantes de nivel del mar. La adaptación del habitante de la altura, es fenotípica, ya que la adaptación genotípica tomaría cientos de miles de años, lo cual, es ciertamente aseverado según algunos estudios.7,8
MACIZO ANDINO
Para hablar del habitante de los Andes, debemos retroceder algunos millones de años, a la formación de las placas tectónicas, que hoy en día conocemos como los distintos continentes de nuestro globo terráqueo, estableciendo una antigüedad para nuestro planeta, desde la enunciación de la teoría del Big Bang, en 4800 a 5000 millones de años, época en la cual nuestro planeta se constituyo en una masa con un núcleo candente de miles de grados kelvin, donde debemos recalcar que la materia adoptó un isómero levógiro para sus constituyentes atómicos, lo cual fue definitivo para la constitución de la tierra y su posterior evolución, dando origen con el paso de los años, a formar las primeras células vivas, en zonas acuosas posteriores a distintas y variadas épocas glaciares, agua formada que se constituyó en la VIDA para nuestro planeta.
El macizo Andino tiene una antigüedad de 18 millones de años9,10 y algunas especies de mamíferos como los ancestros de cobayos datan de épocas anteriores al millón de años,9 dichos animales se encuentran adaptados genotípicamente, sin embargo el ser humano andino y su cultura apenas cuentan con un periodo de antigüedad que en el mejor de los casos asciende entre 3000 a 6000 años.
Por lo referido, el ser humano andino, no ha tenido tiempo hasta el momento de adaptarse genéticamente, una prueba muy sencilla de lo afirmado es que un nativo de los Andes, al descender a niveles de la costa, empieza a adaptarse a las dos semanas, para luego adaptarse al comportamiento fisiológico de los costeños a la vuelta de unos meses, así mismo, se postula que los animales genéticamente adaptados a la altura no presentan enfermedades crónicas de la altura, sin embargo los animales traídos por los españoles sufren de enfermedades relacionadas con el hábitat crónico de la altura, así como algunos habitantes de los Andes sufren del Mal de Monge.11,12
Para tener una idea mas aproximada de la evolución de la tierra podemos recurrir al día Brahamánico, de los Vedantas Induistas, sin ser exactos en los 4.320.000 años que se citan por día Brahamánico y suponiendo que el día Brahamanico dure 4.870 millones de años,13 podríamos inferir que las 24 horas del día se dividirían como sigue:
Asumiendo que la tierra comienza inmediatamente después de las 12 de la noche de ayer, a las 8 de la mañana aparecerían los primeros seres vivos llamados Eucariotes, a las 9 aparecerían los organismos multicelulares, a las 10 de la noche se iniciaría la vida fuera del agua, faltando 35 minutos para media noche aparecerían los primeros mamíferos terrestres, los Andes se formarían faltando 10 minutos para el final del día y el ser humano ingresaría al continente americano faltando 3 segundos para finalizar el día.
Por lo expuesto se puede deducir, que la adaptación genotípica de los seres vivos tiene que tomar un largo proceso de tiempo y que las adaptaciones genotípicas son propiedad por el momento de seres vivos, que anteceden al habitante Andino en cientos de miles de años.
ADAPTACIÓN GENÉTICA
Estudios Realizados en el Tibet8 por un grupo de investigadores de nacionalidad China, han reportado la existencia de 50 Exones humanos, que han sido bien tipificados, en los habitantes del Tibet, que viven a más de 4000 mts s.n.m. estos genes presentan un cambio de alelos que con el tiempo serían inductores de una adecuada adaptación genotípica, a continuación cito algunos de los exones más importantes.
Tabla 5. Genes relacionados con la adaptación a grandes alturas.
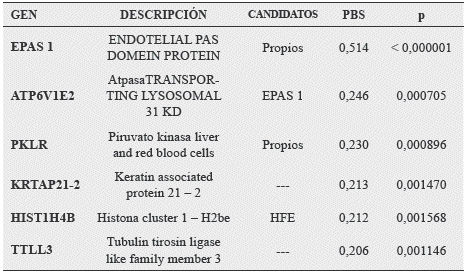
Fuente: Xin yi, Yiu Lang, Huerta E, Zha Xi Fing, Jhon Pool, Hui Jiang, et al. Sequencing of 50 human eximes reveals adaptation to high altitude. Science. 2010;329:75-77.
El EPAS 1 es conocido como Factor inducido por Hipoxia, esta familia de transcriptores génicos consiste de 2 subunidades, cada uno con tres subunidades, las cuales expresan una regulación a nivel fetal pulmonar y placentario y en el endotelio vascular. La desestabilización y/o mutación de los transcriptores, se asocia con la Eritrocitosis Excesiva. (Antiguamente llamada Poliglobulia, Policitemia, Eritrocitosis de Altura)
GASOMETRÍA ARTERIAL Y SATURACIÓN DE OXÍGENO EN ALTURAS EXTREMAS
Botella de Maglia J y colaboradores, citan en un artículo bastante interesante, publicado en la revista de Medicina Intensiva de la federación Panamericana e Iberica de las Sociedades de Medicina Critica y Terapia Intensiva14 la saturación arterial de O2 durante la ascensión a una montaña de 8.035 mts el Gasherbrum II, ubicado en Karakorum, donde se citan los siguientes valores por oximetría pulsar:
Tabla 6. Valores de Oximetría pulsar durante la ascensión a una montaña de 8.035 mts el Gasherbrum II.
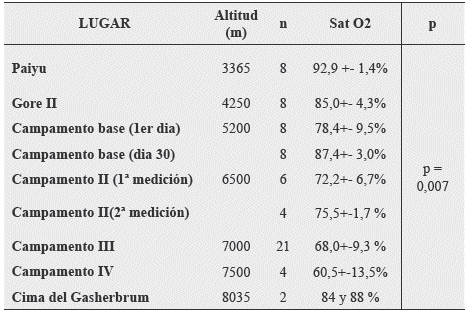
Fuente: Botella de Maglia J, Real-Soriano R, Compte-Torrero L. Saturación Arterial de Oxígeno durante la ascensión a una montaña de más de 8.000 metros. Med Intensiva. 2008;6:277-81.
Los datos vertidos en la Tabla 6, permitieron a los autores inferenciar algunos conceptos:
El aumento de la saturación en el campamento base a 5200 mts s.n.m. en el día 30 concuerda con el concepto de la aclimatación que da por resultado una saturación por oximetría pulsar un tanto más elevada que en el primer día.
La información dada permite calcular aproximadamente el contenido de O2 en sangre arterial a 7000 mts s.n.m. en un supuesto montañéz, misma que tomando en cuenta una Hb de 17.4gr/dl, SatO2: 68% y una PaO2 de 32mmHg, el Contenido total de O2en sangre arterial oscilaría alrededor de 159 ml por litro de sangre. A nivel del mar la cifra sería de 180 a 210 ml. En estas condiciones, bastaría un incremento relativamente pequeño del GC, para mantener un transporte de O2 adecuado en las altitudes descritas.
Las cifras de saturación arterial en la cima de la montaña, son sorprendentes y habrá que considerarlas con suma cautela, ya que no se sabe a ciencia exacta, la variabilidad de las mismas, si el oxímetro de pulso estaba bien colocado, si las manos estaban calientes, si la señal de la pantalla era adecuada, si no había interferencias y otros datos a considerar, sin embargo, West y col. En la American Medical Research Expedition to Everest,3 afirman que el aumento de la saturación a grandes altitudes se podría deber a los estados de hiperventilación, a un aumento de la PAO2, sin embargo en mi modesta opinión, la alcalosis respiratoria acompañante, desplazaría la curva de saturación de Hb hacia la izquierda, lo cual dejaría de tener consistencia con las explicaciones vertidas.
Algunos estudios a la fecha, afirman que la hiperventilación en los ascensos a grandes alturas, es facilitada por una menor viscosidad del aire, lo cual facilita una mejoría apreciable en la saturación arterial.15,16
Los autores del citado estudio, concluyen argumentando que todos los datos obtenidos y los criterios de inclusión y exclusión y la metodología del estudio y la selección de los participantes del estudio, fue exhaustivamente evaluada y que los datos son por demás fiables, pero que como siempre, se deberán cotejar los resultados con otros estudios similares y con las características del mismo.
Un trabajo similar de Michael PW Grocott y col. 2009,17 acerca de los gases arteriales y el contenido de O2 en sangre arterial, en montañistas ascendiendo al monte Everest llega a las siguientes conclusiones:
Tabla 7. Gases arteriales medidos y calculados en 4 sujetos estudio a una altitud de 8400 mts s.n.m. en ascenso al Monte Everest.
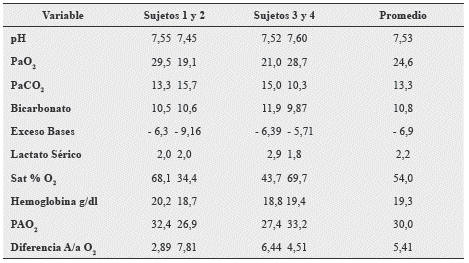
Fuente: Grocott M, et al. Arterial Blood Gases and Oxygen Content in Climbers on Mount Everest. N Eng J med. 2009;360:180-9.
Conclusiones de los autores:
La disminución de la PaO2 es proporcional al descenso barométrico mientras que la saturación de O2 es mantenida pese a los grandes cambios barométricos con la altitud.
Incrementos en la concentración de Hb compensan el contenido arterial de O2 hasta niveles que alcanzan los 7000 mts. s.n.m.
No se pudo demostrar, alteraciones neurocognitivas que avalaran disturbios serios de hipoxia hipobárica cerebral.
El metabolismo anaeróbico no contribuye substancialmente a la producción de energía en extremas altitudes, ya que los niveles de lactato sérico medidos, no excedieron el rango de 2.2 mMol/L siempre y cuando las personas, estuvieran en reposo.
Los resultados del estudio de Grocott, son consistentes con otros estudios en condiciones hipobáricas18-21 acotando que en este estudio, las muestras arteriales fueron hechas en sujetos en posición supina, lo cual no descarta la influencia del peso gravitatorio pulmonar, microatelectasias basales o un estado de hiperflujo central pulmonar, por otra parte habría que considerar el flujo sanguíneo y las diferencias de presión alveolar y capilar, en las distintas zonas de West, así como, las alteraciones de mal ventilación/perfusión en altitudes extremas.
Así mismo, llama la atención, que no se pudiera demostrar alteraciones neurocognitivas por hipoxia hipobárica cerebral, ya que Ken-ichi Iwasaki y col,22 afirman contundentemente que en condiciones agudas y crónicas de hipoxia hipobárica, en altitudes extremas, existe un bloqueo de la autorregulación dinámica cerebral, inclusive en sujetos aclimatados a extremas alturas, el mecanismo básico para esta desadaptación estriba en la hipoxia hipobárica, misma que dilata arteriolas cerebrales distales, sobrepasando los efectos naturales de la hipocapnea, sin embargo existiría también un estado de vasoconstricción arteriolar cerebral, secundario a un desequilibrio entre la actividad simpática, liberación de citokinas, endotelinas, oxido nítrico, sintasa bNOs (brain) autacoides, adenosina y otros,23-26 todo ello, conllevaría a un edema cerebral vasogénico, bajo una premisa muy importante: aún en individuos bien aclimatados, los mecanismos de autorregulación cerebral nunca retornan a la normalidad, en casos de altitud extrema.22
El estudio de Iwasaki, fue realizado con la colaboración de 11 alpinistas daneses, bajo la dirección del Comité Científico de Copenhagen, la Universidad de Texas Sothwestern y el Hospital Presbiteriano de Dallas, habiendo establecido como zona de aclimatación en su momento, los nevados de Chacaltaya (5.260 mts. s.n.m.) La Paz, Bolivia, por espacio de un mes.
Quizás habría que considerar, que en el mecanismo de autorregulación cerebral, es de suma importancia el establecer, el efecto "buffer" craneoespinal,27 el mismo que de alguna manera, tiene que jugar un rol preponderante.
SIGNIFICACION CLÍNICA ÁCIDO BASE DE UNA GASOMETRÍA ARTERIAL
La interpretación de una gasometría puede inferir diagnósticos tan precisos como una acidopatía tubular renal distal o proximal,1,2,28 sin embargo resumiré la significación clínica gasométrica, en relación al tema, mediante dos factores:
1. Factores Cualitativos
2. Factores Cuantitativos
Factores Cualitativos:
Los factores que denotan severidad y/o gravedad son la PaCO2, la PaO2 y el pH. Un pH de 7,20 en un Diabético no es tan alarmante como el mismo pH en un sujeto con crisis asmática, ya que el Diabético descompensado, adquiere gravedad en cuanto al análisis gasométrico, cuando el pH se encuentra en 7,00 o menos, sin embargo en un sujeto en crisis asmática, en estado de acidosis franca asociado a una PaCO2 elevada, es una clara indicación para optar por la ventilación mecánica, caso contrario la vida del sujeto correría riesgo inminente de muerte. Por lo referido, fácilmente vemos que la PaCO2 adquiere mucha importancia clínica, cuando hablamos de insuficiencia respiratoria aguda.
En la altura, si comparamos, la PaO2 nuestra con un nativo del nivel del mar, considerando el análisis de un sujeto nativo de la costa, con seguridad que, una PaO2 de 60 mmHg para ellos, es sinónimo de Hipoxia moderada a severa y constituye una clara indicación para intubación orotraqueal y apoyo de ventilación mecánica, lo cual me permite imaginar a todos los habitantes de La Paz, cargando como mochila un ventilador portátil y comunicándonos por señas al estar todos intubados, obviamente que lo aseverado es un disparate de lesa magnitud, ya que nosotros llevamos una vida tan normal como cualquier prójimo de la costa.
Factores Cuantitativos:
Estos factores son facilitadores del cálculo, para la administración de bases o ácidos, en los desequilibrios acido base. Entre ellos tenemos al BE ó déficit o exceso de bases.,la Saturación de O2, el bicarbonato y la PaFIO2, ésta última con doble función, ya que es un parámetro de factor pronóstico y terapéutico en sujetos con insuficiencia respiratoria, así como el bicarbonato, que denota también severidad en los estados de acidosis metabólica o acidosis mixta.
UTILIDAD DE LA PaFIO2 Y DEL LACTATO SÉRICO
La relación de la PaO2 y la FIO2, es una constante que se viene manejando, con fines pronósticos tanto en la insuficiencia respiratoria aguda, como para el manejo del destete de la ventilación mecánica. Desde ya y bajo un concepto muy simple, un sujeto con una FIO2 de 0,45 (medio ambiente es 0,21) lo cual deja suponer que el mismo se encuentra bajo oxígenoterapia, cuya gasometría refiera una PaO2 de 60 mmHg, ya constituye un signo de alarma, ya que un pulmón normal, oxigenado con una FIO2 de 0.45, debería reportar gasométricamente una PaO2 muy por encima de lo normal, por lo tanto, una PaO2 de 60 mmHg, no significa un estado de normoxemia, para el caso citado, sino un estado de hipoxemia.
La relación PaO2/FIO2, tiene valores límite/mínimo aceptables o inferiores normales definidos en la actualidad, tanto para nivel del mar (300) como para la altura.
- Ejemplo: La Paz (200) esta constante se calcula dividiendo la PaO2 entre la FIO2.
- Ejemplo: Sujeto a nivel del mar y comparativamente en La Paz (3600 mts s.n.m.) y la punta del Everest (8848 mts.s.n.m.)
Tabla 8. Valores de PaO2, FIO2 y de la relación PaO2/FIO2

Todo sujeto con insuficiencia respiratoria aguda, con apoyo ventilatorio o en tubo en T o bajo apoyo de CPAP (Continuos Positive Airway Pressure), debe ser valorado mediante esta constante, ya que valores por debajo de los citados (300 a n.m. y 200 en La Paz) infieren un mal pronóstico ya sea para el destete de la ventilación mecánica o para la extubación del paciente.
Por otra parte en la Lesión Pulmonar Aguda (LPA) el valor a tomar en cuenta, según el consenso de la SBMCTI para una altura de 3600 mts. es de 200 para aseverar una LPA y menos de 100 para determinar un Sindrome de Distres Respiratorio Agudo.
Como es por todos conocido, el reporte de la PaFIO2, conforma parte del reporte gasométrico en la actualidad, debido a su amplia utilidad en los casos citados. Así como, la interpretación de los niveles de Lactato sérico, cuyo reporte es de un valor incalculable, para el manejo del paciente crítico, la sepsis y la lacticidemia secundaria al estado hipóxico.29-31
CONCLUSIONES
La Gasometría arterial en la altura, debe ser interpretada con suma precaución y aplicación de conceptos básicos que tienen que ver con los cambios de presión de los gases arteriales en relación a las condiciones barométricas, fijadas para cada altitud.
Es menester conceptualizar, que el único desequilibrio acido base, que confronta un pH dentro lo normal, en su estado compensado es la Alcalosis Respiratoria. Las variables actualmente utilizadas, en el análisis gasométrico, como la Pa/FIO2, la FIO2, el acido láctico, la Hemoglobina, la Temperatura y otros, deben ser analizadas en relación con el proceso desencadenante y la aplicabilidad de los mismos, deberá ser correlacionado con la clínica y factores de morbilidad predictivos.
NOTAS
1MD - Médico Especialista Medicina Crítica y Terapia Intensiva. Past President Sociedad Boliviana de Medicina Crítica y Terapia Intensiva. Miembro de Número Critical Care Society-USA. Jefe Unidad de Terapia Intensiva, Hospital de Clínicas-La Paz. Profesor Emérito, Universidad Mayor de San Andrés. La Paz, Bolivia.
Este artículo debe citarse como: Hinojosa-Campero WE. Gasometría arterial y adaptación en la altura. Rev Méd-Cient "Luz Vida". 2011;2(1):39-45.
This article shouldbe citedas: Hinojosa-Campero WE. Arterial blood gas analysis and height adaptation. Rev Méd-Cient "Luz Vida". 2011;2(1):39-45.
REFERENCIAS BIBLIOGRÁFICAS
1. Hinojosa W. Fisiopatología Clínica. Módulos de enseñanza basados en casos problema. 1a ed. Bs As-Argentina: Editorial Grupo Guía; 2004. [ Links ]
2. Hinojosa W. Módulo de autoinstrucción: Gasometria arterial, Interpretación Clínica. La Paz-Bolivia: UMSA; 2005. [ Links ]
3. West JB, Schoene RB, Milledge JS. High altitude medicine and physiology. 4thed: London-Great Britain: HodderArnold; 2007. [ Links ]
4. Taylor A. High Altitude Illnesses: Physiology, Risk factors, prevention and treatment. Rambam Maimonides Medical Journal. 2011;1:2-18. [ Links ]
5. Instituto Boliviano de Biología de Altura. Parámetros Biológicos Normales. IBBA-VIII Juegos Deportivos Bolivarianos; 1977. [ Links ]
6. Ergueta J, Hinojosa W, editores. Fisiopatología clínica, Tomo 1. La Paz-Bolivia: Editorial Gramma; 1989. [ Links ]
7. MacInnis J, Kohele M, Rupert JL. Evidence for a genetic basis for Altitude Illness: 2010 Update. High Alt Med Biol. 2010;11:349-68. [ Links ]
8. Xin yi, Yiu Lang, Huerta E, Zha Xi Fing, Jhon Pool, Hui Jiang, et al. Sequencing of 50 human eximes reveals adaptation to high altitude. Science. 2010;329:75-77. [ Links ]
9. Enfermedad de la altura, Los Andes [Internet]. 2009 [citado 2009]. Disponible en: http//mazinger.sisih.uchile.cl/reposito-rio/ciencias_veterinarias_y_pecuarias [ Links ]
10. Hurtado A. La influencia sobre el hombre de la altura. OMS; 1970. [ Links ]
11. Monje C. Bases biológicas del mal de montaña crónico. Perú: Universidad Cayetano Heredia Instituto de Investigaciones de Altura y Departamento de Ciencias Fisiológicas; 1992. [ Links ]
12. Aparicio O. Texto de Medicina de la altura. 1a ed. La Paz-Bolivia: Artes Gráficas; 2008. [ Links ]
13. Swami-Prabhupada B. El Bhagavad-Gita, Texto 17-9-14. India: Editorial Bhaktivedanta Booktrust; 1997. p 412-13. [ Links ]
14. Botella de Maglia J, Real-Soriano R, Compte-Torrero L. Saturación arterial de oxígeno durante la ascensión a una montaña de más de 8.000 metros. Med Intensiva. 2008;6:277-81 [ Links ]
15. Dempsey JA, Wagner PD. Exercise-induced arterial hypoxemia. J Appl Physiol. 1999;87:1997-2006. [ Links ]
16. Hackett P, Roach R. High Altitude Illness. N Eng J Med. 2001;345:107-113. [ Links ]
17. Grocott MPW, Martin DS, Levett DZH, McMorrow R, Windsor J, Montgomery HE. Arterial blood gases and oxygen content in climbers on mount Everest. N Eng J Med. 2009;360:180-9. [ Links ]
18. Sutton JR, Reeves JT, Wagner PD, Groves BM, Cymerman A, Malconian MK, et al. Operation Everest II: oxygen transport during exercise at extreme simulated altitude. J Appl Physiol. 1988;64:1309-21. [ Links ]
19. Wagner PD. Operación Everest II. Rev Am Med Resp. 2011;1:24-34. [ Links ]
20. Richalet JP, Robach P, Jarrot S, Schneider JC, Mason NP, Cauchy E, et al. Operation Everest III (COMEX 97) effects of prolongued and progressive hypoxia on humans during a simulated ascent to 8.848 mts in a hypobaric chamber. Adv Exp Med Biol. 1999;474:297-317. [ Links ]
21. West JB, Hackett PH, Maret KM, Milledge JS, Peters Jr RM, Pizzo Cj, Winslow RM. Pulmonary gas exchange on the summitof mount Everest. J Appl Physiol. 1983;55(3): 678-87. [ Links ]
22. Iwasaki K, Zhang R, Zuckerman J, Ogawa Y, Hansen L, Levine B. Impaired dynamic cerebral autoregulation at extreme high altitude even after acclimatization. J Cerebral Blood Flow Metab.2011;31:283-92. [ Links ]
23. Ainslie PN, Ogho S. Regulation of cerebral blood flow in mammals during chronic hypoxia: a matter of balance. Exp Physiol. 2010;95:251-62. [ Links ]
24. Bailey DM, Evans KA, James PE, McEnemy J, Young IS, Fall I, et al. Altered free radical metabolism in acute mountain sickness: implications for dynamic cerebral autoregulation and blood brain barrier function. J Physiol. 2009;587:73-85. [ Links ]
25. Iwasaki K, Shibata S, Aoki K. Acute exposure to normobaric mild hypoxia alters dynamics relationship between blood pressure and cerebral blood flow al very low frecuency. J Cerebral Blood FlowMetab. 2007;27:776-84. [ Links ]
26. Zhang R, Zuckerman JH, Iwasaki K, Wilson TE, Grandall CG, Levine BD. Autonomic neural control of dynamic cerebral autoregulation in humans. Circulation. 2002;106:1814-20. [ Links ]
27. Hinds CJ. Intensive Care-a concise textbook. London: Editorial Tyndall; 1987. [ Links ]
28. Hinojosa W. Significación clínica ácido base. La Paz-Bolivia: Fac. Medicina-UMSA; 2004. [ Links ]
29. Briceño I. Criterios diagnósticos de sepsis. Medicrit. 2005;2(8): 164-78. [ Links ]
30. Blanquer J, Solé-Violan J, Carvajal J, Lucena F. Infecciones comunitarias que requieren ingreso en UTI. Med Intensiva. 2010;6:388-96. [ Links ]
31. Gil L, GarciaL, Moya M, Artigas A, Borges M, Candel J, et al. Documento de Concenso (SEMES-SEMICYUC) Recomendaciones del manejo diagnóstico y terapéutico inicial y multidisciplinario de la sepsis grave en los Servicios de Urgencia Hospitalarios. Med Intensiva. 2007;7:388-99. [ Links ]
32. Rittisrsch D, Flierl MA, Ward PA. Harmful molecular mechanisms in sepsis. Nat Rev Immunol. 2008;8:776-87. [ Links ]
33. Dellinger RP. Inflammation and coagulation: implications for the septic patients. Clin Infect Dis. 2003;34:1259-65. [ Links ]
34. Lopez J. Breve introducción a la enfermedad de las alturas (High altiutde illness). Murcia: Hospital General Universitario de Murcia-Reina Sofía; 2005. [ Links ]
35. MacInnis MJ, Koehle MS, Rupert JL. Evidence for a genetic basis for altitude illness: 2010 update. High Alt Med Biol. 2010;11(4):349-368. [ Links ]
36. Antezana G, Leguía G, Morales A, Coudert J, Spielvogel H. Hemodynamic study of high altitude pulmonary edema (12.200 ft) In: Topìcs in evironmental physiology end medicine high altitude physiology and medicine. New York: Ed. W Brendel; 1982. Chapter 35:232-42. [ Links ]
37. Spielvogel H. Edema agudo pulmonar de altura. Rev Cuadernos. 2006;51(2):73-79. [ Links ]
38. Andrew M, McIntosh S, Grssom C, Auerbach P, Rodway G, Schoene R, et al. Wilderness medical Society Consensus Guidelines for the prevention and treatment of acute altitude illness wild. Environ Med. 2010;21:146-55. [ Links ]












