Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.37 Oruro 2015
ARTÍCULOS ORIGINALES
Lixiviación de criptomelano, en soluciones ácidas de sulfato ferroso
Cryptomelane lixiviation in acid solutions of ferrous sulfate
Lixiviação de criptomelano em soluções ácidas de sulfato ferroso
Fausto Alfredo Balderrama Flores
Ing. Metalúrgico, Magister en Ingeniería de los Recursos Naturales
Jefe de Laboratorio de Hidrometalurgia
Carrera de Ingeniería Metalúrgica y Ciencia de Materiales, Universidad Técnica de Oruro
faustoabf@gmail.com
Romer Lorgio Quispe Choque
Empresa Minera Huanuni
Resumen
Se ha estudiado el efecto de la razón mineral/agua, temperatura, concentración de sulfato ferroso y concentración de ácido sulfúrico, sobre la extracción de manganeso, en un mineral proveniente del sector de Uyuni, Provincia Quijarro, del Departamento de Potosí. El mineral estudiado presentó un contenido de 37.16% de Mn y el análisis mineralógico, por difracción de rayos X, indicó que está compuesto principalmente por criptomelano (KMn8O16) y cuarzo (SiO2).
El estudio realizado a nivel de laboratorio, indica que la solución de sulfato ferroso en medio ácido es un excelente agente lixiviante para este mineral. Para una concentración de sólidos de 100 gramos de mineral por kilogramo de agua, temperatura de 15 °C, tamaño de partícula del mineral de -48 +65 # Ty, concentración de sulfato ferroso 1.25 veces el estequiométrico, concentración de ácido sulfúrico 1.25 veces el estequiométrico, velocidad de agitación de 350 rpm y 2 horas de lixiviación, se consiguió una extracción de manganeso de 99.7%. Si se aumenta la temperatura de lixiviación a 45 °C y se disminuye el tamaño de grano a -65 # Ty sería posible disminuir el tiempo de lixiviación por lo menos a 1 hora. Temperaturas de lixiviación mayores a 45 °C perjudican el proceso, pues se origina un precipitado que arrastra manganeso disuelto y disminuye la extracción del mismo.
Palabras clave: Lixiviación, minerales de manganeso, criptomelano.
Abstract
It has been studied the effect of the rate mineral/water, temperature, concentration of ferrous sulfate and sulfuric acid concentration on the extraction of manganese, a mineral from the Uyuni zone in the department of Potosi. The mineral studied contains 37.16% of Mn, and mineralogical analysis by X-ray diffraction indicated that consists mainly of cryptomelane (KMn8O16) and quartz (Si02).
The study in the laboratory indicates that the solution of ferrous sulfate in an acidic medium is an excellent lixiviating agent for this mineral. With a solid concentration of 100 grams of mineral per kilogram of water, temperature of 15 °C, size of particles of -48 +65 #Ty, ferrous sulfate concentration of 1.25 times the stoichiometric concentration, concentration of sulfuric acid of 1.25 times the stoichiometric, agitation speed of 350 rpm and 2 hours of lixiviation, an extraction of 99.7% manganese was achieved. If the temperature of lixiviation is increased to 45 °C, and the size of the grain is decreased to -65 Ty, it's possible to decrease the lixiviation time at least 1 hour. Lixiviation temperatures above 45°C are detrimental to the process, because it's created a precipitate which contains dissolved manganese and reduces its extraction.
Keywords: Lixiviation, manganese minerals, cryptomelane.
Resumo
Tem sido estudado o efeito da razão mineral / água, temperatura, concentração de sulfato ferroso e concentração de ácido sulfúrico na extração de manganês, um mineral do setor de Uyuni, província Quijarro, departamento de Potosi. O mineral estudado apresentou um conteúdo de 37,16% de Mn, e a análise mineralógica por difração de raios-X indicou que consiste principalmente de criptomelano (KMn8O16) e quartzo (Si02).
O estudo em laboratório indica que a solução de sulfato ferroso em meio ácido é um excelente agente de lixiviação para este mineral. Para uma concentração de sólidos de 100 gramas de mineral por quilograma de água, temperatura de 15 °C, tamanho de partícula de mineral de -48 +65 #Ty, concentração de sulfato ferroso 1.25 vezes a concentração estequiométrica, concentração de ácido sulfúrico de 1.25 vezes a taxa estequiométrica, velocidade de agitação de 350 rpm e 2 horas de lixiviação, foi alcançada uma extração de manganês de 99.7%. Se a temperatura de lixiviação é aumentada até 45 ° C e o grão e diminuído até -65 #Ty, seria possível diminuir o tempo de lixiviação em pelo menos 1 hora. Temperaturas de lixiviação acima de 45 °C são prejudiciais para o processo, pois se cria um precipitado que arrasta o manganês dissolvido e diminui a sua extração.
Palavras chave: Lixiviação, minerais de manganês, criptomelano.
Introducción
El manganeso es un metal de transición, blanco grisáceo, parecido al hierro. Es el duodécimo elemento más abundante en la corteza terrestre y está ampliamente distribuido. Se encuentra en cientos de minerales, aunque sólo una docena tienen interés industrial.
Los minerales de manganeso más importantes son: pirolusita (MnO2), psilomelana (MnO2.H2O), manganita (MnO(OH)), braunita (3Mn2O3.MnSiO3), rodonita (MnSiO3), rodocrosita (MnCO3), hübnerita (MnWO4) y criptomelano (KMn8O16).
Bolivia cuenta con grandes yacimientos de minerales de manganeso tanto en el oriente como en el occidente del país [1,2]. Muchos de estos yacimientos son actualmente explotados por la minería chica y cooperativistas. Sin embargo, la comercialización y exportación de minerales de manganeso solo es factible, económicamente, para minerales con leyes mayores a 50% de Mn. Minerales con leyes menores no se comercializan debido a su precio bajo.
El análisis químico de una muestra de mineral de manganeso, obtenida de un yacimiento en la región de Uyuni, del departamento de Potosí, indica que tiene 37.16% de manganeso. El análisis mineralógico del mineral mencionado, indica que el manganeso se encuentra como criptomelano (KMn8O16), y la ganga como cuarzo (SiO2).
Entre las alternativas de explotación para este mineral están: la concentración de minerales, mediante la cual se podrían producir concentrados de alta ley, mayores a 50% de Mn, o la producción de compuestos con valor agregado, como el sulfato de manganeso, dióxido de manganeso electrolítico y/o la producción de manganeso electrolítico.
En el presente trabajo de investigación, se estudió, como una primera etapa en la producción de compuestos de manganeso con valor agregado, el efecto de las variables más importantes en la lixiviación de dicho mineral de manganeso en soluciones ácidas de sulfato ferroso.
Fundamento teórico
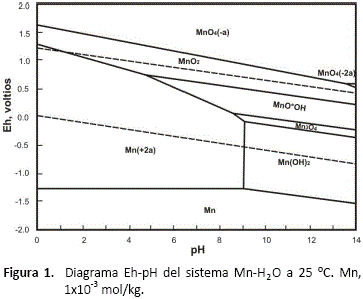
La figura 1, muestra el diagrama Eh-pH para el sistema manganeso-agua a una temperatura de 25 °C y 1x10-3 mol/kg de manganeso disuelto, construido con el software HSC Chemistry [3].
Un análisis de este diagrama indica que la disolución de óxidos de manganeso, donde la valencia del manganeso es 2+, solamente necesita de un medio ácido para su lixiviación. La lixiviación de óxidos de manganeso, donde la valencia del manganeso es 4+, necesita además de un medio ácido un ambiente reductor en la solución de lixiviación.
El criptomelano, KMn8O16, tiene una mezcla de Mn4+ y Mn2+ en su estructura cristalina de acuerdo a K(Mn4+,Mn2+)8O16. Un balance de cargas en el compuesto muestra que un 93.75 % del manganeso esta con valencia 4+ y solo un 6.25 % está con valencia 2+. Se concluye que para disolver el criptomelano se requiere ambiente ácido y reductor. En este ambiente el cuarzo, SiO2, permanece inerte.
En el presente trabajo de investigación se utilizó ácido sulfúrico (H2SO4), para proporcionar el medio ácido y sulfato ferroso (Fe2SO4), para proporcionar el ambiente reductor a la solución de lixiviación.
La lixiviación del criptomelano en medio ácido y reductor ocurre de acuerdo a la siguiente reacción global:
2KMn8O16 + 30FeSO4 + 32H2SO4= 16MnSO4+ K2SO4+15Fe2(SO4)3+ 32H2O (1)
Experimentación
El mineral estudiado proviene del sector de Uyuni, provincia Quijarro del departamento de Potosí. El análisis químico del mineral, realizado en el laboratorio de Spectrolab, se presenta en la tabla 1.
El análisis mineralógico, por difracción de rayos X, realizado en el Laboratorio de Microscopia y Metalurgia Física de la Carrera de Metalurgia y Ciencia de Materiales, indica que el mineral mayoritario es el criptomelano (KMn8O16), acompañado de cuarzo (SiO2).
Los reactivos utilizados fueron ácido sulfúrico de 98% de pureza y 1.84 g/ml de densidad, sulfato ferroso heptahidratado p.a. y agua destilada.
En la experimentación se estudió el efecto de una variable a la vez, manteniendo constantes el resto de las variables. Las variables estudiadas fueron: razón mineral/agua, temperatura, tamaño de partícula, concentración de ion Fe +, y concentración deH2SO4.
El procedimiento experimental utilizado fue el siguiente:
Se pesó la cantidad de mineral necesario (en la mayor parte de las pruebas 10 g de mineral). Se preparó la solución de sulfato ferroso y ácido sulfúrico en agua (en todas las pruebas 200 ml de agua) y se la colocó en un reactor de vidrio de 400 ml de capacidad.
Se calentó la solución a la temperatura requerida y se reguló el termostato para mantener esa temperatura durante todo el proceso de lixiviación. El equipo utilizado fue una plancha de calentamiento eléctrico de temperatura regulable provisto de un sistema de agitación magnético.
Se colocó la pastilla magnética y se inició la agitación. Se añadió la cantidad requerida de mineral. Se tomaron muestras líquidas a las 5, 10, 15, 20, 30, 60 y 120 minutos. Para ello, se detuvo la agitación, se dejó decantar la pulpa 1 minuto y se tomó 2 ml de muestra de la solución sobrenadante. La muestra se diluyó y aforó a 50 ml con agua acidulada de pH 1.
Una vez concluida la reacción, se filtró la pulpa, se lavó la misma y se la seco en horno secador a 40 °C. Se midió el volumen de solución de lixiviación.
Las muestras liquidas fueron analizadas por volumetría, con permanganato de potasio [4]. Las muestras sólidas fueron analizadas en el laboratorio de Spectrolab por Absorción Atómica.
Resultados
Efecto de la concentración de sólidos
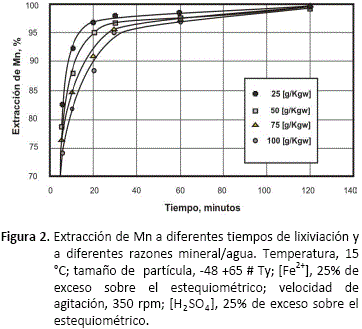
Los resultados del efecto de la concentración de sólidos sobre la extracción de manganeso se presentan en la figura 2. Se estudiaron concentraciones de 25, 50, 75 y 100 gramos de mineral por kilogramo de agua (g/kgw).
A medida que aumenta la concentración de sólidos en la pulpa, la velocidad de lixiviación disminuye. Este fenómeno es más notorio en los primeros 30 minutos de la lixiviación. Después de 1 hora de lixiviación el efecto es menor, y a partir de las dos horas de lixiviación, la extracción de manganeso es prácticamente la misma, 99.8% para todas las razones mineral/agua estudiadas.
Efecto de la temperatura
Los resultados del efecto de la temperatura sobre la extracción de manganeso se presentan en la figura 3. Se estudiaron temperaturas de lixiviación de 15, 30, 45, 60 y 75 °C.
A medida que aumenta la temperatura de la pulpa lixiviada, la velocidad de disolución es mayor. Esto es bastante notorio en los primeros 5 minutos de la lixiviación.
Sin embargo, después de este tiempo, la prueba a 75 °C se comportó de manera diferente. La extracción comenzó a disminuir, tal como se observa en la figura 3, siendo a las 2 horas menor la extracción en 8 % respecto de las pruebas a las otras temperaturas. A 75 °C el manganeso después de disolverse inicialmente, luego precipita. Durante esta prueba se observo un precipitado de color amarillo-café junto con el residuo sólido. Un análisis de rayos X de este residuo muestra que este contiene jarosita. Esta jarosita formada arrastra manganeso.
Las pruebas de lixiviación a temperaturas menores que 60 °C, todas prácticamente alcanzan la misma extracción de 99.7 a las 2 horas de lixiviación.
Efecto del tamaño de partícula
Los resultados del efecto del tamaño de partícula sobre la extracción de manganeso se presentan en la figura 4. Se estudiaron tamaños de partícula de -48 +65, -65 +100 y -100 # Ty.
A medida que el tamaño de partícula disminuye la velocidad de lixiviación aumenta. Esto es coherente debido a que a menor tamaño de partícula se tiene más área superficial por unidad de masa de mineral y por tanto la velocidad es mayor. Sin embargo a las dos horas de lixiviación la extracción es la misma para los tres tamaños de partícula estudiados, esto debido a que la reacción a este tiempo ha sido completa.
Efecto de la concentración de sulfato ferroso
Los resultados del efecto de la concentración de sulfato ferroso sobre la extracción de manganeso se presentan en la figura 5. Se estudiaron concentraciones de sulfato ferroso de 0, 25 y 50 % de exceso sobre el estequiométrico calculado a partir de la ecuación 1.
Se nota un pequeño incremento en la velocidad de lixiviación a medida que se aumenta mayor cantidad de sulfato ferroso. Sin embargo a partir de la primera hora y en particular a las 2 horas la extracción es prácticamente la misma, 99.6 %.
Efecto de la concentración de ácido sulfúrico
Los resultados del efecto de la concentración de ácido sulfúrico sobre la extracción de manganeso se presentan en la figura 6. Se estudiaron concentraciones de ácido sulfúrico con 0, 25 y 50% de exceso sobre el estequiométrico calculado a partir de la ecuación 1.
Se notan pequeñas variaciones en la velocidad de lixiviación a medida que se aumenta mayor cantidad de ácido sulfúrico. Sin embargo, de manera general, la concentración de ácido sulfúrico a partir de la concentración estequiometria no parece tener mayor influencia. A las 2 horas de lixiviación la extracción de manganeso es de 99.6% para las tres pruebas.
Efecto de la velocidad de agitación
Los resultados del efecto de la concentración de sólidos sobre la extracción de manganeso se presentan en la figura 7. Se estudiaron velocidades de agitación de 100, 200, 350 y 600 rpm.
Se observa de manera general, que a mayor velocidad de agitación la velocidad de lixiviación aumenta. Sin embargo se ve también que a partir de 350 rpm, una mayor velocidad de agitación ya no aumenta la velocidad de lixiviación del manganeso.
A partir de los 30 minutos las velocidades de agitación de 200, 350 y 600 rpm muestran los mismos resultados en la extracción de manganeso. A las 2 horas de lixiviación la extracción es prácticamente la misma en estos tres casos 99.8 %.
Conclusiones y recomendaciones
Los resultados de la investigación, han permitido establecer lo siguiente:
La muestra de mineral estudiado, tiene 37.16% de manganeso, y se encuentra en el mineral como criptomelano (KMn8O16). Su principal ganga es el cuarzo (SiO2).
Las extracciones altas conseguidas, muestran que la solución de sulfato ferroso en medio ácido es un agente lixiviante, excelente, para este mineral.
Se encontró que las condiciones de operación para una extracción de manganeso de 99.7% son: concentración de solidos de 100 gramos de mineral por kilogramo de agua, temperatura de 15 °C (ambiente), tamaño de grano del mineral de -48 +65# Ty, concentración de sulfato ferroso 1.25 veces el estequiométrico, concentración de ácido sulfúrico 1.25 veces el estequiométrico, velocidad de agitación de 350 rpm y 2 horas de lixiviación.
Sería posible disminuir el tiempo de lixiviación a, por lo menos, 1 hora si se aumenta la temperatura de lixiviación a 45 °C y se disminuye el tamaño de grano a -65 #Ty. Temperaturas mayores a 45 °C perjudican el proceso, pues precipita jarosita que arrastra manganeso disuelto.
Se recomienda estudiar la obtención de dióxido de manganeso electrolítico a partir de las soluciones de lixiviación. En teoría sería posible precipitar el dióxido de manganeso en el ánodo y reducir el ion férrico a ferroso en el cátodo, en una celda electrolítica de membrana, regenerándose de esta manera el agente lixiviante y obteniéndose dióxido de manganeso electrolítico, un producto con valor agregado.
Referencias
1. AHLFELD, F. Los yacimientos minerales y de hidrocarburos de Bolivia. Bolivia: Departamento Nacional de Geología, Ministerio de Minas y Petróleo, Boletín N °5 (especial), 1964. [ Links ]
2. RIVAS S., AHLFELD F. Los yacimientos de Bolivia y sus parajes. Santa Cruz de la Sierra - Bolivia: 1998. [ Links ]
3. Outokumpu Research Oy. Software HSC Chemistry versión 6.0. 2006. [ Links ]
4. MONTES J., HERNÁNDEZ A. Eqa-p025 procedimiento para determinar manganeso por volumetría. México: Servicio Geológico Mexicano, abril 2011. [ Links ]