Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.37 Oruro 2015
ARTÍCULOS ORIGINALES
Termodinámica de la fusión reductora de estaño
Thermodynamic of the reduction smelting process of tin concentrates
Termodinâmica da fusão redutora de estanho
Juan Eduardo Joffré Encinas
Master of Science in Metallurgical Engineering
Jefe del Área de Metalurgia y Materiales
Facultad de Ingeniería, Universidad Autónoma San Luis Potosí, México
joffreju@uaslp.mx
Resumen
Se presenta un análisis termodinámico de las reacciones más importantes en el proceso de fusión reductora de concentrados de estaño, mostrando la influencia que tiene el fierro en el proceso. La reducción de estaño está limitada por el equilibrio FeO - Fe y el desarrollo del proceso depende en gran medida de cómo desea el metalurgista hacerlo más efectivo.
La primera opción es haciendo una reducción benigna en la primera etapa de fusión, de tal manera que el estaño obtenido esté prácticamente libre de fierro y posteriormente hacer una reducción más intensa de la escoria líquida, para recuperar más unidades de estaño, a expensas de obtener estaño con mayor contenido de fierro (cabeza dura). Sobre esta cabeza dura líquida se agregan concentrados frescos para nuevamente producir estaño casi limpio de fierro, aprovechando así al contenido de Fe de la cabeza dura como reductor de los óxidos de estaño que ingresan al horno, continuando así el ciclo de operaciones. Pero en la etapa de recuperación de estaño de la escoria de primera fusión el consumo de carbón es excesivo porque también hay que reducir fierro de la escoria para lograr mayor recuperación de estaño en la fase metal.
La segunda opción es hacer una reducción benigna de estaño en la etapa de fusión, de tal manera que se produce estaño casi libre de fierro y escoria líquida con concentraciones apreciables de estaño, entre 4 y 8% Sn, que es sometida a volatilización de estaño para descartar escorias finales con concentraciones de estaño muy bajas, alrededor de 0.2% Sn y polvos de estaño de alta ley, libres de fierro que se peletizan fácilmente y regresan a fusión reductora junto con los concentrados frescos.
Se discuten los sistemas Sn - Fe, Sn - Fe - C, Sn - Fe - escoria, y finalmente se hacen algunos comentarios con referencia a los hornos que se utilizan para la fusión reductora de estaño, concluyendo que en la actualidad el horno Ausmelt es el más indicado para esto, tomando en cuenta su capacidad específica de fusión por volumen de baño, en base al consumo de oxígeno como comburente.
La volatilización de estaño puede ser sulfurante, añadiendo piritas a la escoria, o puede ser también neutra o medianamente oxidante, así volatiliza el Sn como SnO (g). La volatilización sulfurante es mucho más intensa y veloz que como SnO. Cuando se volatiliza como SnO, se debe incrementar también la temperatura de operación, para lograr escorias descartables.
Palabras clave: Termodinámica, estaño, fundición, cabeza dura, volatilización.
Abstract
A thermodynamic analysis of the most important reactions that occur in the reduction smelting process of tin concentrates is presented. It shows the influence of iron on the process. Tin reduction is limited by the equilibrium FeO -Fe and the process depends greatly on how the metallurgist proceeds to make it most effective.
The first option is to perform a benign reduction of tin in the first smelting step, so the tin produced is practically free of iron, and then perform a more intense reduction of tin from liquid slag, to increase its recovery at the cost of obtaining metal with more content of iron (hard head). This liquid hard head, which remains inside the furnace, receives fresh tin concentrates to produce again clean tin, taking advantage of the iron content of the hard head as a reducing agent of fresh tin oxides in concentrates, and continuing the operations cycle. However, the consumption of carbon is excessive during the slag reduction stage because it also reduces iron in order to recover more tin units.
The second option is to perform the same benign tin reduction in the stage of smelting, so the tin produced is practically free of iron, leaving from 4% to 8% Sn in slag. Then volatilize the tin from this liquid slag by either using sulfide or oxide fuming to discard a tin free slag with around 0.2% Sn. Then the SnO2 fumes free of iron can be easily pelletized and recycled to the smelting stage.
The systems Sn - Fe, Sn - Fe - C and Sn - Fe - slag are discussed and finally some comments are made with reference to furnaces used for tin reduction smelting, concluding that nowadays the Ausmelt furnace is the most capable operating unit for that purpose, taking into account its specific smelting capacity, based on the consumption of oxygen to support combustion.
Tin fuming can be sulfurizing, adding pyrites to the liquid slag or can be neutral or oxidizing, in this cases tin volatilizes as SnO(g). SnS fuming is much more intense and faster than SnO fuming. When fuming tin as oxide, temperature should be increases in order to attain discard slags.
Key words: Thermodynamics, tin, smelting, hard head, fuming.
Resumo
Apresenta-se uma análise termodinâmica das reações mais importantes no processo de fusão redutora de concentrados de estanho, mostrando a influência do ferro no processo. A redução de estanho é limitada pelo equilíbrio FeO-Fe e o desenvolvimento do processo depende em grande parte de como o metalúrgico deseja fazer-lhe mais eficaz.
A primeira opção é fazer uma reação benigna na primeira etapa de fusão, de modo que o estanho obtido esteja praticamente livre de ferro e, em seguida, fazer uma redução mais intensa da escória líquida para recuperar mais unidades de estanho, à custa da obtenção de estanho com maior conteúdo de ferro (cabeça dura). Na cabeça dura líquida são adicionados concentrados frescos para produzir novamente estanho quase limpo de ferro, aproveitando assim o conteúdo de ferro na cabeça dura como redutor dos óxidos de estanho que ingressa no forno, continuando assim o ciclo de operações. Mas na fase de recuperação de estanho da escória da primeira fusão, o consumo de carvão é excessivo, porque também tem que reduzir o ferro da escoria para uma maior recuperação de estanho na fase de metal.
A segunda opção é fazer uma redução ligeira de estanho na etapa de fusão, de modo que é produzido estanho quase livre de ferro e escória líquida om concentrações apreciáveis de estanho, entre 4% e 8% de Sn, o qual é submetido a volatilização de estanho para descartar escórias finais com concentrações de estanho muito baixas, cerca de 0,2% Sn e pós estanho de alta lei que são facilmente peletizados e voltam para a fusão redutora juntamente com os concentrados frescos.
Os sistemas Sn-Fe, Sn-Fe-C, Fe-Sn-escória são discutidos, e finalmente, alguns comentários são feitas com referência aos fornos utilizados para fusão redutora de estanho, concluindo-se que atualmente o forno Ausmelt é a melhor opção, tendo em conta a sua capacidade especifica de fusão por volume de banho, com base no consumo de oxigénio como comburente.
A volatilização do estanho pode ser sulfurante, adicionando pirites à escória ou também pode ser neutra ou medianamente oxidante, assim volatiliza o estanho como SnO. A volatilização sulfurante é muito mais intensa e mais rápida do que como SnO. Quando volatiliza como SnO, também se deve aumentar a temperatura da operação para alcançar escórias descartáveis.
Palavras chave: Termodinâmica, estanho, fusão, cabeça dura, volatilização.
Presentación
Los dos trabajos que aparecen en las referencias 19 y 20 en el libro Termodinámica Metalúrgica (Segunda edición ampliada, F.N.I., 1978), se presentaron en el Simposio Internacional del Estaño en Noviembre de 1977, organizado por el Ministerio de Minería y Metalurgia en La Paz, Bolivia; terminado el ciclo de conferencias, la mayoría de los participantes viajó a Oruro para visitar dos entidades metalúrgicas bolivianas, que en esa época gozaban de muy buen prestigio nacional e internacional: el Instituto de Investigaciones Minero Metalúrgicas y la Empresa Nacional de Fundiciones (ENAF) en Vinto, que por ese entonces tenía las instalaciones más modernas del mundo para procesar concentrados de estaño de alta y de baja ley, así como una novedosa fundición de antimonio.
El autor, habiendo tenido el privilegio de haber sido alumno del Dr. T. R. A. Davey (Australia) en Colorado School of Mines y habiendo conocido antes en Oruro al Ing. Peter Wright (Inglaterra), invitó a ambos a su casa en oportunidad de esa visita y ahí surgió la idea de publicar un condensado de los dos trabajos en el libro de Termodinámica Metalúrgica, que estaba siendo revisado para su segunda edición en la Facultad Nacional de Ingeniería.
Así fue como este trabajo aparece en las páginas 112 a 148 de la Segunda Edición FNI del libro en 1978.
Ahora, casi cuarenta años después, los editores de la Revista Metalúrgica, sugieren al autor publicar este trabajo en la revista y para esto se requiere una actualización. Haciendo la revisión del trabajo, se observa que efectivamente es necesaria una actualización, pero no en la termodinámica del proceso pirometalúrgico, sino mas bien en las interpretaciones que se le han dado tanto para explicar y comprender el proceso, como para desarrollar nuevos procesos en base, naturalmente, a esos mismos principios termodinámicos que no cambian. Cabe mencionar aquí que precisamente en esa época, alrededor de 1977, John Floyd estaba desarrollando en C.S.I.R.O. su proceso de combustión sumergida, precisamente con estaño, que posteriormente dio lugar a la tecnología AUSMELT.
Las referencias bibliográficas en este trabajo que aparecen por ejemplo así: Harris y Hallett22,23 [2], se refieren a su vez a que son las referencias 22 y 23 del trabajo de Davey que es la referencia 2 de este trabajo. De la misma manera, si aparecen así: ampliamente3,4,5 [1], son las referencias 3, 4 y 5 de la referencia 1 de este trabajo.
Introducción
El proceso clásico de la fundición de estaño consiste en una primera etapa de reducción en condiciones no muy reductoras, para obtener estaño casi exento de Fe (máximo 2% Fe) y una escoria rica en estaño que es sometida a condiciones más severas de reducción para producir una aleación Sn - Fe más o menos de composición monotéctica (alrededor de 80% Sn y 20% Fe) llamada cabeza dura, que recircula a la primera etapa, tal como ilustra el flujograma de la figura 1. Si la segunda escoria contiene todavía estaño en cantidades mayores al 2%, es sometida nuevamente a reducción para producir una aleación cuya composición aproximada es de 50% Sn y 50% Fe, que también recircula a la primera etapa, reduciendo aparentemente la capacidad de tratamiento de concentrados, pero también disminuyendo el consumo de carbón, pues el fierro de las cabezas duras actúa también como agente reductor del estaño de los concentrados frescos.
La alternativa para no recurrir a la formación de cabezas duras, es someter las escorias de la primera fusión reductora, a volatilización por sulfuración, descartando escorias finales cuyo contenido de estaño es alrededor de 0.2%.
La figura 2, ilustra en líneas muy generales el flujograma que seguía ENAF1 [1], para el tratamiento de concentrados de estaño de alta ley (>35%Sn); la mayor parte de recirculantes, (drosses, cenizas, lodos secos y polvos), eran reducidos en un horno separado, y la escoria de éste, se mezclaba con los concentrados frescos (o tostados) para su alimentación al reverbero. La gran ventaja de esta forma de operar es que en la volatilización de estaño se obtienen polvos de SnO2 de alta ley totalmente libres de Fe, los mismos que al ser alimentados a reducción en forma de pellets constituyen una excelente alimentación para cualquier horno de reducción.
La figura 3, muestra el flujograma que seguía ENAF para el tratamiento de concentrados de baja ley (<35%Sn)1 [1]. Los concentrados de baja ley eran previamente sometidos a volatilización en horno ciclón y los óxidos ricos eran reducidos en un horno eléctrico a estaño crudo y una escoria líquida que, luego de una volatilización con piritas, era descartada. Los polvos de estaño producidos en todo el circuito, libres de fierro, recirculaban a fusión previa peletización. La refinación térmica del estaño crudo incluía a la refinación al vacío.
Reducción del estaño
Los principales problemas de la fusión reductora de estaño son ocasionados por el fierro que forma parte de los concentrados. Los comportamientos de fierro y estaño durante la reducción de sus óxidos menores, son muy similares y una reducción completa de estaño a partir de las escorias, conduce a la reducción de una cantidad considerable de fierro.
Plomo, bismuto, arsénico, antimonio, cobre, plata son también perjudiciales durante la obtención pirometalúrgica de estaño, porque sus óxidos también se reducen en mayor o menor grado y el estaño crudo obtenido requiere de refinación posterior.
La obtención de estaño metálico crudo consiste básicamente en la reducción de la casiterita mediante carbón (CO). Las principales reacciones que ocurren durante el proceso son las siguientes:

O bien:
![]()
Que es la suma de las dos primeras reacciones.
El SnO(s) es estable sólo a temperaturas menores a 400 °C, y también ocurre la siguiente reacción de descomposición;
![]()
y SnO2 es nuevamente reducido por CO.
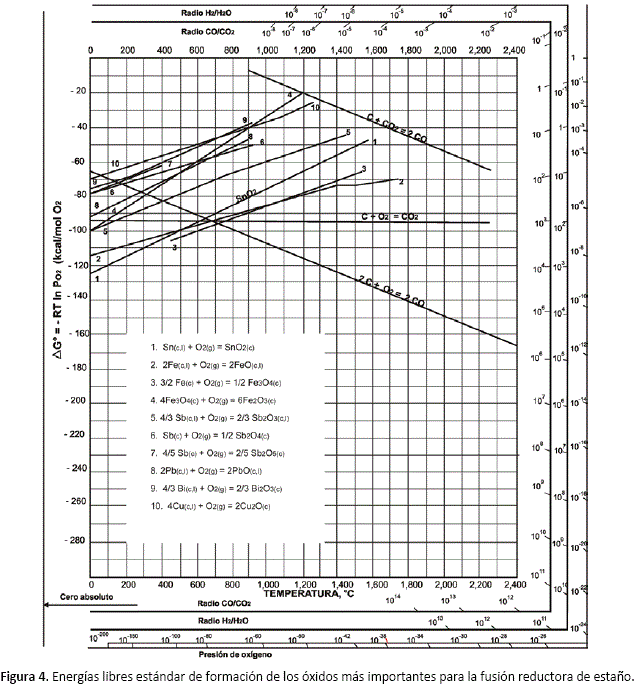
La figura 4, muestra las energías libres de formación de los óxidos de Sn, Fe, Pb, Cu, Bi y Sb en función de temperaturas, de las relaciones CO/CO2 y H2/H2O y de las presiones parciales de oxígeno a equilibrio (diagrama de Ellingham).
Los óxidos más estables entre todos ellos son precisamente los de fierro (FeO, Fe2O3) y el de estaño (SnO2). La energía libre de formación de As2O3(sj¡ no está en este gráfico, pero su línea es muy cercana a las de PbO y Sb2O3.
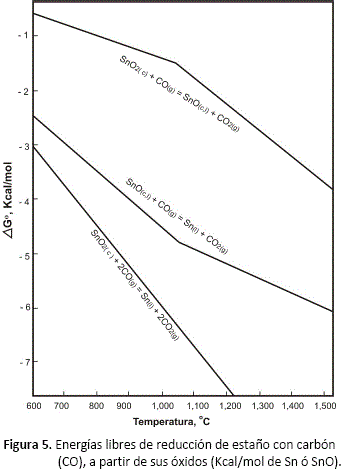
La figura 5 muestra las energías libres estándar para las reacciones (1), (2) y (3), en función de temperatura. Se observa que la reacción general (SnO2 - Sn) es favorecida intensamente por la temperatura.
Reducción de la casiterita
La reducción de SnO2 a partir del concentrado (previamente tostado por lo general) que se alimenta al horno, está expresada de la siguiente manera:
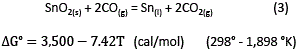
Como una primera aproximación, la actividad de SnO2 en el concentrado puede ser considerada igual a la unidad.
La curva para estaño en equilibrio con concentrado nuevo que ingresa al horno, se muestra en función de temperatura y log(CO2/CO) en la figura 6, donde también se han graficado los equilibrios de reacción de los óxidos de Fe, la reacción de Bouduard y los equilibrios de reducción de PbO, Bi2O3 y Cu2O.
Teóricamente el FeO no debería reducirse a Fe metálico en el horno de reducción de estaño y más bien ser disuelto en la escoria como FeO, pero ocurre que si las condiciones son muy reductoras en el horno para "garantizar una alta recuperación de estaño", se ocasiona también la reducción de algo de Fe que se disuelve en el estaño metálico, con el peligro de formar cabezas duras.
La reducción de estaño está entonces limitada por el equilibrio FeO - Fe y la zona de operación en el horno está limitada a la zona achurada del diagrama de la figura 6.
En la práctica la operación se efectúa por lo general a temperaturas entre 1,150° y 1,300 °C - temperaturas de fusión de las escorias - que corresponden entonces a razones CO2/CO a equilibrio, dentro de los siguientes límites:

Tampoco podrían emplearse mayores temperaturas para los mismos valores de CO2/CO, porque se corre el riesgo de volatilizar Sn como SnO(g). De todas maneras esto ocurre en mayor o menor grado, de acuerdo al control que se ejerce sobre la operación en los hornos, y los polvos de estaño recirculan.
La presencia de Pb, Bi, Cu, As y Sb en la alimentación al horno de reducción, es perjudicial porque los óxidos de estos elementos se reducen a temperaturas relativamente bajas y a razones CO2/CO bastante altas, es decir, a bajas concentraciones de CO en el ambiente del horno. Estos metales se disuelven en el estaño líquido (Pb, Bi, Cu, As, Sb) o forman compuestos complejos con estaño (As, Sb) produciendo el llamado speiss.
Reducción del óxido de estaño en la escoria
El SnO formado por la reducción parcial de SnO2, o el Sn metálico que por reversibilidad de la reacción (2) pasa nuevamente a SnO, puede disolverse en la escoria. Del mismo modo el FeO de la escoria puede también ser reducido a Fe metálico, pasando a disolverse en el estaño.
Por lo general el contenido de estaño en la escoria de la primera reducción oscila entre 8 y 12% y el contenido de Fe en el metal oscila entre 2 y 6%. Las reacciones de intercambio escoria - metal para Sn y Fe están representadas por las ecuaciones (4) y (5):
![]()
![]()
De modo que las actividades de SnO(l) y FeO(l) ya no pueden ser consideradas iguales a la unidad.
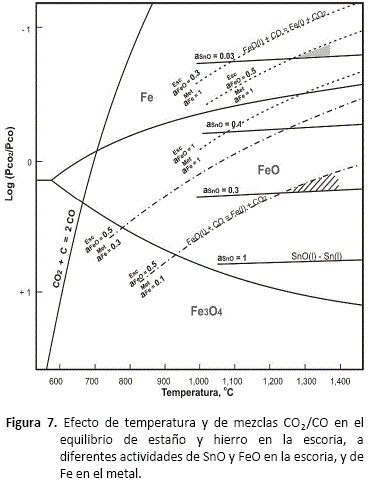
Asumiendo condiciones bajo las cuales las actividades de Sn y de Fe pueden tomarse como unitarias, la relación entre log(CO2/CO) y temperatura para estas reacciones está ilustrada en la figura 7.
Disminuyendo entonces las actividades de FeO y SnO en la escoria, será posible efectuar la reducción de estaño bajo concentraciones más elevadas de CO(g) sin tener que reducir el FeO a Fe metálico. Analizando estas líneas puede estimarse la posibilidad de reducir SnO de la escoria; por ejemplo, cuando la actividad de FeO en la escoria sea 0.5, SnO podrá ser reducido hasta que su actividad llegue a 0.03, correspondiente a la intersección de las líneas de aSnO= 0.03 y aFeO = 0.5 a 1,250 °C. Mayor reducción de SnO conduce a una reducción de FeO. Si se eleva la temperatura, deberán elevarse también las condiciones reductoras.
Pero la actividad de Fe en el metal no puede asumirse igual a la unidad, porque se trata de una aleación líquida Sn - Fe y surge el problema principal. En vista de que en la primera fusión reductora, el estaño crudo que se obtiene es de una pureza mayor al 95%, su actividad en el metal puede asumirse igual a la unidad sin incurrir en errores de consideración. En cambio el contenido de Fe en el metal crudo es aproximadamente 4% y puede asumirse que su actividad sea alrededor de 0.1.
La figura 7, muestra también el desplazamiento de las líneas de equilibrio FeO(l) - Fe(l) cuando la actividad de Fe en Sn líquido es menor a la unidad. Puede observarse entonces que esta disminución de la actividad del Fe metálico (por muy pequeña que sea la cantidad de Fe reducido y disuelto en el estaño), restringe las condiciones de reducción de estaño. Así por ejemplo a 1,250 °C, cuando la actividad de FeO en la escoria es 0.5 (aFeO = 0.5) y la del fierro en el metal es 0.1 (aFe = 0.1), el SnO podrá reducirse de la escoria, solamente hasta que su actividad alcance a 0.3. Si ha de reducirse más SnO, deberán variarse las condiciones de reducción y la temperatura, pero para el ejemplo dado, las condiciones de variación están restringidas a la pequeña zona sombreada en la figura 7.
El panorama se complica aún más y las condiciones de operación son más restringidas, cuando la actividad de estaño en el metal ya no puede ser considerada igual a la unidad. Tal el caso de la producción de cabezas duras.
Por estas razones, cuando se reducen las escorias de la primera fusión en condiciones más reductoras (figura 1), inevitablemente se reduce el Fe junto al Sn formando cabezas duras de composición monotéctica, según el diagrama de fases Sn - Fe (figura 8), y el diagrama ternario Sn - Fe - O de la figura 10, que se discute más adelante.
De modo que una completa reducción de estaño en la primera etapa, trae consigo inevitablemente una considerable proporción de Fe. Por eso, para producir estaño crudo con la menor cantidad posible de Fe, las condiciones de reducción deben ser comparativamente benignas y el contenido de estaño en la escoria será relativamente grande (6 a 12% Sn).
Entonces puede considerarse que la distribución de estaño y fierro entre las fases escoria y metal a equilibrio, está gobernada por la reacción (6) que es la diferencia de las reacciones (4) y (5):
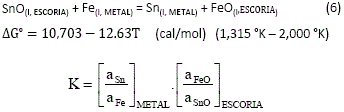
Sustituyendo ![]()
![]()
Y como3 [1]:
![]()
y
![]()
Reemplazando en (7);

Se ha discutido ampliamente3,4,5 [1], la relación que existe entre ![]() en las escorias de estaño, llegándose a determinar que
en las escorias de estaño, llegándose a determinar que ![]() no es una relación constante como se suponía, sino que más bien varía presumiblemente alrededor de 1.
no es una relación constante como se suponía, sino que más bien varía presumiblemente alrededor de 1.
CarbóNóver y Richardson6 [1], determinaron que las actividades de SnO(l) en escorias de SiO2, saturadas con Al2O3, a temperaturas entre 1,000° y 1,250 °C, son muy próximas a las fracciones molares de SnO(l) en ellas, es decir, su comportamiento es muy próximo al ideal dentro de los límites del error experimental.
Haciendo:

y llamando k a la constante de distribución de Sn y Fe entre escoria y metal3 [1]:
![]()
Davey y Floyd3 [1] y Harris y Hallett4 [1], han coincidido en demostrar experimentalmente que cuando se produce estaño casi puro, k ![]() 300 (primera fusión reductora) y cuando se producen cabezas duras de composición monotéctica en la zona de inmiscibilidad (
300 (primera fusión reductora) y cuando se producen cabezas duras de composición monotéctica en la zona de inmiscibilidad (![]() 20% Fe), k
20% Fe), k ![]() 200.
200.
La relación (8) puede escribirse como:
![]()
donde ![]() es la relación de coeficientes de actividad en el sistema Sn - Fe.
es la relación de coeficientes de actividad en el sistema Sn - Fe.
El estudio de estas aleaciones es de mucho interés en la metalurgia extractiva del estaño, principalmente en la recuperación de estaño a partir de minerales ferruginosos y de cabezas duras y para remoción de Fe en la refinación.
La literatura especializada da cuenta de varios estudios sobre el diagrama de fases Sn - Fe10,11,12,13,14,15,16 [1]. Hultgren, et. al.17 [1] publicó en 1968 datos de este diagrama, que a la fecha son los más exactos, figura 8.
La característica principal de este sistema es la zona de inmiscibilidad entre XSn=0.31 y XSn=0.6 (![]() 50%Sn y 80%Sn respectivamente). Esta zona ha sido motivo de intensas discusiones en el pasado, principalmente en lo que respecta a la formación de cabezas duras durante la segunda y la eventual tercera reducción de escorias en el flujograma clásico (figura 1). Davey y Floyd3 [1] efectuaron uno de los primeros análisis termodinámicos del equilibrio escoria - metal en la fundición de estaño. Davey16 [1] hizo estimaciones de las solubilidades de Sn y Fe en base a varios modelos termodinámicos; Kozukaet. al. experimentaron con cabezas duras y con el sistema Sn - O - Fe, sus resultados concuerdan con los cálculos efectuados por Davey16 [1].
50%Sn y 80%Sn respectivamente). Esta zona ha sido motivo de intensas discusiones en el pasado, principalmente en lo que respecta a la formación de cabezas duras durante la segunda y la eventual tercera reducción de escorias en el flujograma clásico (figura 1). Davey y Floyd3 [1] efectuaron uno de los primeros análisis termodinámicos del equilibrio escoria - metal en la fundición de estaño. Davey16 [1] hizo estimaciones de las solubilidades de Sn y Fe en base a varios modelos termodinámicos; Kozukaet. al. experimentaron con cabezas duras y con el sistema Sn - O - Fe, sus resultados concuerdan con los cálculos efectuados por Davey16 [1].
Shirahishi y Bell8 [1], también hicieron un estudio termodinámico de la fundición de estaño, con énfasis en el sistema Sn - Fe.
Habiéndose efectuado un análisis cuidadoso de estos trabajos; para el análisis teórico de la constante de distribución k, pueden tomarse los valores experimentales de Kozuka et. al.9 [1] a temperaturas alrededor de 1,401 °K (1,128 °C):
![]()
La influencia de la variación de temperatura en las constantes de estas ecuaciones es probablemente muy pequeña, puesto que a 1,630 °C, en el punto de cierre de la zona de inmiscibilidad, el coeficiente de ![]() es aproximadamente4 [1] igual a 0.9.
es aproximadamente4 [1] igual a 0.9.
Aplicando logaritmos a la ecuación (9), reemplazando estos valores en ella y ordenando se tiene:
![]()
Con referencia a log K en la ecuación (10), los investigadores3,4,5 [1], coinciden en que los valores de las energías libres de formación de SnO(l) y de FeO(l), tal como presenta la literatura18,19 [1], son evidentemente bajos en valor absoluto, existiendo una diferencia de 1 a 2 kilocalorías con los valores obtenidos por cálculos a partir de determinaciones experimentales de k. De modo que si se reemplazan los valores de log K, calculados según (6), en la relación (10), se llegan a obtener resultados sumamente bajos para k, que están en total contradicción con los resultados reales, obtenidos en la práctica experimental e industrial.
Davey3 [1], efectuó un cálculo de la energía libre para la reacción (6) a 1,423 °K (1,150 °C), considerando un término de corrección entre Fe0.947O y FeO y la entalpía de fusión de SnO igual a 7,000 cal/mol, obteniendo ![]() = -8,800 cal/mol, frente a
= -8,800 cal/mol, frente a ![]() = -7,270 cal/mol según el cálculo con la expresión de energía libre para (6).
= -7,270 cal/mol según el cálculo con la expresión de energía libre para (6).
El valor de ![]() que implica los resultados obtenidos por Harris y Hallett4 [1], asumiendo que
que implica los resultados obtenidos por Harris y Hallett4 [1], asumiendo que ![]() es constante e gual a la unidad, es -13,200 cal/mol. Pero como se ha establecido que
es constante e gual a la unidad, es -13,200 cal/mol. Pero como se ha establecido que ![]() no es constante, es aconsejable tomar el valor de -8,800 cal/mol para la energía libre estándar de la reacción (6) a 1,423 °K.
no es constante, es aconsejable tomar el valor de -8,800 cal/mol para la energía libre estándar de la reacción (6) a 1,423 °K.
Respecto a log E en (10), puede asumirse que![]() es igual a la unidad a temperaturas entre 1,000° y 1,250 °C6, por tanto
es igual a la unidad a temperaturas entre 1,000° y 1,250 °C6, por tanto ![]() deberá ser principalmente el factor variable en las escorias de estaño. En este trabajo no se analizan las influencias de los otros componentes de las escorias: SiO2, CaO, Al2O3, etc. porque la literatura especializada3,4,5,20,21,22 [1] contiene suficiente material al respecto.
deberá ser principalmente el factor variable en las escorias de estaño. En este trabajo no se analizan las influencias de los otros componentes de las escorias: SiO2, CaO, Al2O3, etc. porque la literatura especializada3,4,5,20,21,22 [1] contiene suficiente material al respecto.
Con todas las observaciones anotadas, puede calcularse la constante de distribución k, utilizando la relación (10) a 1,423 °K:
![]()
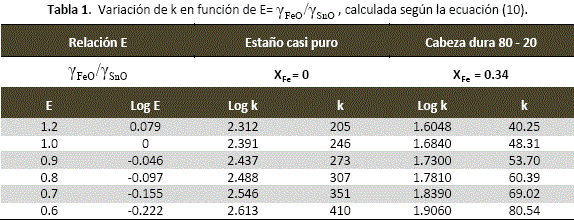
La tabla 1 y la figura 9, muestran la variación de k en función de valores asignados a E, para la reducción de estaño "limpio" (XFe = 0) y para la formación de cabezas duras de composición monotéctica (XFe = 0.34).
Como k ![]() 300 para XFe= 0 y k
300 para XFe= 0 y k ![]() 50 para XFe= 0.34, en la figura 9 pueden extrapolarse los valores correspondientes de E y así calcular
50 para XFe= 0.34, en la figura 9 pueden extrapolarse los valores correspondientes de E y así calcular ![]() en las escorias respectivas:
en las escorias respectivas:
Para estaño casi puro, XFe= 0 y k ![]() 300, E =
300, E = ![]() = 0.82, entonces
= 0.82, entonces ![]() = 0.82.
= 0.82.
Para cabezas duras de composición monotéctica, XFe= 0.34 y k ![]() 50, E =
50, E = ![]() = 0.97, entonces
= 0.97, entonces ![]() = 0.97. Puede observarse entonces que
= 0.97. Puede observarse entonces que ![]() varía poco con la composición en la escoria y que además el comportamiento del FeO en ella es también próximo al ideal (
varía poco con la composición en la escoria y que además el comportamiento del FeO en ella es también próximo al ideal (![]() = 1). Los valores de
= 1). Los valores de ![]() obtenidos de la figura 9, muestran que las pequeñas desviaciones de las actividades de FeO son negativas, tal como se espera del comportamiento del fierro en las escorias.
obtenidos de la figura 9, muestran que las pequeñas desviaciones de las actividades de FeO son negativas, tal como se espera del comportamiento del fierro en las escorias.
Finalmente para ![]()
![]() 1, a temperaturas entre 1,150° y 1,250 °C, las actividades de FeO en las escorias de estaño pueden aproximarse según:
1, a temperaturas entre 1,150° y 1,250 °C, las actividades de FeO en las escorias de estaño pueden aproximarse según:
![]()
Donde k ![]() 300 para estaño metálico libre de Fe y k
300 para estaño metálico libre de Fe y k ![]() 50 para cabeza dura de composición monotéctica.
50 para cabeza dura de composición monotéctica.
En la práctica a veces no se llega a equilibrio debido a factores cinéticos, de ahí que los valores reales de k están en muchos casos alejados de los teóricos, como se verá más adelante, pero el conocimiento de estos valores teóricos es muy importante para determinar las limitaciones del proceso.
Sistema estaño - fierro - escoria
Desafortunadamente los sistemas Sn - Fe y Sn - Fe - escoria son muy difíciles de investigar experimentalmente por una variedad de razones, y la literatura inclusive ahora aún contiene una masa confusa de datos conflictivos, ninguno de los cuales está relacionado a valores correctos de equilibrio.
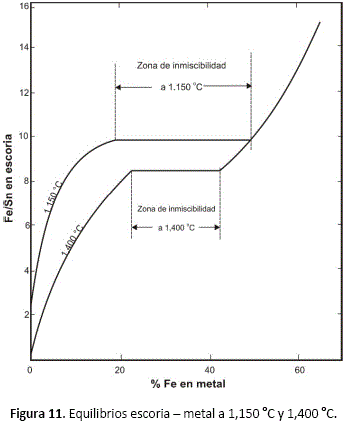
La figura 10, muestra el diagrama de fases Fe - Sn - O a 1,150 °C, asumiendo que están presentes suficientes cantidades de SiO2 y de CaO para escorificar la mezcla FeO - SnO y dar escorias líquidas no viscosas a 1,150 °C. Existen cinco áreas entre las líneas metal y escoria, las que se discuten a continuación:
1. Una región de dos líquidos a la derecha, en la que una solución de fierro en estaño está en equilibrio con una escoria estaño - fierro, relativamente rica en estaño. En esta área se realiza la primera etapa de reducción de estaño y a cuya frontera izquierda pueden efectuarse las reducciones de segunda etapa. Se muestran solamente unas cuantas líneas de enlace (o conodas): las de 0.5%, 1%, 5% y 10% Fe en estaño metálico. Esta región del diagrama es muy comprimida para mostrar adecuadamente los datos de equilibrio para propósitos prácticos y la figura 11, muestra los mismos datos en una forma más adecuada para utilizar.
2. Región de tres líquidos; dos metales líquidos más la escoria. Especialmente debe notarse que ambas fases metálicas (a ambos lados de la zona binaria de inmiscibilidad) con 18.25% Fe y 50.9% Fe, respectivamente; están en equilibrio con la misma escoria, cuya razón Fe/Sn es 9.7. Aunque debería ser obvio, la mayoría de las publicaciones que se proponen relacionar las condiciones de equilibrio, muestran o implican que los metales a cada lado de la zona de inmiscibilidad están en equilibrio con escorias de diferente composición, lo que no es correcto.
3. Otra región de dos líquidos, donde una solución de estaño en fierro líquido está en equilibrio con una escoria de bajo contenido de estaño.
4. Una región de tres fases, donde Fe líquido (que contiene cerca de 46% Sn disuelto) y una solución sólida de estaño en fierro (con cerca de 16% Sn), está en equilibrio con escoria líquida.
5. Una región de dos fases donde una solución sólida de estaño en fierro está en equilibrio con escoria líquida.
La región 3 es muy restringida a 1,150 °C para ser de mayor uso en la reducción de estaño, pero a mayores temperaturas se extiende mucho más hacia la izquierda y puede ser usada para una segunda etapa de reducción (a 1,400 °C, por ejemplo), para reducir el contenido de estaño de las escorias a un nivel muy bajo, bastante menor que 1% Sn si se desea.
Las líneas de enlace y fronteras de fases en la figura 10 fueron calculadas de los datos de las figuras 8 y 11.
La figura 11 está basada mayormente en el trabajo de Harris y Hallett22,23 [2] pero es objeto de cierta incertidumbre porque sus experimentos muestran una variación en las razones Fe/Sn de escorias supuestamente en equilibrio con composiciones de metal dentro de la zona de inmiscibilidad. Como se hizo notar previamente24 [2], la composición de la escoria no puede alterar su razón Fe/Sn a medida que la composición de la fase metálica atraviesa la zona líquida de inmiscibilidad, si se alcanza realmente el equilibrio.
Floyd25[2], ha demostrado que la rápida pérdida de SnO de la escoria por volatilización, más el lento equilibrio de las fases escoria y metal por el paso del estaño del metal a la escoria22 [2], hace muy difícil la determinación de equilibrios reales.
Aunque reconocieron este problema, Harris y Hallett22 [2], no tuvieron éxito al producir resultados experimentales que muestren un valor constante de la razón Fe/Sn de las escorias a través de la zona de inmiscibilidad. Las figuras 10 y 11 son consistentes termodinámicamente, pero no puede asegurarse de ellas una alta exactitud.
Al usar datos de actividad para el sistema binario Fe - Sn producidos por Davey, et. al.1 [2], se observa entre escorias ricas en estaño y escorias con muy poco estaño una variación en la razón ![]() en las escorias de por lo menos 1.5. Davey y Floyd13 [2] asumieron originalmente que esta razón era constante e igual a 1 en toda esta región, lo mismo asumieron Harris y Hallett22 [2], pero la variación asumida por Davey et. al.1 [2], ciertamente ocurre, aunque la magnitud exacta es incierta.
en las escorias de por lo menos 1.5. Davey y Floyd13 [2] asumieron originalmente que esta razón era constante e igual a 1 en toda esta región, lo mismo asumieron Harris y Hallett22 [2], pero la variación asumida por Davey et. al.1 [2], ciertamente ocurre, aunque la magnitud exacta es incierta.
Los datos de la figura 11, pueden ser presentados en una forma alternativa como se muestran en la figura 12, donde el log k está graficado contra el contenido de fierro en el metal. La distribución de fierro y estaño entre las fases líquidas metal y escoria está representada por k:
![]()
Para comparación, las estimaciones de Wright17 [2] para k, también se muestran en la figura 12.
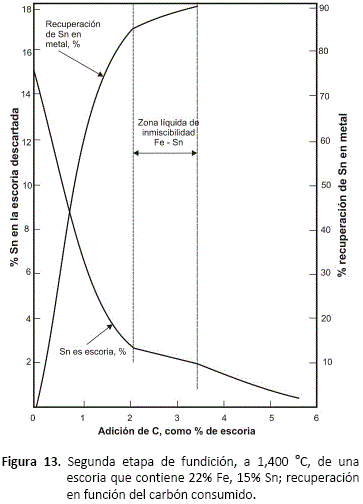
La figura 13 también está basada en la figura 11, muestra los resultados de la segunda etapa de reducción de escorias en función del grado de reducción alcanzado. Tanto la recuperación de estaño como metal (cabeza dura) y el contenido residual de estaño en la escoria, han sido graficados frente al carbón reductor usado. Se ha asumido que la escoria inicial contiene 22% Fe, 15% Sn, 13% CaO, pero los resultados no serían muy diferentes si se habría escogido otra composición de escoria. Se ha asumido que el carbón reacciona a CO, pero si se forma una mezcla de CO y CO2, el efecto es solamente el de alterar algo la escala horizontal.
El hecho de que algo de estaño es removido en la práctica por la volatilización de SnO ha sido ignorado; el efecto de esta volatilización es incrementar (aparentemente), la recuperación de estaño y reducir el contenido final de la escoria para un consumo dado de carbón.
La figura 13 muestra claramente que, cuando el metal producido llega a la composición de la zona de inmiscibilidad, se requiere una cantidad desproporcionalmente grande de carbón para recuperar estaño adicional de la escoria. Este carbón se consume principalmente reduciendo fierro de la escoria, para incrementar la razón fierro/estaño en la cabeza dura o fase metálica, y muy poco estaño se reduce hasta que se llega al lado más alejado de la zona de inmiscibilidad.
La figura 14, muestra esto más gráficamente, donde la cantidad de carbón requerido para producir un 1% adicional en la recuperación de estaño de la escoria, está graficada en función de la composición de la fase metal. Se muestra con mucha claridad este incremento en el requerimiento de carbón para cruzar la zona líquida de inmiscibilidad en el sistema fierro -estaño, e inclusive antes de que fueran establecidos los límites de la zona líquida de inmiscibilidad, la práctica de muchas fundiciones fue la de conducir la segunda etapa de reducción de tal manera que se produzca una cabeza dura de composición que se aproxime al lado rico en estaño de la zona de inmiscibilidad. Evidentemente la prueba y el error han demostrado que solamente cantidades mínimas de estaño eran recuperadas, inclusive si se realizaba una reducción mucho mayor de la escoria. Estas consideraciones condujeron a Davey13 [2] en 1966 a la conclusión de que Hansen19 [2], estaba en error al colocar la frontera de inmiscibilidad a cerca de 12% Fe, en lugar de haberlo hecho a entre 18% y 20% Fe. Tantas fundiciones de estaño producían cabezas duras de esta composición, que esto podía ser sólo debido a que el límite de inmiscibilidad estaba cerca a esa posición.
Hornos para fusión reductora y volatilización de estaño y consideraciones de operación
Los hornos que más se usaban para la reducción de estaño eran los de reverbero y los rotatorios de tambor corto. Probablemente el último reverbero que se construyó para fundir concentrados de estaño en el mundo fue el de ENAF, Bolivia, aproximadamente en 1968. En Capper Pass, Inglaterra se usaba un horno de soplo y en Berzelius, Alemania así como en Metales Potosí, México se usaban hornos eléctricos en la época de los años 1960 hasta 1995 aproximadamente.
Las características más importantes de estas tres plantas de estaño eran que, además de concentrados de estaño, trataban grandes cantidades de materiales de reciclaje.
La ganga de los minerales y concentrados tiene muy poca influencia en el coeficiente de distribución k y la fluidez de la escoria es un factor preponderante para llegar a equilibrio entre las fases escoria y metal, puesto que la difusión de SnO de la interfase metal/escoria hacia la escoria, es el factor que controla la velocidad del proceso3,4 [1]. Para alcanzar equilibrio entre las fases metal y escoria se requiere agitación y el horno de reverbero, por su carácter estático, no permite llegar a equilibrio entre las fases metal y escoria, en cambio en un horno rotatorio se logra rápidamente el equilibrio entre las fases.
La única ventaja que se le puede reconocer a un horno de reverbero es que requería poca o ninguna preparación de la carga, puesto que podían cargarse materiales finos, aunque el reciclaje de polvos era mayor.
Entre sus desventajas se cuenta su baja eficiencia energética, grandes cantidades de calor salen con los grandes volúmenes de gases del proceso, obligando a emplear grandes cantidades de combustible, cualquiera que fuera éste; el calentamiento de la carga a través de una capa de escoria aislante y estática es un método muy ineficiente de transferencia de calor y de masa. Dos etapas de reducción en un reverbero podían lograrse solo mediante sangría, solidificación y refusión de la escoria después de la primera etapa de fusión reductora. Esto no es un problema serio cuando la proporción de escoria producida (de concentrados de alta ley) es relativamente baja, pero se vuelve un impedimento insuperable al fundir concentrados de baja ley, por la elevada producción de escorias, cuyas cantidades son mucho mayores al estaño producido.
En un horno rotatorio de tambor corto hay muy poco o no hay gradiente de temperatura entre la superficie y el fondo de la carga, de tal modo que por lo general no se forman acreciones en la solera del horno y la parte superior de la carga tampoco se sobrecalienta. Sus desventajas son: incremento del consumo de refractarios por erosión y corrosión, incremento de la volatilización de estaño, incremento de pérdidas de finos de la carga, dificultad de alcanzar las elevadas temperaturas necesarias para la fusión de escorias y para alcanzar las grandes capacidades de producción de una planta, se requiere la construcción de varios hornos rotatorios, lo que incrementa los costos de inversión y de mantenimiento.
Cuando se escribía este trabajo en 1977, J. M. Floyd desarrollaba en C.S.I.R.O., Australia su proceso de combustión sumergida, que después se convirtió en la tecnología AUSMELT, que actualmente es considerada la más efectiva, simple y eficiente a nivel mundial para la fusión de innumerables materiales (minerales, concentrados, materiales de reciclaje, etc.). Esta tecnología, está clasificada como uno de los procesos de fusión en baño. En la fusión en baño, el concentrado está sumergido y reacciona en un baño líquido turbulento de mata o metal, escoria y gas. En los procesos de fusión en baño el gas se inyecta por debajo de la superficie del baño, por medio de lanzas sumergidas (Ausmelt), suspendidas (Mitsubishi), o toberas (Vanyukov, Noranda), causando gran turbulencia en el sistema, haciendo así más intensivo al proceso, incrementando la transferencia de energía y de masa en el baño.
Kellogg y Díaz [3], en 1992 presentaron un excelente trabajo comparativo de los procesos de fusión en baño y desde entonces, quienes se dedican al diseño de procesos pirometalúrgicos, utilizan un distinto parámetro técnico de comparación para procesos de fusión, sea éste en baño o en suspensión (Flash o relámpago, como los procesos Outokumpu, Kivcet, Contop).Este parámetro de comparación de tecnologías es la velocidad a la cual el proceso consume oxígeno. El consumo de oxígeno del aire, de aire enriquecido con oxígeno, o de oxígeno industrial puro (> 95% O2), está directamente relacionado con la velocidad de fusión de materiales en general. Utilizando la velocidad de consumo de oxígeno como medida de la velocidad de fusión, se garantiza que la medición resultante sea independiente de la tarea específica de fusión, es decir no importa si se funde material de baja ley o de alta ley, óxidos o sulfuros, o qué material se esté fundiendo. Tampoco importa mucho qué tipo de combustible se esté usando, sea éste líquido, o gas, o sólido (carbón, los propios sulfuros, etc.); todo combustible para dar calor necesita oxígeno.
No todo el oxígeno que se inyecta en un horno se consume eficazmente. Esa porción que sale del horno como oxígeno libre no contribuye a las reacciones de fusión y no debe contabilizarse para la medición de la intensidad de fusión. La medida del oxígeno total que se consume, expresada como porciento del que se introduce al horno, es la "eficiencia de uso de oxígeno", EUO, y se estima que la incertidumbre en estas mediciones puede variar en ± 5%. Los procesos de fusión en baño son capaces de una utilización muy eficiente de oxígeno.
La capacidad de consumo de oxígeno se convierte en una medida más significativa de la intensidad de fusión, si la relacionamos con el volumen del baño para los procesos de fusión en baño (lanzas, toberas); o con el volumen del reactor de fusión para los procesos de fusión en suspensión (flash, ciclón), de la siguiente manera:
Capacidad Específica de Fusión por Volumen de Baño, CEFVB:
CEFVB = Nm3 O2 usado/h/m3 de volumen de baño.
Capacidad Específica de Fusión por Volumen de Reactor en Suspensión, CEFVR:
CEFVR = Nm3 O2 usado/h/m3 de volumen de reactor.
Bajo estas consideraciones y según la intensidad de fusión, los diferentes procesos que actualmente compiten en el mercado de tecnologías, están agrupados como:
De baja intensidad, CEFVB o CEFVR < 100.
De intensidad intermedia, CEFVB o CEFVR entre 100 y 200.
De alta intensidad, CEFVB o CEFVR > 250.
La capacidad específica de fusión por volumen de baño del proceso Ausmelt es la más alta para este tipo de procesos, oscila entre 400 y 500 Nm3 O2 usado/h/m3 de volumen de baño, tomando en cuenta una EUO igual o mayor a 95%.
Esta información es muy útil para el dimensionamiento de un horno para determinada capacidad de tratamiento de determinado material, por ejemplo si se desea construir un horno tipo Ausmelt para producir 35,000 toneladas anuales de estaño crudo por fusión reductora de concentrados de alta ley (![]() 50% Sn), utilizando gas natural como combustible y aire enriquecido en oxígeno (25% O2) como comburente; de acuerdo a la composición del concentrado, a las reacciones que ocurrirían en el proceso, y a la cantidad de combustible requerido para la fusión, la cantidad de O2 gas que se requeriría en el soplo sería aproximadamente de 2,900 Nm3/h.
50% Sn), utilizando gas natural como combustible y aire enriquecido en oxígeno (25% O2) como comburente; de acuerdo a la composición del concentrado, a las reacciones que ocurrirían en el proceso, y a la cantidad de combustible requerido para la fusión, la cantidad de O2 gas que se requeriría en el soplo sería aproximadamente de 2,900 Nm3/h.
Considerando una CEFVB igual a 500, el cálculo de las dimensiones del horno sería el siguiente:
![]()
Despejando el volumen de baño, VB, queda:
VB = 5.8m3
La relación Volumen del horno/Volumen del baño, VH/VB, es una medida del volumen en exceso del horno, necesario para proporcionar espacio a los gases sobre la superficie del baño líquido, para controlar las salpicaduras, liberación de gotas de líquidos y en algunos casos para la post combustión de CO, H2 y vapores metálicos que surgen del baño.
La geometría del horno y la ubicación de los lugares para alimentación de sólidos y salida de gases y polvos de estaño también afectan al volumen del horno con relación al volumen del baño que está contenido en aquel. Un alto valor de CEFVH resulta en un reactor más pequeño, más intensivo y menos costoso y en bajas pérdidas de calor para la misma capacidad de fusión. Generalmente la relación que debe existir entre el volumen del horno y el volumen del baño en un horno tipo AUSMELT está entre 3 a 1 y 3.5 a 1.
La experiencia dice que, dada la intensidad de la combustión y la turbulencia que ésta produce durante el proceso, para evitar que las salpicaduras de líquidos lleguen a la parte superior del horno y formen acreciones que son difíciles de eliminar cuando se acumulan, es deseable trabajar con altas relaciones VH/VB, mayores a 3/1. Así si se desea trabajar con una relación VH/VB = 3.2, para el caso del ejemplo, el volumen del horno resulta igual a:
VH = 3.2 x 5.8 m3 = 18.56 ![]() 19 m3
19 m3
Teniendo ya los volúmenes de horno y de baño requeridos para una combustión intensa, se fija un valor para el diámetro interno del horno y se calcula la altura del horno (aproximadamente hasta la línea de alimentación de sólidos e ingreso de la lanza). Así, para un diámetro interno del cilindro igual a 2.3 m:

Con estas consideraciones de capacidades específicas comprobadas, los hornos modernos son más compactos, más intensivos y mucho más sencillos de construir y de operar.
Se informó que el horno Ausmelt de Vinto operará inicialmente solo con aire. Esto significa que cuando comience a operar con aire enriquecido en oxígeno, su capacidad de tratamiento se incrementará considerablemente, tomando en cuenta sus dimensiones aproximadas (3.40 m diámetro interior por 8.00 m altura cilindro) y el formidable efecto del enriquecimiento con oxígeno que intensifica las reacciones.
Conclusiones
La fusión reductora de minerales y concentrados de estaño es altamente influenciada por la presencia de Fe que invariablemente acompaña a los minerales de estaño, y es la base para la toma de decisiones sobre el diagrama de flujo a seguir; si se reduce el estaño por etapas, con la consiguiente formación de cabezas duras, o si se hace una reducción controlada del estaño, seguida de un proceso de volatilización de estaño de las escorias. En la actualidad ambas alternativas pueden se correctamente ejecutadas y controladas.
Referencias
1. JOFFRÉ, J. E. "Consideraciones termodinámicas de la reducción de estaño". II.MM. (Bolivia). En: Simposio internacional del estaño, Noviembre, La Paz, Bolivia, 1977. [ Links ]
2. DAVEY, T. R. A. "The Fe - Sn phase diagram and its practical consequences for tin smelting and refining" C.S.I.R.O. (Australia). En: Simposio internacional del estaño, Noviembre, La Paz, Bolivia, 1977 [ Links ]
3. KELLOGG, H.H., y DÍAZ, C. "Bath smelting processes in nonferrous pyrometallurgy. An overview". En: Savaard/Lee International Symposium on Bath Smelting, p. 39 - 65. T.M.M.M.S. 1992. [ Links ]