Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.36 Oruro May 2015
ARTÍCULO ORIGINAL
Tostación de marmatita
Marmatite roasting
Tostação de marmatita
Carlos Velasco Hurtado
M. Sc. Tecnologías de Protección Ambiental, Ing. Metalúrgico
Docente, Carrera de Ingeniería Metalúrgica y Ciencia de Materiales
Universidad Técnica de Oruro
cvelascohu@yahoo.es
Marco Aurelio Mercado Frías
Ingeniero Metalúrgico Gobernación del Departamento de Oruro
Resumen
Se ha estudiado la formación de ferritas de zinc durante el proceso de tostación de concentrados de marmatita (Zn,Fe)S, procedentes de la Empresa Minera Colquiri. El estudio realizado a nivel de laboratorio, ha determinado la influencia de la temperatura y el tiempo del proceso sobre la proporción de los diferentes compuestos oxidados obtenidos en el producto tostado, especialmente la formación de ferritas de zinc, ZnO.Fe2O3, productos insolubles que afectan a la recuperación del zinc de este producto en un posterior proceso de lixiviación ácida.
Se concluye que en la tostación de estos concentrados, no es posible evitar la formación de ferrita de zinc, que constituyen aproximadamente el 30% del tostado obtenido a 750 °C, y hasta un 43% del tostado cuando la temperatura del horno se eleva hasta 1,050 °C.
Palabras clave: Tostación, ferritas de zinc, marmatita, concentrados de zinc.
Abstract
It has been studied the formation of zinc ferrite during the roasting process of marmatite concentrates (Zn, Fe)S, from Empresa Minera Colquiri.Thestudy madeatthe laboratory determined the influence of temperatureand processingtime in the proportion of the various oxidized compounds obtained from the roasted product, especially in the zinc ferrite formation ZnO.Fe2O3, an unsolvable product that affeets the zinc recovery from product in a subsequent acid lixiviation process.
It is concluded that in the roasting of these concentrates it's not possible to avoid the formation of zinc ferrite, which constitutes approximately 30% of roasted obtained at 750 °C and up to 43% of roasted when the furnace temperature is raised to 1,050 °C.
Keywords: roasting, zinc ferrites, marmatite, zinc concentrates.
Resumo
Foi estudada a formação de ferritas de zinco durante o processo de tostação de concentrados de marmatita (Zn, Fe) S, da Empresa Minera Colquiri. O estudo realizado no laboratório determinou a influencia da temperatura e do tempo de processamento na proporção dos vários compostos oxidados obtidos a partir do produto tostado, especialmente na formação de ferritas de zinco ZnO.Fe2O3, produtos insolúveis que afetam à recuperação de zinco num processo posterior de lixiviação ácida.
Concluiu-se que, na tostação de estes concentrados não é possível evitar a formação de ferrita de zinco, o que constituí cerca de 30% do produto tostado obtido a 750 °C e até 43% do tostado quando a temperatura do forno é aumentada para 1050 °C.
Palavras chave: Tostação, ferritas de zinco, marmatita, concentrados de zinco.
1. Introducción
La Empresa Minera Colquiri, dependiente de COMIBOL, está ubicada en la provincia Inquisivi del Departamento de La Paz, a una altura de 4,200 m.s.n.m. y a 60 Km. al norte de la ciudad de Oruro, tiene un yacimiento mineralógico del que produce en su planta de beneficio un concentrado de estaño y otro de zinc. La composición química del concentrado de zinc es mostrado en la tabla 1.
Mineralógicamente el concentrado de zinc es mayoritariamente marmatita, asociada a pirita, cuarzo, casiterita y rocas.
El trabajo ha sido realizado a nivel de laboratorio, y se ha estudiado la influencia de las variables del proceso detostación de manera de conocer las condiciones de operación en las que se forman las ferritas de zinc (ZnO*Fe2O3), y en que extensión son formadas en el concentrado estudiado; con el objetivo de tener una información básica para el diseño de un posible proceso de tostación-lixiviación para la recuperación del zinc producido en esta empresa.
El sistema Zn-Fe-S-O
La marmatita es un mineral sulfuroso de zinc, en el que el ZnS ha sido sustituido en la estructura cristalina por FeS hasta un 36% aproximadamente, como máximo. El hierro no puede sustituir totalmente al zinc en la blenda, porque la triolita (FeS) es hexagonal en tanto que la blenda es cúbica. La marmatita tiene la fórmula (Zn,Fe,)S.
Debido a que los sulfuros son insolubles en soluciones de ácido sulfúrico diluido, es necesario realizar la conversión a óxidos y/o sulfatos por medio de la tostación oxidante, porque éstos son solubles en dichas soluciones; además el sulfato es soluble en agua.
En la tostación de la marmatita, se deben tener en cuenta las relaciones de equilibrio en los sistemas individuales Zn-S-O como Fe-S-O, así como las del sistema cuaternario Zn-Fe-S-O.
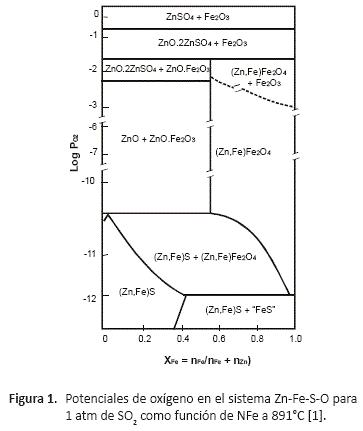
La dificultad en la tostación de marmatita reside en el hecho de que los óxidos producidos pueden reaccionar entre sí dando óxidos complejos. Esto se ilustra en las figura 1, la cual muestra los equilibrios de fase en el sistema Zn-Fe-S-O para una presión constante de SO2 igual a una atmósfera, que ha sido tomada de Rosenqvist [1], y que ha sido construida para la temperatura de 891 °C. En la oxidación de la marmatita se pueden formar las fases "espinela" (Zn,Fe)Fe2O4, y "ferrita" ZnO.Fe2O3, que son compuestos insolubles en ácido diluido, y su formación no es deseada si la tostación se la realiza como etapa de preparación de la carga para un proceso de lixiviación.
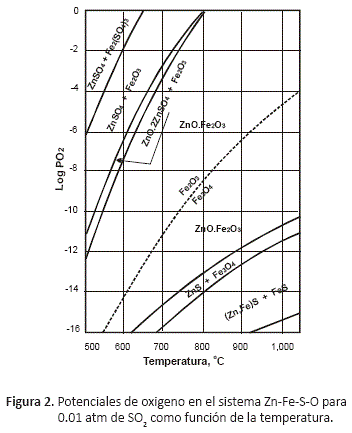
Desde un punto de vista termodinámico, dependiendo de la temperatura y de la composición de la fase gaseosa, la tostación da lugar a la formación de uno u otro producto. En la figura 2, se pueden observar las zonas de estabilidad de los diferentes productos que puedes formarse a diferentes temperaturas de tostación, como una función de la presión de oxígeno.
Experimentación
Las pruebas experimentales se realizaron de manera discontinua en un horno tubular con calefacción eléctrica y temperatura regulable, en el que se cargaron para cada prueba 120 gramos de concentrado, los que se mantenían situados en el piso del horno de manera estática. El horno fue calentado previamente a la temperatura establecida según el plan de trabajo preparado. Durante las pruebas se mantuvo constante el flujo de aire de ingreso en 889 l/h, medido a 20 °C y 0.64 atmósferas, que es el valor de la presión atmosférica en el laboratorio donde se desarrollaron las pruebas experimentales.
El material tostado fue descargado del horno, enfriado y pesado. Después de pulverizarlo a -200 mallas Tyler, se caracterizaron las muestras por análisis químico y difracción de rayos X.
Un esquema del equipo experimental utilizado para la realización de pruebas se muestra en la figura 3.
Las variables estudiadas fueron la temperatura y el tiempo de tostación, manteniendo constante el flujo de ingreso de aire. Como valores extremos para este estudio se fijaron las temperaturas de 750 y 1,050 °C, en base a las temperaturas de operación industrial para este tipo de concentrados.
La variable tiempo se estudió para determinar los periodos en los que se van formando las ferritas de zinc. La tostación fue realizada a diferentes periodos de tiempo, luego de los cuales el horno fue descargado, el tostado enfriado y posteriormente sometido a la determinación de las fases formadas.
Resultados
La experimentación fue realizada de manera discontinua; la carga se encontraba estática sobre el piso del horno tubular y el aire fluía sobre la superficie del sólido, desde donde el oxígeno difunde al interior del sólido a través de los poros del óxido formado por la tostación hasta llegar a las interfases de reacción, lugar en el que sucede la reacción química. La tostación transcurre de acuerdo al modelo de núcleo sin reaccionar, y es más rápida al principio debido a que no existe una capa de producto, y se va haciendo más lenta a medida que transcurre el tiempo porque se van formando diferentes capas de productos oxidados en la zona cercana a la superficie, que van creciendo en espesor a medida que transcurre la reacción, dificultando la difusión de los gases hacia y desde el interior del mineral.
En el interior del sólido, se tiene una gradiente de concentración delos gases, en el caso del oxígeno este gas es más concentrado en la superficie externa de la carga, y su concentración va disminuyendo a medida que penetra al interior del sólido. En el caso del SO2, es más concentrado en la interfase sulfuro no reaccionado-óxido, y disminuye a medida que va abandonando el sólido. En el sólido se producen también varias interfases de reacción entre productos intermedios, como se muestra en el siguiente esquema.

La oxidación de la marmatita en el proceso de tostación sucede de manera simultánea en todo el cristal, de manera que la velocidad con la que se oxida el ZnS es la misma con la que se oxida el FeS, como se puede ver en la figura 5, que es un ejemplo del tipo de gráficos obtenidos cuando se representan las fracciones reaccionadas de ZnS y FeS considerando que reaccionan de manera independiente. La superposición de las curvas de fracción reaccionada es perfecta, y muestra que en la tostación de este tipo de minerales complejos:
![]()
Donde:
-rZnS Velocidad de oxidación del ZnS de la marmatita.
-rFeS Velocidad de oxidación del FeS de la marmatita
-r(Zn ,Fe)S Velocidad de oxidación de la marmatita
El efecto de la temperatura sobre el grado de oxidación de la marmatita a diferentes tiempos de tostación se muestra en la figura 6, y permite observar que la velocidad de oxidación del sulfuro tiene poco incremento entre 750 y 950 °C, y va haciéndose más rápida a temperaturas superiores.
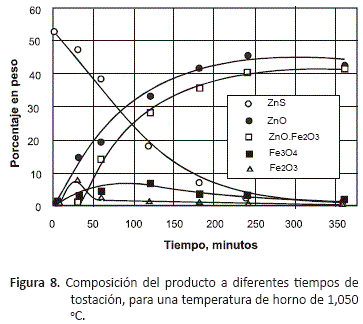
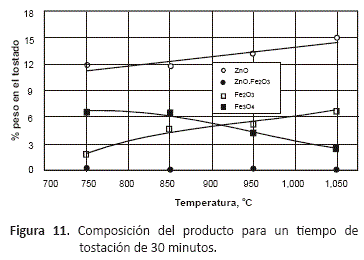
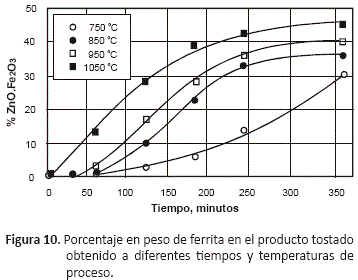
El tipo de productos de oxidación obtenidos y la proporción de los mismos en el tostado, depende de las condiciones en las que se desarrolle la tostación, y del tiempo de permanencia del sulfuro en el horno. Dependiendo de la temperatura y la composición de la atmósfera gaseosa en el horno, serán favorecidas la formación de algunas especies. Las figuras 7 y 8 permiten observar la variación en la composición de la calcina a las dos temperaturas extremas del estudio, 750 y 1,050 oC, la composición del producto tostado mostrado en estas gráficas está en porcentaje en peso de los componentes en el tostado.
Un proceso de tostación realizado como una etapa de preparación de la carga para un proceso de lixiviación ácida del zinc, debe llevar a maximizar la formación de los compuestos
de zinc solubles en ácido, ZnO y ZnSO4, y minimizar la formación de compuestos insolubles, como las ferritas de zinc, ZnO.Fe2O3.
La siguiente figura, muestra la fracción de ZnO formado durante el proceso de tostación, esta fracción ha sido calculada a partir de la relación:
![]()
La fracción de ZnO es la proporción del zinc de la carga que puede ser solubilizado con ácido en una operación normal de lixiviación.
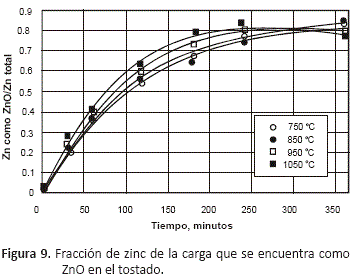
A partir de esta figura, se ve que a temperaturas de 750 y 850 °C, se forma ZnO a una menor velocidad que cuando se realiza el proceso a temperaturas mayores, pero con tiempos de tostación largos se pueden conseguir elevadas proporciones de ZnO. Cuando se realiza la tostación a 950 y 1,050 °C, se obtiene la mayor proporción de ZnO cerca a las cuatro horas de proceso, para tiempos de residencia mayores, disminuye la proporción de ZnO en el producto.
La formación de la ferrita de zinc (ZnO.Fe2O3), se ve favorecida por un incremento de la temperatura de tostación. A medida que se incrementa la temperatura en el horno la cantidad de zinc en la ferrita también aumenta, llegando a su máximo de composición a las seis horas. Hasta las dos horas es poca la cantidad de ferrita, y se incrementa su proporción recién a partir de ese tiempo llegando al máximo a las 6 horas de trabajo.
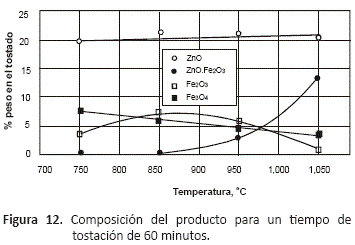
Este comportamiento se visualiza mejor en las figuras 11 y 12, en las que se muestra la proporción de los óxidos formados por la tostación a los 30 y 60 minutos de proceso.
Estas gráficas permiten observar que al inicio del proceso, se forman mayoritariamente ZnO y Fe3O4, que se encuentran como especies libres, no combinadas entre sí, y también una cantidad menor de Fe2O3, que se va incrementando de manera lineal a medida que se aumenta la temperatura. A 60 minutos y temperaturas mayores a 850 °C comienza a formarse la ferrita, y como se puede ver en la figura 12, la aparición de esta fase coincide con una disminución en la proporción de Fe2O3, lo que indica que para este tiempo de proceso y a estas temperaturas, esta especie disminuye su proporción porque se combina con el ZnO de acuerdo a la reacción:
![]()
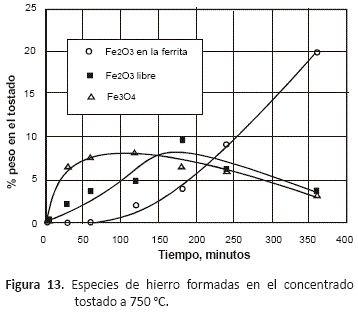
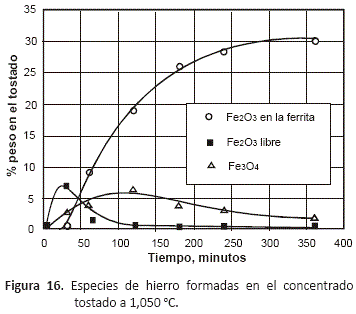
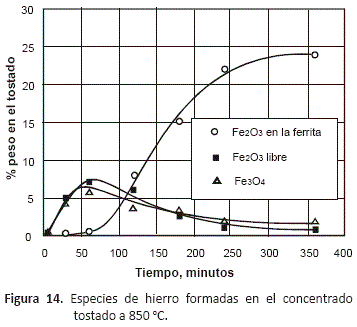
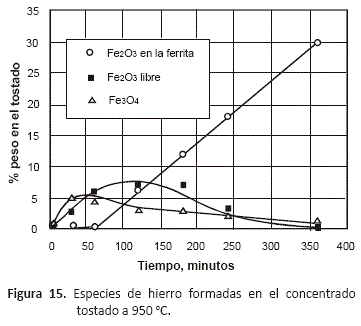
En el caso de las especies de hierro presentes en el tostado, las figuras 13 a 16 en las que se han representado sólo las especies oxidadas de este metal, permiten observar que tostando entre 750 y 950 °C, se forma inicialmente la magnetita, Fe3O4, que es el óxido de hierro mayoritario al inicio del proceso, y conforme va transcurriendo el tiempo, disminuye su contenido hasta alcanzar un mínimo a las 6 horas de tostación debido a que se va oxidando hasta Fe2O3 a medida que la composición del gas va haciéndose más rica en oxígeno. Sólo en las pruebas realizadas a 1,050 °C, se pudo observar inicialmente un contenido mayor de Fe2O3 que de magnetita. En estas figuras se puede observar que a todas las temperaturas, el decrecimiento en la proporción de Fe2O3 en el tostado coincide con la aparición de la fase ferrita, fase que alcanza su máximo contenido a las 6 horas de proceso.
Discusión de resultados
En las figuras 17 y 18 se presentan los diagramas de predominancia de fases del sistema Fe-Zn-S-O para las temperaturas de 750 y 850 °C. Estos diagramas permiten observar las fases estables bajo determinadas condiciones de composición de la fase gaseosa a las temperaturas mencionadas, y permiten además seguir el camino de transformación que sigue la marmatita hasta convertirse en el producto final de tostación.
En estos diagramas se ha dibujado la zona comprendida entre las isobaras correspondientes a la presión de SO2 igual a 0,0064 atm, que corresponde a la composición de la fase gaseosa igual a 1% de SO2, y presión de SO2 igual a 0.064 atm, que corresponde a la composición de la fase gaseosa igual a 10% SO2, que son aproximadamente las composiciones promedio del gas en el interior y el exterior de la partícula en las pruebas experimentales realizadas. Es a lo largo de esta zona donde transcurren las reacciones de oxidación en el interior del grano de marmatita.
Estos diagramas de predominancia de áreas muestran que el FeS requiere una concentración de oxígeno menor que el ZnS para empezar a oxidarse, y que el producto de oxidación es el compuesto Fe3O4. Los resultados experimentales muestran que en el (Zn,Fe)S se oxidan de manera simultánea el zinc y el hierro de la marmatita, produciendo ZnO y Fe3O4 desde el principio del proceso, como se puede observar en las figuras 7 y 8. La formación de la ferrita sucede luego de transcurrido aproximadamente una hora, y a partir de este tiempo, se tiene un incremento constante de la cantidad de esta especie.
Chen y Dutrizac [2], han encontrado resultados similares en el estudio de los cambios mineralógicos que suceden durante la tostación de una marmatita proveniente de la empresa CEZinc, Valleyfield, Canadá, mediante el estudio de imágenes obtenidas con microscopio electrónico (BSE). Los resultados de su investigación muestran que durante la tostación de marmatita, se forma en una primera etapa el óxido (Zn,Fe) O. El hierro de la fase (Zn,Fe)O migra hacia la periferia de las partículas, formando en una segunda etapa el ZnO.Fe2O3. El óxido (Zn,Fe)O es una fase homogénea, y el hierro en esta fase está probablemente en una solución sólida metaestable. El resultado es una partícula porosa formada por ZnO + ZnO.Fe2O3 en forma de masas esféricas.
En la tostación a 750 °C, debería formarse ZnSO4 como producto final, según se muestra en el diagrama de predominancia de fases del sistema Zn-Fe-S-O (figura 17). Este diagrama muestra que se requieren elevadas concentraciones de SO2 para formar la fase sulfato, que se dan al principio del proceso, cuando el área de reacción es máxima y no se ha formado aún una capa de producto. Las pruebas experimentales fueron realizadas de manera discontinua, de manera que la composición de la fase gaseosa al principio de la tostación es más rica en SO2; concentración que va disminuyendo a medida que se va consumiendo el azufre de la marmatita. La disminución de SO2 en la atmósfera del horno como sucede en los periodos finales del proceso ocasiona un desplazamiento de la línea de trabajo hacia la parte inferior del diagrama, y la zona de trabajo se desplaza por consiguiente hacia la zona de estabilidad de ZnO y Fe2O3 favoreciendo de esta manera la formación de ferritas.
Un incremento en la temperatura ocasiona que la zona de trabajo del horno se desplace hacia regiones donde no se forman sulfatos, y los productos de la oxidación son el ZnO y Fe2O3 ocasionando de manera inevitable la formación de la ferrita.
Si bien estos diagramas isotérmicos permiten tener una idea del transcurso de la reacción en condiciones de equilibrio; en el campo real estudiado existen desviaciones debido a que la oxidación de la marmatita es una reacción muy exotérmica y ocasiona que en la interfase sulfuro-óxido donde se están produciendo las reacciones químicas de oxidación, exista una elevación de temperatura. En estas condiciones no se puede considerar la temperatura del grano constante, sino que existe una distribución de temperatura desde la superficie del grano hacia la interfase de reacción sulfuro-óxido. En consecuencia las temperaturas de experimentación se refieren a la temperatura del horno, y la temperatura en la interfase del lecho de sulfuros es más elevada.
Las fases formadas a las otras temperaturas muestran una buena coincidencia con las fases finales predichas a partir del análisis termodinámico sobre la base de los diagramas de estabilidad de fases. Debido a que la composición de la fase gaseosa en el interior de los granos de sólido se desplaza hacia la zona donde son estables los óxidos de zinc y hierro, la formación de ferrita que sucede de acuerdo a la reacción entre los sólidos ZnO y Fe2O3 es por lo tanto favorecida con la elevación de la temperatura.
La esfalerita tiene una estructura cristalina tetraédrica, esta estructura está basada en aniones empaquetados en estructura cúbica cerrada. La ferrita de zinc tiene la fórmula general AB204 con una estructura cúbica que puede ser vista como una combinación de estructura de NaCl y esfalerita. La estructura cristalina de la marmatita (Zn,Fe)S es cúbica, lo mismo que de la ferrita de zinc (ZnFe2O4), lo cual hace que desde el punto de vista del consumo de energía, la transformación de marmatita a ferrita sea mas fácil que la transformación de marmatita a óxido de zinc libre ya que este óxido tiene una estructura cristalina hexagonal. Este cambio de estructura en el sólido requiere del reordenamiento de los átomos de Zn, Fe y O con un mayor consumo de energía. Por consiguiente desde el punto de vista de la estructura cristalina, en la tostación de marmatita siempre se formará inevitablemente alguna cantidad de ferrita.
Conclusiones
Los resultados de la investigación, han permitido establecer lo siguiente:
En base al estudio termodinámico, pruebas experimentales realizadas y el análisis de la estructura cristalina de los compuestos sólidos involucrados, se concluye que no es posible evitar la formación de alguna proporción de ferrita durante el proceso de tostación de marmatita.
La proporción de ferrita en el producto, es mayor cuanto más elevada es la temperatura de tostación.
Al principio de la tostación es posible producir cantidades elevadas de ZnO libre, ya que posteriormente una porción de este óxido va reaccionando con el Fe2O3 para formar ferrita.
La ferrita aparece en el tostado aproximadamente después de una hora de iniciada la tostación, y va incrementando su proporción más rápidamente cuanto más elevada sea la temperatura.
La tostación a temperaturas de 750 °C permite obtener un producto tostado con aproximadamente 30% de ferrita luego de 6 horas de tostación, en tanto que cuando se eleva la temperatura a 1,050 °C, la proporción de ferrita para el mismo tiempo es de 43%.
La fracción de zinc que se encuentra como ZnO libre luego de las 6 horas de tostación está en aproximadamente 80% para todas las temperaturas estudiadas. Este valor sería la máxima recuperación de zinc que se podría obtener en un proceso hidrometalúrgico de lixiviación neutra. Bajo las condiciones que se dan en un proceso de lixiviación industrial, es posible que las recuperaciones reales de zinc sean más bajas.
Debido a que el hierro se encuentra incrustado en la estructura cristalina de la esfalerita, no es posible separarlo por ningún método físico. Tampoco es posible separar el hierro de la marmatita realizando una tostación magnetizante. Después de realizar una tostación magnetizante se obtienen como producto ZnO y Fe304; de este producto no es posible separar el hierro por separación magnética, debido a que la magnetita formada se encuentra incrustada en la celda cristalizada de ZnO.
Los procesos de tostación que tienen el objetivo de preparar la carga para recuperar el zinc por vía hidrometalúrgica, deben producir un producto que pueda ser lixiviado bajo condiciones de "lixiviación neutra", su contenido de sulfatos debe ser bajo y deben tener la menor cantidad posible de ferritas. Por tanto, en un eventual proceso de lixiviación de los productos tostados provenientes de Colquiri, se tendrían recuperaciones no muy aceptables de zinc, haciendo necesario un retratamiento de los queques de lixiviación, para extraer el zinc remanente.
Referencias
1. ROSEN QVIST, T. Fundamentos de la Metalurgia Extractiva. Méjico: Limusa, 1987, ISBN 968-18-2144-0 [ Links ]
1. CHEN, T. T y DUTRIZAC, J. E. "Mineralogical changes occurring during the fluid-bed roasting of zinc sulfide concentrates". JOM-J Min.Met. Mat. Diciembre de 2004. [ Links ]
2. MERCADO F., MARCO. "Tostación de Marmatita". Tesis de Licenciatura. Tutor: Carlos Velasco Hurtado. Oruro: Universidad Técnica de Oruro, Carrera de Ingeniería Metalúrgica. 2010. [ Links ]
3. MISIC, L.; TRUJIC, V.; APOSTOLOVOSKI-TRUJIC, T. "High oxidative process for dead roasting of polimetalic sulfide concentrates. En: 15- International Research/Expert Conference TMT 2011, Praga, Checoslovaquia, 12-18 de septiembre de 2011. [ Links ]
4. NETAJI, V., KUMAR, J. "Study of kinetics involved in oxidation of ferrous metal sulphides". Tesis de Grado en Ingeniería Metalúrgica y de Materiales, Department of Metallurgical and Materials Engineering, National Institute of Technology, Rourkela, 2010. [ Links ]
5. QUEIROZ, C. A. R; CRVALHO, R. J. y MOURA, F. J. "Oxidation of zinc sulphide concentrate in a fluidized bed reactor- Part 2: The influence of experimental variables on the kinetics". Brazilian Journal of Chemical Engineering, Vol 22, N2 01, pp 127-133,2005. [ Links ]
6. CIGAN, J. M., MACKEY T. S. AND O"KEEFE. T. J. "Lead-Zinc-Tin'80". En: World Symposium and Metallurgy and Environmental Control. TMS-AIME, 1980. [ Links ]
7. KHALAFALLA, S. E. "La tostación como un proceso unitario". En: "Cinética de los procesos de la Metalurgia Extractiva". Primera edición. En: SOHN, H. Y., WADSWORTH, M. E. México: Editorial Trillas, ISBN 968-24-1915-8,1986. [ Links ]
8. HONG YON SOHN y GOEL, R.- "Principles of Roasting Minerals". Sci. Eng. Vol. 11, N2 3, Julio de 1979.
9. BENLYAMANI, M. y AJERSCH, F. Agglomeration of Particles during Roasting of Zinc Sulfide Concentrates. Metallurgical Transactions B, Vol 17B. Dec. Pp. 647 -655. [ Links ]
10. JOFFRE, E., JUAN E., Termodinámica Metalúrgica. Oruro: Ed. Universitaria, 2014, ISBN 968-6194-55-X. [ Links ]
11. VELASCO H. C. "Guías de Laboratorio de MET 2213", Universidad Técnica de Oruro, 2012. [ Links ]
12. H. ALAN FINE, Extractive Metallurgy Laboratory Exercises. The Metallurgical Society AIME. 1983. [ Links ]