Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.32 Oruro Dec. 2012
ARTICULOS ORIGINALES
Obtención de zinc por reducción carbotérmica alcalina
Obtaining alkaline zinc by carbothermal reduction
Obtenção de zinco por redução carbotérmica alcalina
Karina Campos Saravia * Carlos Velasco Hurtado
Luis Demetrio Siles Terán
Carrera de Ingeniería Metalúrgica y Ciencia de Materiales
Universidad Técnica de Oruro
Anirak2208@hotmail.com*
Resumen
Obtener zinc a partir de un sulfuro mediante un proceso de reducción carbotérmica puede ser viable si a las condiciones normales de operación se añade un agente desulfurizador como la cal o la caliza, que se caracterizan fundamentalmente por retener el azufre mediante la formación de CaS, evitando así que éste sea emanado al medio ambiente como SO2. El trabajo presenta el análisis termodinámico interpretativo de lo que acontece en la reducción carbotérmica alcalina y los resultados experimentales a nivel de laboratorio de la reducción de un mineral de zinc del tipo marmatita. Se demuestra que este planteamiento es altamente competitivo frente al proceso tradicional de vía clásica, destacando el bajo efecto sobre el medio ambiente y la demanda energética que tiene la reducción carbotérmica alcalina. En la experimentación realizada, se han alcanzado recuperaciones de zinc metálico del 90% y 99% con CaO y CaCO3 como agentes desulfurizantes, respectivamente.
Palabras clave: Reducción alcalina, marmatita, zinc, tecnología limpia.
Abstract
Obtaining zinc from a sulfide trough a carbothermal reduction process may be viable if a desulfurization agent as lime or limestone is added to the normal operation conditions. These agents are characterized by retaining the sulfur forming CaS, avoiding its emanation into the environment as SO2.
The paper presents the interpretative thermodynamic analysis of what happens in the alkaline carbothermal reduction, and the experimental results in the laboratory of the zinc mineral reduction (marmatite type). It's shown that the proposal is highly competitive versus the traditional process in a classical way, highlighting the low impact on the environment and the energy demand that the alkaline carbothermal reduction has. Zinc recoveries of 90% and 99% have been achieved in the experiment which have been made using CaO and CaCO3 as desulfurization agents.
Keywords: Alkaline reduction, marmatite, zinc, clean technology
Resumo
A obtenção dum sulfureto de zinco pelo processo de redução carbotérmica pode ser viável se às condições normais de operação normal é adicionado um agente de "dessulfurizacao" cal ou calcário, o qual é caracterizado pela retencao do enxofre e pela formacao de CaS, evitando por isso a emanação ao ambiente do SO2.
O trabalho apresenta a análise interpretativa termodinâmica do que acontece na redução carbotérmica alcalina, e os resultados experimentais do laboratório da redução dum mineral de zinco tipo marmatite. Demonstra-se que a ideia proposta é altamente competitiva em contraste com o processo tradicional da via clássica, destacando o baixo impacto sobre o meio ambiente e a demanda de energia da redução carbotérmica alcalina. No experimento feito, foram alcançados recuperações de zinco metálico de 90% e 99% com CaO e CaCO3 como agentes de dessulfurização respectivamente.
Palavras chave: redução alcalina, marmatite, zinco, tecnologia limpa.
Introducción
El zinc es uno de los materiales más utilizados, no sólo en estado puro, sino también aleado o con cierto grado de oxidación, es por eso que a lo largo del tiempo se han desarrollado varios procesos que hacen posible la obtención de zinc, algunos de los cuales han sido sustituidos totalmente por convertirse en tecnologías obsoletas.
Los minerales portadores de zinc más importantes se caracterizan por ser sulfurados, de los cuales los más representativos son la esfalerita y la marmatita, estando en este último mineral acompañado por hierro. La marmatita es considerada como un mineral complejo de zinc, que resulta de la sustitución de átomos de zinc por átomos de hierro hasta alcanzar un 36.5% en la estructura cristalina de la esfalerita (ZnS). Debido a que el hierro se encuentra incrustado en la estructura cristalina de la esfalerita, no es posible separar el mismo por ningún método físico.
Los procesos productivos que permiten obtener zinc u óxido de zinc a partir de sulfuros, se clasifican en pirometalúrgicos e hidrometalúrgicos, e independiente al tratamiento seleccionado, estos incluyen una etapa previa de oxidación obligatoria, que está relacionada directamente a la generación de agentes dañinos al medio ambiente.
Una alternativa de tratamiento a este tipo de menas de zinc, que evita precisamente lidiar con las dificultades señaladas, es la reducción carbotérmica en presencia de un agente alcalino, distinguido por su habilidad de captar el azufre.
Antecedentes del tratamiento metalúrgico del zinc
De manera general, el mineral concentrado sulfuroso, es sometido inicialmente a un proceso de tostación oxidante en presencia de aire, obteniéndose una calcina principalmente formada por óxido de zinc y otros acompañantes, dependiendo de la calidad del concentrado. Luego, la calcina es sometida a una etapa de reducción carbotérmica donde se produce vapor de zinc que luego es condensado.
El problema de reducir al zinc para obtener metal líquido, radica en la temperatura de ebullición que posee el zinc, 906 °C a 1 atm, es menor que la temperatura a la cual el CO(g), comienza a reducir al óxido de zinc, lo que hace que en los procesos de obtención pirometalúrgica tradicionales se obtenga este metal al estado gaseoso.
La vía hidrometalúrgica que permite obtener zinc requiere emplear las siguientes etapas de tratamiento: tostación, lixiviación, purificación, electrólisis y fusión.
La mayor dificultad de este tratamiento metalúrgico es la separación de zinc-hierro. En este caso se han desarrollado tres procesos que permiten la precipitación de hierro y por ende la separación del mismo de la solución rica, siendo estos: el proceso jarosita, goetita y hematita, cuyos residuos son químicamente inestables.
Como se vio, para cualquier caso de obtención de zinc, es necesaria la etapa de tostación, que puede ser calificada como desventajosa para el proceso global por los siguientes factores:
- Pérdida de calor.
- Formación de ferritas.
- Formación de sulfatos.
- Emanación de gases contaminantes.
- Disposición de desechos.
REDUCCIÓN CARBOTÉRMICA ALCALINA
La reducción directa de sulfuros en presencia de carbón, puede ser escrita de manera global por las siguientes reacciones:
![]()
![]()
Estas reacciones, termodinámicamente no son favorables para la mayoría de los sulfuros, considerando además que si el metal a ser extraído forma carburos estables, se abre también la posibilidad de que éstos se formen y no así el metal.
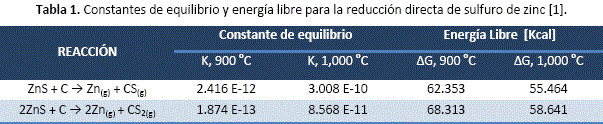
Para el caso del zinc en la tabla 1, se puede verificar que las reacciones de reducción carbotérmica directa, no son favorecidas energéticamente.
Modificando este escenario con condiciones desfavorables, es posible plantear las reacciones (3) y (4) a partir de la adición de cal.
![]()
![]()
De este planteamiento referido al caso del zinc, que en lugar de formar metal éste volatiliza, se puede destacar la posibilidad de separar los materiales volátiles de los no volátiles, y en el caso de la marmatita, separar el zinc como gas y dejar en el residuo al hierro, evitando de este modo la formación de ferritas como acontece cuando se elige un proceso que incluya un proceso de tostación.
Las reacciones (3) y (4), para mineral de marmatita, pueden escribirse como:
![]()
![]()
Estas reacciones permiten la obtención de zinc metálico al estado gaseoso, y por motivos experimentales donde es más sencillo poder oxidar el zinc gaseoso obtenido por reducción carbotérmica a óxido de zinc, en lugar de condensarlo a líquido, es necesaria la reacción:
![]()
En el caso de emplear caliza como agente alcalino, la reacción (5) es consecuencia de la reacción (6), esto por la descomposición inicial del carbonato en óxido a 900 °C, de acuerdo a la reacción (8):
![]()
El resultado de aplicar una reducción carbotérmica bajo la presencia de un agente alcalino a un mineral de carácter sulfuroso, que es mostrada a priori en las reacciones (5) y (6), es producto de la interacción de varias reacciones intermedias ya que así como están presentadas pueden llevar a interpretaciones equívocas sobre su ocurrencia inmediata, por tratarse de reacciones del tipo sólido-sólido.
Rafael Padilla [2], señala que el mecanismo de la reducción carbotérmica de sulfuros en presencia de CaO es complejo, debido a que involucra reacciones sólido-sólido, como se mencionó y reacciones sólido-gas, también involucra la formación de compuestos intermedios sólidos y gaseosos.
En este entendido, se puede llegar a plantear varios mecanismos que permitan interpretar las reacciones químicas que ocurren en un proceso de reducción carbotérmica bajo la presencia de un agente desulfurizante, sin embargo, se debe tomar en cuenta que todos los mecanismos que pueden ser escritos deberán ser sometidos a criterios cinéticos y termodinámicos para su valoración.
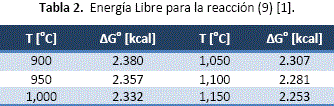
Inicialmente se puede plantear una reacción simple de intercambio de elementos, tal como muestra la reacción (9), la cual puede ser descartada por tener valores de energía libre positivos mostrados en la tabla 1.
![]()
Hua-Ching Hsu, Chun-I Lin y Hsi-Kuei Chen [3], plantean una reacción del tipo sólido-gas, que también permite la formación de sulfuro de calcio mediante la formación intermedia del COS gaseoso (sulfuro de carbonilo u oxisulfuro de carbono), debido a la interacción del monóxido de carbono y el azufre gaseoso, de acuerdo a la reacción (10):
![]()
Al parecer, la participación del COS (g) es fundamental, ya que éste permite obtener sulfuro de calcio, que es el compuesto químico que retiene al azufre y evita que este sea emanado al medio ambiente. La reacción que permite este cometido es:
![]()
Para Hua-Ching Hsu, Chun-I Lin y Hsi-Kuei Chen [16], la obtención de zinc gaseoso y formación de oxisulfuro de carbono es mediante la reacción (12):
![]()
En consecuencia, considerando que las reacciones del tipo sólido-sólido son menos probables que las reacciones sólido-gas, y que la presencia del COS (g), es necesaria para posibilitar la retención del azufre, se tomará en cuenta el planteamiento de los investigadores citados, teniendo presente que en todo el camino de la reducción carbotérmica alcalina, existirán reacciones intermedias cuyo resultado de interacción posibilite la obtención de zinc gaseoso y sulfuro de calcio, ya sea por la reacción (12) u otra que pueda presentarse.
Como en cualquier proceso de reducción, la reacción de Bouduard desempeña un papel muy importante.
![]()
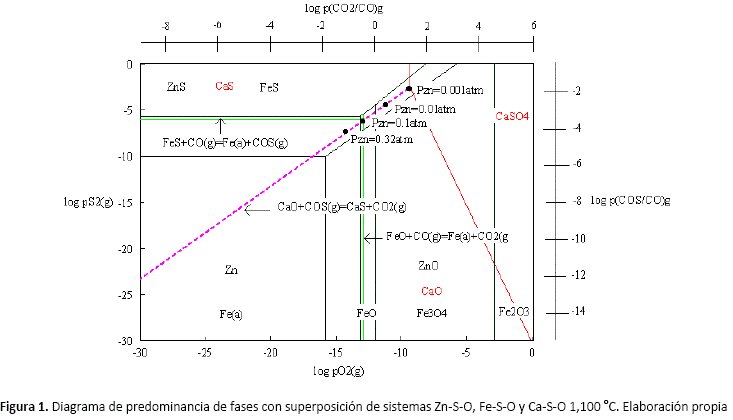
Los diagramas de predominancia de fases para los sistemas Zn-S-O, Fe-S-O y Ca-S-O a 1,100 °C superpuestos, se muestran en la figura 1; en los que se puede observar que la zona de reducción, se encuentra sobre la línea que separa las áreas de estabilidad del CaS y CaO.
Esta figura muestra también que la formación de vapor de zinc es favorecida cuando la razón CO2(g)/CO(g) es pequeña, en otras palabras, cuando la cantidad de CO(g) presente en la atmósfera del sistema es mayor que la de CO2(g). Del mismo modo, cuanto menor será la cantidad de COS(g) presente en la atmósfera mayor será la presión de zinc en la fase gaseosa.
Los diagramas de predominancia de áreas del sistema superpuesto Zn-Fe-S-Ca-O, muestran en la escala log(PCO2/PCO); que existe una relación mínima de este valor, que corresponde a la presión de equilibrio necesaria para producir la reducción del ZnS.
El zinc gaseoso obtenido se encuentra en equilibrio con fases condensadas tales como ZnS, Fe(![]() ), FeO o Fe3O4 no siendo necesaria la formación de zinc líquido como un requisito primordial para el proceso de volatilización de zinc.
), FeO o Fe3O4 no siendo necesaria la formación de zinc líquido como un requisito primordial para el proceso de volatilización de zinc.
Finalmente por interacción de las reacciones anteriormente planteadas, es posible escribir la reacción global del proceso:
![]()
Procedimiento experimental
Para la investigación, se utilizó como muestra concentrado de zinc proveniente de la mina Colquiri, que presenta el siguiente análisis: 41.96% Zn, 14,74% Fe, 32.19% S, 0.2% As, 0.32% Cd, 0.19% Cu, 0.46% Sn, 0.16% Pb. En este concentrado, el zinc se encuentra como marmatita.
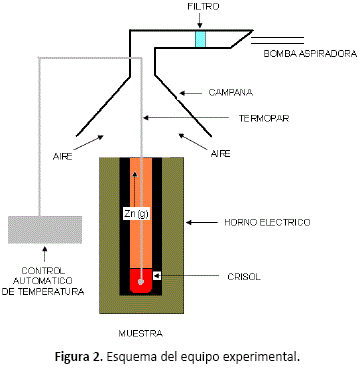
La experimentación ha sido desarrollada utilizando un horno eléctrico de temperatura regulable, en el cual 50 gr de mineral de la muestra fueron colocados en un crisol de mullita juntamente con carbón y el desulfurizante, en cantidades medidas según la variable de estudio.
El equipo experimental empleado, se muestra en la figura 2.
El zinc gaseoso producido, fue oxidado en la boca del horno por una corriente de aire falso, y el ZnO producido fue recuperado por un filtro colocado en una campana situada en la parte superior del horno.


La evaluación de resultados se ha realizado en base al análisis químico y peso de residuo que quedó en el crisol.
Efecto de la temperatura
El indicador empleado para evaluar los resultados es el porciento de recuperación de zinc en la fase gas. La temperatura fue la primera variable estudiada en diferentes niveles, empleando cal y caliza bajo las siguientes condiciones: relación de moles de mineral: carbón : agente alcalino = 1:1:1 y tiempo de reacción de 2.5 horas.
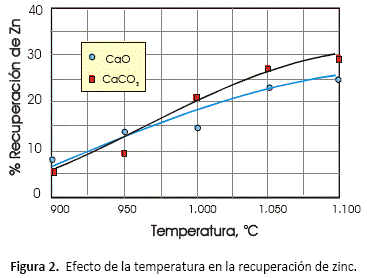
Como se ve, los mejores resultados ocurren al incrementar la temperatura por encima de los 1,000 °C y al emplear caliza.
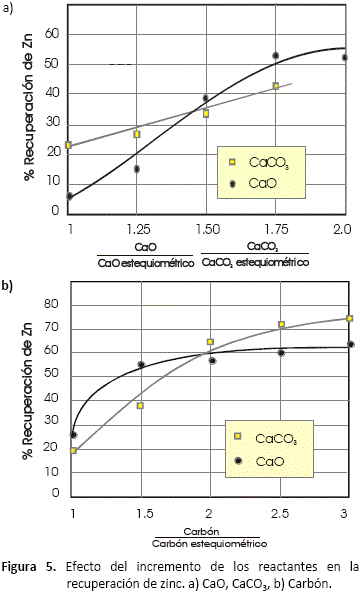
Efecto del incremento de los reactantes (agente alcalino y carbón)
Los siguientes resultados fueron obtenidos para diferentes relaciones de proporcionalidad de reactivos, en ambos casos se operó bajo la temperatura de 1,100 °C y por un tiempo de 2.5 horas.
En la figura 5, se aprecia el mejoramiento de la recuperación a medida que se incrementa la cantidad en la que los reactantes se hallaron presentes en el horno.
Efecto del tiempo de reacción
Las condiciones de operación de los siguientes resultados son: T=1,100 °C, relación de concentraciones: (Zn,Fe)S:C:CaCO3 = 1:2.5:1.5.
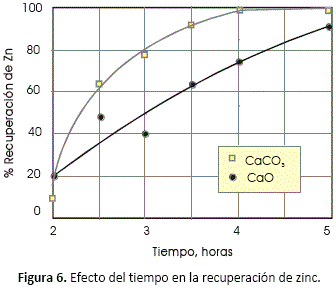
Como en la mayoría de los resultados previos, existe una mejor respuesta al emplear caliza que incluso alcanza un 99% al prolongar el tiempo de reacción a 5 horas.
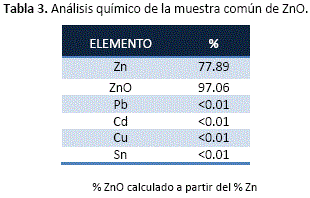
Calidad del producto obtenido
El producto resultante de la investigación inicialmente es zinc metálico al estado gaseoso, el cual fue condensado a óxido de zinc cuyas muestras recuperadas por el sistema de succión analiza la siguiente calidad de ZnO:
Repercusión al medio ambiente y a la demanda de energía
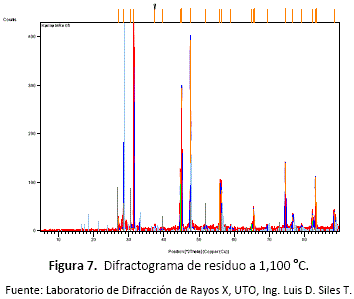
Mediante análisis químicos y ensayos de difracción de rayos X, se pudo evidenciar la retención total del azufre en forma de sulfuro de calcio eliminando así los impactos sobre la calidad del aire que se generan por el SO2. Los residuos sólidos que se generaron en las diferentes experimentaciones, fueron sometidas a test geoquímicos como los estudios del método SOBECK [4], los cuales revelaron que en ningún caso los residuos son generadores de DAR.

Respecto a la demanda de energía a partir de las reacciones que acontecen en el proceso, se determinó que la reducción carbotérmica alcalina, demanda menor requerimiento de energía que un proceso de tostación-reducción.
Discusión de resultados
La reducción carbotérmica alcalina de minerales sulfurosos de zinc, abre las puertas al estudio e investigación para la mejora de los procesos de obtención de óxido de zinc o zinc. Además muestra resultados favorables a escala de laboratorio que proyectan la idea de obtener los mismos resultados a escala piloto.
Las muestras sometidas a experimentación, por efecto del calentamiento hasta la temperatura de proceso ya experimentan una pérdida de peso, debido a los siguientes factores:
- Pérdida de humedad de la carga y el carbón.
- Eliminación del material volátil del carbón cargado al crisol.
- En las pruebas llevadas a cabo con caliza, la descomposición del carbonato de calcio a 900 °C según:
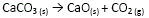
- La volatilización de zinc y la oxidación del C hasta CO(g) o CO2(g), según las reacciones 14.a y 14.b.
- Oxidación del carbón por el oxigeno de la atmósfera.
Como se puede ver, los ítems 1) al 3) ocasionan el mismo valor de pérdida de peso durante todas las pruebas experimentales, la pérdida de peso debido a la volatilización de zinc y oxidación del carbón como consecuencia de la reacción química es variable y depende del grado de reducción del ZnS.
En cuanto a la combustión del carbón durante el calentamiento de la muestra hasta la temperatura de la experimentación, se ha observado que sucede en un bajo grado debido a que la concentración de oxígeno en el interior del crisol es bastante baja.
A medida que se incrementa la temperatura, las reacciones (9) y (12) se ven poco favorecidas, entonces surge la interrogante que, cómo es posible poder reducir al zinc hasta que este se encuentre en forma de vapor con valencia cero, a partir de una fase sólida sulfurosa, si aún habiendo incrementado la temperatura hasta 1,100 °C, las dos reacciones planteadas mantienen valores de energía libre positivos. Para tratar de responder esto se puede citar nuevamente a Rafael Padilla, quien indica que las reacciones que se ven involucradas dentro de un proceso de reducción carbotérmica alcalina son complejas y que además incluyen reacciones intermedias las cuales posibilitan aquellas reacciones globales obtenidas.
La interacción de la cantidad de los reactantes, desempeña un papel muy importante ya que es necesario fijar límites de adición, pues su incremento indiscriminado puede llegar a constituirse en un desperdicio de los mismos.
Empleando el diagrama de predominancia de fases donde es posible determinar la presión de equilibrio necesaria para producir la reducción del ZnS a partir de la relación mínima del log(PCO2/PCO); en el horno se debe mantener una presión de CO(g) más elevada que la que corresponde a esta relación de equilibrio, para garantizar que la reacción (15), se mueva en dirección de la formación de zinc gaseoso elemental, y por lo tanto, no todo el CO(g) presente reacciona ya que existe una porción de CO(g) menor a la que corresponde a la proporción de equilibrio, que abandona el horno sin reaccionar. Así entonces, se puede escribir la siguiente reacción que toma en cuenta el CO que abandona el horno sin reaccionar:
![]()
La cantidad de xCO(g) que sale del horno, ocasiona la deficiencia de carbón mencionada anteriormente. Como se ve en la siguiente serie de reacciones, que indican que se requiere una cantidad x de carbón extra a la cantidad estequiométrica requerida.
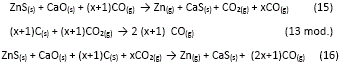
Por otra parte, en la mayoría de los resultados se aprecia una mejor respuesta al emplear caliza, esto está relacionado con la reacción de Bouduard y la alimentación indirecta de CO2(g) por la descomposición del carbonato de calcio mediante la reacción (8), la cual no es instantánea sino que la caliza va descomponiéndose paulatinamente en el horno; y por lo tanto, va cediendo el CO2(g) que a alta temperatura y en presencia de exceso de carbón es inestable y tiende a formar rápidamente monóxido de carbono generando así un ambiente más reductor en la fase gaseosa del sistema (reacción (16).
Desde el punto de vista cinético, y al contar con resultados del grado de reacción de la muestra y tiempo, fue posible determinar la etapa controlante del proceso, la cual se rige por la reacción química entre reactantes tanto al emplear cal como caliza. El tiempo necesario para volatilizar el total de zinc del sulfuro en el caso de caliza es de 7.4 horas y 12.4 horas en el caso de emplear cal. Al exponer durante 5 horas la carga que contiene caliza, el tiempo de reacción es cercano al requerido para volatilizar el 100% de zinc, tanto así que el análisis químico para esta prueba alcanza 0.209% de zinc y la recuperación es de 99.35%.
En el caso del hierro, tal como se planteó al inicio de la descripción termodinámica donde a este se le atribuye sólo un cambio en su estado de oxidación, el ensayo de difracción de rayos X corrobora su presencia en el residuo como Fe(![]() ) cuando la temperatura es elevada a 1,100 °C y bajo condiciones fuertemente reductoras, tal como muestra el diagrama de predominancia de fases superpuesto que muestra el equilibrio entre Zn gaseoso y Fe(
) cuando la temperatura es elevada a 1,100 °C y bajo condiciones fuertemente reductoras, tal como muestra el diagrama de predominancia de fases superpuesto que muestra el equilibrio entre Zn gaseoso y Fe(![]() ).
).
Respecto de la calidad del producto, en la mayor parte de los resultados para diferentes condiciones experimentales el contenido de Zn en ZnO supera el 70%. El producto común obtenido puede ser catalogado de buena calidad habiendo sido contaminado principalmente por As y Cd, a medida que las condiciones reductoras en las pruebas experimentales fueron aumentadas; en cambio en condiciones de deficiencia de carbón los elementos citados fueron retenidos en el residuo por el calcio. Dependiendo entonces la calidad del producto de la calidad del concentrado a alimentarse.

Conclusiones
- La reducción carbotérmica de mineral sulfuroso de zinc como la marmatita bajo la presencia de un agente desulfurizante sea este cal o caliza, es posible a través de varias reacciones intermedias de la fase condensada sólida a la fase gaseosa.
- El azufre es retenido en forma de sulfuro de calcio de manera eficiente.
- La calidad del óxido de zinc está a la altura de ser un producto comercial con leyes de zinc muy cercanas al óxido de zinc puro.
- La operación del sistema a temperaturas por encima de los 1,100 °C favorece notablemente el proceso.
- La mejor relación de proporciones molares de (Zn,Fe)S:C: CaO es 1:2.5:1.5; es decir para obtener los mejores resultados se debe emplear 2.5 veces más el valor estequiométrico de carbón y 1.5 veces más el valor estequiométrico de cal o caliza.
- El tiempo de operación obtenido en las condiciones experimentales, muestra que para tiempos mayores a 5 horas en se obtienen valores de recuperación superiores al 90%, tanto al operar con cal como con caliza.
- El proceso planteado, presenta una gran ventaja sobre los efectos del medio ambiente, debido a la no generación de gases sulfurosos y a que los residuos sólidos del proceso los posibles contaminantes, estos se caracterizan por no ser generadores de drenaje ácido de roca, lo que favorece a su deposición segura.
- Respecto al consumo de energía, el proceso planteado tiene una menor demanda de energía cuando se emplea cal y supera levemente el consumo de energía de un proceso tostación-reducción cuando se emplea caliza respecto del tratamiento de una tonelada de mineral, tomada como base para realizar la comparación.
Bibliografía
- PADILLA, Rafael. "Reducción Carbotérmica de Sulfuras Metálicos". Revista Metalúrgica. Carrera de Ingeniería Metalúrgica, Facultad Nacional de Ingeniería. Oruro, Bolivia: Diciembre 2000, 21, p.5-12. [ Links ]
- HUA-CHING Hsu, CHUN-I Lin, HSI-KUEI Chen. "Zinc Recovery from Spent ZnO Catalyst by Carbon in the Presence of Calcium Carbonate". Metallurgical and Materials Transactions. Vol 35B pág. 55-63, 2004. [ Links ]
- ZAMORA, Gerardo; BENZAAZOUA, Mostafa. "Predicciones de Drenaje Ácido de Roca Mediante Tests Geoquímicos Estáticos y Dinámicos". Revista Metalúrgica. Carrera de Ingeniería Metalúrgica, Facultad Nacional de Ingeniería. Oruro, Bolivia: Julio 2003, 24, p.5-13. [ Links ]