Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.27 Oruro June 2006
ARTICULOS ORIGINALES
Estudio del proceso de cristalización de sales de las aguas ácidas de la mina San José por evaporación
Ing. Raúl P. Quezada Hinojosa Dr. Ing. Gerardo Zamora Echenique
Carrera de Ingeniería Metalúrgica y Ciencia de Materiales Universidad Técnica de Oruro
Resumen
La mina San José cuyas operaciones fueron cerradas en 1992, presenta las características requeridas para la formación de drenaje ácido. En sus extensas galerías y socavones, así como en sus desmontes aledaños a la ciudad de Oruro, existe material sulfuroso el cual es oxidado y disuelto por aguas subterráneas y de lluvia. El agua de interior mina con valores de pH ácidos de 1.2 - 2.5, es bombeada sin tratamiento a fin de mantener accesibles los niveles más profundos para una futura explotación, logrando ésta atravesar nuestra ciudad y desembocando gradualmente en el lago Uru Uru.
Como alternativa de mitigación, en los estudios de remediación al impacto ambiental de la mina, se propuso la aplicación de la cristalización de sales disueltas en las aguas de mina, mediante su evaporación en lagunas o estanques de gran área y apropiadamente aisladas para evitar infiltraciones de agua ácida en acuíferos subterráneos.
El objetivo de este trabajo es el estudio del proceso de cristalización de las sales que tomará lugar durante la evaporación de las aguas ácidas de mina. La investigación realizada contempló el principal efecto del porcentaje de agua evaporada y la variación de temperatura sobre la saturación de las posibles especies sólidas a cristalizar.
1. INTRODUCCIÓN
Los antiguos trabajos de explotación minera y de beneficio de minerales, efectuados a lo largo de muchos años en diferentes regiones del mundo, han dado lugar a la formación de grandes cantidades de material de desecho: roca estéril, menas agotadas y colas de proceso.
En la actualidad, uno de los principales impactos ambientales causados por las labores mineras y los desmontes depositados, se debe a la infiltración de aguas superficiales y subterráneas, generando las diversas formas de Drenaje Ácido de Mina (DAM) y Drenaje Ácido de Roca (DAR).
En el transcurso de las dos últimas décadas, varias técnicas de tratamiento han sido desarrolladas con el propósito de mitigar la contaminación producida por el agua de mina en el ambiente receptor. Si bien varias de estas técnicas tienen hoy en día un amplio uso en el tratamiento de aguas ácidas, aún se siguen investigando y desarrollando nuevas alternativas que reduzcan mucho más la contaminación producida por el DAM y representen además un menor costo de tratamiento.
En nuestro medio estos métodos bien podrían aplicarse, ya que al igual que en otras regiones mineras del mundo se van generando grandes volúmenes de drenaje ácido. Tal es el caso de las aguas ácidas provenientes de la mina San José y los desmontes mineros ubicados en diferentes zonas cercanas a la ciudad. En la actualidad la mina se encuentra fuera de operación, y a fin de evitar su inundación, el agua procedente de su interior es continuamente evacuada al exterior sin ningún tratamiento, fluyendo a través de canales deteriorados dentro y fuera de los límites de la ciudad.
Las conclusiones del Proyecto de Remediación de la Mina San José realizado por la consultora Dames & Moore Norge, proponen que la medida más adecuada de atenuación del impacto ambiental del drenaje ácido, es recolectar las aguas ácidas en lagunas de evaporación. Se propone además la consolidación de los residuos mineros, siendo por lo tanto, necesario el manejo apropiado de los lixiviados ácidos para su posterior evaporación.
Dentro de la serie de investigaciones realizadas con el propósito de mitigar el impacto ambiental que el drenaje ácido de la mina San José genera, se decidió estudiar el proceso de cristalización de las sales de los metales disueltos en el agua de mina, que tendrá lugar durante la evaporación de la misma, determinando las principales variables que controlan este proceso.
2. OBJETIVO
El objetivo del presente trabajo de investigación, es el de estudiar el proceso de cristalización de sales y minerales disueltos en las aguas ácidas de la mina San José mediante evaporación-cristalización, como alternativa de eliminación de metales pesados disueltos.
3. EQUILIBRIO GEOQUÍMICO
La interpretación de calidad de aguas se realiza estableciendo equilibrios geoquímicos, equilibrios iónicos, balances de masa y balances de carga para cada ión disuelto. De esta forma se determina qué sales o minerales tienden a ser disueltos o precipitados en determinadas condiciones, o qué reacciones pueden ocurrir para dar al agua una composición específica.
La oxidación de sulfuros y la disolución de sales e iones metálicos durante la formación del Drenaje Ácido de Mina, establece una serie de equilibrios simultáneos, formando varias especies disueltas en el agua: iones libres, complejos acuosos y pares iónicos.
Para determinar el grado de saturación de una solución con respecto a un mineral particular o sólido, se compara la constante de equilibrio para la solubilidad del mineral (constante de producto de solubilidad), con el producto de las actividades reales de los iones presentes en la solución; de este modo se establece una relación llamada índice de saturación (SI).

Donde IAP es el producto de actividad iónico.
De la comparación del producto de actividad iónico con la constante de producto de solubilidad, se puede determinar que:
* IAP > Kps (SI > 0). La solución está sobresaturada y se puede producir la cristalización
* IAP = Kps (SI = 0). La solución está saturada y en equilibrio.
* IAP = Kps (SI = 0). La solución está infrasaturada y mayor cantidad de la fase sólida puede ser disuelta.
4. MATERIALES Y MÉTODOS DE INVESTIGACIÓN
El estudio del proceso de cristalización de sales de las aguas ácidas de mina, se realizó mediante pruebas experimentales a nivel laboratorio. Para dicho efecto se consideraron algunas de las posibles variables que tengan influencia durante la evaporación de aguas ácidas en las lagunas propuestas en el Plan de Remediación Ambiental para la Mina San José.
La investigación se dividió en dos partes principales:
* Cristalización en forma discontinua
* Cristalización con alimentación continua
Muestreo y Caracterización del Agua de Mina
Se realizaron dos muestreos de AAM en dos fechas distintas; ambas muestras fueron tomadas del canal de bombeo, en la boca mina del cuadro Santa Rita, Los resultados del análisis químico de cada muestra se presentan en las tablas 1 y 2.
Cristalización en forma discontinua
Las pruebas fueron realizadas evaporando volúmenes fijos de agua ácida en recipientes abiertos. Los objetivos alcanzados con estas pruebas son los siguientes:
* Determinar las sales (sulfatos, cloruros y óxidos hidratados) que cristalizan a diferentes porcentajes de agua evaporada (% evaporación).
* Analizar el efecto que tiene la temperatura en la cristalización por evaporación.
* Determinar qué sales cristalizan por enfriamiento de la solución.
El flujograma de tratamiento al cual fueron sometidas las muestras de aguas ácidas de la mina San José, se muestra en la figura 1. El bosquejo del equipo utilizado para las pruebas de cristalización discontinua por evaporación, es presentado en la figura 2.
Cristalización con alimentación continua
Se realizó un proceso de evaporación-cristalización con alimentación continua en vacío, El vacío es producido para causar la distensión de la solución y acelerar su evaporación. Los objetivos alcanzados con estas pruebas son los siguientes:
- Estudiar el efecto de la adición permanente de iones (efecto del ión común), a la solución durante su evaporación, hasta su sobresaturación
- Condensar el vapor para su análisis, con el fin de detectar la posible presencia de compuestos capaces de evaporar conjuntamente con el agua.
La figura 3, presenta el flujograma de tratamiento.
La figura 4, muestra el equipo experimental para estas pruebas.
5. RESULTADOS DE LA INVESTIGACIÓN
Cristales y Precipitados Formados
La realización de las pruebas discontinuas sirvió para la identificación de las especies que logran cristalizar durante cada etapa de evaporación de las dos muestras de agua de mina AAM(1) y AAM(2), mediante difracción de Rayos X.
En ambas muestras, los precipitados de las primeras evaporaciones (25%, 50%), se constituyen inicialmente de cristales aciculares de yeso CaSO4:2H2O recubiertos por precipitados ferruginosos en forma de costras y geles compuestos de jarosita KFe3(SO4)2(OH)6, hidroniojarosita H2Fe3(SO4)2(OH)7, pequeñas cantidades de natrojarosita NaFe3(SO4)2(OH)6 y goethita (-FeOOH). A evaporaciones
mayores (>75%), aparecen finalmente cristales cúbicos de cloruro de sodio NaCl incrustados en las costras. Además se produce la sobresaturación de la mirabilita Na2SO4:10H2O que no llega a cristalizar por evaporación. La cristalización de esta sal sólo es posible si la solución sufre un enfriamiento hasta una temperatura de -8 se, apareciendo cristales prismáticos que finalmente, después de ser filtrados pierden su agua de hidratación por eflorescencia hasta formar la sal anhidra thenardita Na2SO4.
Por otro lado, mediante el cálculo de los índices de saturación en los equilibrios, se pudo determinar qué otras especies alcanzan la sobresaturación siendo posible su precipitación, ya que las pequeñas cantidades que puedan aparecer en los cristales obtenidos, no son detectadas en el análisis por difracción. La resolución de los múltiples equilibrios y el cálculo de los índices de saturación fue realizado con ayuda del paquete para equilibrio geoquímico acuoso Visual MINTEQ versión 2.02.
De este análisis teórico, se ha determinado que en los cristales formados existe la presencia de anhidrita CaSO4, lepidocrocita -FeOOH, y una sal de hierro con fórmula Fe(OH)2.7Cl0.3. Se ha determinado además que existe sobresaturación de thenardita Na2SO4 a evaporaciones por encima del 85%; sin embargo, como ya se indicó su cristalización es sólo posible por deshidratación de la mirabilita, la cual se forma cuando la solución sufre un enfriamiento cercano a -10 ec, debido a que la segunda muestra de agua de mina AAM(2) tiene una mayor concentración en iones plomo, cristaliza anglesita PbSO4 durante la evaporación.
Porcentaje de Agua Evaporada
El cálculo de los índices de saturación (SI) fue efectuado para 88 especies sólidas; sin embargo, sólo se tomaron en cuenta para el análisis aquellas sales que sufren sobresaturación (SI > 0), o muestren un comportamiento donde su SI se aproxime a valores cercanos a la saturación (SI = 0).
A continuación se presentan los índices de saturación de 22 sales en las dos muestras de agua de mina, como función del porcentaje de agua evaporada.
El comportamiento del grupo de jarositas (figura 5) muestra que los índices de saturación para cada especie tienden a disminuir durante la evaporación. Esto se debe a que mientras la evaporación aumenta, la concentración del hierro como ión férrico Fe3+, va disminuyendo; del mismo modo, al disminuir el pH de la solución, el ión sulfato SO42- deja de ser estable, pasando a la forma de ión bisulfato HSO4-. Las reacciones que toman lugar son las siguientes:

En cada una de las cuatro reacciones anteriores existe la formación de iones H+, lo cual explica el descenso observado del pH en las soluciones durante la evaporación.
La figura 6, muestra que los índices de saturación de los sulfatos de calcio: anhidrita y yeso, tienden a aumentar hasta un máximo en el 50% de evaporación donde se obtiene la mayor cantidad de cristales de yeso; sin embargo, a evaporaciones mayores, la sobresaturación de estas sales comienza a disminuir debido a la disminución en la actividad de los iones Ca2+ y comienza la sobresaturación de los sulfatos de sodio, mirabilita y thenardita. A porcentajes de evaporación mayores a 85%, con valores de pH muy ácidos, la concentración del ión SO42- es muy baja, permitiendo que sea el ión cloruro Cl- más estable y reaccione con el sodio cristalizando la halita NaCl. Los demás iones se asocian de igual forma con el anión cloruro formando en la mayoría de los casos complejos acuosos que no llegan a cristalizar.
Las reacciones que toman lugar son las siguientes:

Las sales calcantita CuSO4.5H2O, cotunnita PbCl2, epsomita MgSO4.7H2O, goslarita ZnSO4.7H2O y melanterita Fe-SO4.7H2O, son incluidas en este análisis ya que su comportamiento muestra valores cercanos de saturación; pero aún así, el producto iónico de las actividades de los iones en solución, no llega a superar al producto de solubilidad.
Los equilibrios que se presentan en solución son los siguientes:

Los óxidos e hidróxidos de hierro, si bien al inicio se hallan con valores de sobresaturación, los valores de los índices de saturación van disminuyendo a medida que ocurre la evaporación, debido a la disminución del pH de la solución, y a que el ión férrico se asocia con los iones cloruro formando especies acuosas más estables, diminuyendo la concentración del ión Fe3+ libre.
Las reacciones que toman lugar para la sobresaturación de este grupo de compuestos se muestran a continuación:

Termodinámicamente estas reacciones pueden ocurrir; sin embargo, desde el punto de vista cinético, la formación de Fe2O3 y Fe3O4, es demasiado lenta a estas temperaturas, por lo que su formación no es posible.
Temperatura
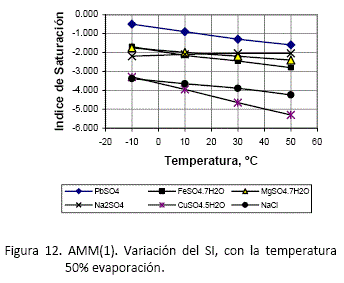
El efecto que la variación de temperaturas en las soluciones evaporadas al 50% se muestra a continuación en las siguientes gráficas, siendo agrupadas nuevamente las especies que muestran un comportamiento similar.
El comportamiento mostrado en las gráficas se puede explicar, analizando la variación de las constantes de equilibrio de las reacciones de precipitación, calculadas a diferentes temperaturas (tabla 3). Se puede ver que existen en general dos comportamientos en las reacciones. Los sulfatos y cloruros tienden a ser más solubles conforme el aumento de la temperatura, lo cual también se hace evidente analizando las curvas de solubilidad. Por otro lado, están los óxidos y sales de hierro, cuyas constantes de equilibrio aumentan conforme al aumento de temperatura, siendo entonces su precipitación favorecida a temperaturas elevadas.
Evaporación Continua
Estas pruebas fueron realizadas para determinar el efecto que tiene la adición permanente de agua de mina a la solución que se encuentra evaporando. Inicialmente las primeras adiciones diluyen las concentraciones de los componentes, bajando su índice de saturación; sin embargo, una vez que la solución se evapora y se va saturando en cada uno de sus componentes, la adición de agua de mina aumenta ligeramente la sobresaturación de cada especie por efecto del ión común. Finalmente la formación de sales precipitadas es mayor, siendo los componentes mayoritarios las sales ya descritas en las pruebas discontinuas. Su comportamiento se halla representado en las figuras 13 a 15, donde nuevamente se observa el comportamiento similar que tienen las sales de hierro, y por otro lado el comportamiento de las sales de calcio, plomo y sodio. También se han representado las sales cuyo índice de saturación se incrementa pero sin llegar a la sobresaturación que les permita precipitar de la solución.
Estas pruebas también sirvieron para la condensación del vapor lo cual permitió su análisis, revelando que sólo el agua es el componente que se evapora, puesto que mediciones de pH dieron un valor de 5.5 7 y la conductividad eléctrica medida fue de 107 microsiemens/cm. Estos valores excluyen completamente cualquier componente que haya podido volatilizar conjuntamente con el vapor de agua.
Tamaño de Lagunas y Sólidos Precipitados
Debido a que la expulsión diaria de casi 800 m3 de agua ácida de mina sin tratamiento, la cual tiene un costo de bombeo que llega a 240,000 $us/año, COMIBOL decidió sellar todas las perforaciones posibles que sirvieron para la exploración de vetas en los niveles más profundos y que son actualmente fuentes de infiltración del agua subterránea a la mina. De tener éxito este trabajo, COMIBOL optará por inundar la mina en forma controlada por niveles y con permanente monitoreo.
La inundación se realizaría hasta alcanzar primeramente el nivel -340, para luego continuar hasta el nivel -150. En este caso se estima que el caudal de bombeo se reduciría hasta un 25% del volumen actual, siendo aún necesario enviar estas aguas contaminadas hasta una laguna de evaporación.
La tabla 4, muestra el área y volumen requeridos en la laguna de evaporación, considerando el caudal de bombeo máximo registrado en las auditorías ambientales, el caudal promedio actual y el caudal que resultaría en caso de llevarse a cabo la inundación controlada de la mina (estimado a reducirse al 25% del caudal actual). Se utilizó valores de precipitación anual de 504.50 mm y evaporación media anual de 1,685.70 mm.
A partir de los resultados obtenidos en este estudio, se ha podido estimar la cantidad de sales y sólidos que se puedan formar en función del volumen de agua de mina retenida en la laguna y el porcentaje de evaporación.
La acumulación de estos precipitados sólidos en el fondo de la laguna, hará necesaria su disposición final, siendo una alternativa dejarlos en su lugar para el cierre definitivo de la laguna.
Por otro lado, investigaciones realizadas en desmontes mineros a diferentes profundidades, revelan la presencia de capas de sólidos, producto de la evaporación interna del drenaje ácido de roca DAR, que actúan como aislantes de oxígeno (hard pan) evitando oxidaciones de sulfuros a mayores profundidades.
Debido a que la naturaleza de los precipitados corresponde principalmente a dos formaciones: sulfatos de baja solubilidad y compuestos ferruginosos insolubles, la estabilidad de estos permitiría su empleo como material de recubrimiento de desmontes mineros para evitar la difusión de oxígeno hacia el material sulfuroso, previniendo la formación de drenajes ácidos por agua superficial.
6. CONCLUSIONES
De los resultados obtenidos y su análisis, se obtienen las siguientes conclusiones finales:
Las aguas ácidas de la mina San José, dada su composición, son consideradas soluciones las cuales pueden ser tratadas por las variables que controlan los procesos de cristalización, con el objeto de precipitar las sales disueltas.
Los iones metálicos se hallan presentes en el agua de mina inicialmente asociados con los aniones sulfato SO42-, estando ya algunas sales en estado de sobresaturación, principalmente sales de calcio, hierro, sodio y plomo; siendo posible su precipitación por evaporación.
Como producto de la evaporación de las aguas ácidas de mina, se obtienen sales cristalizadas compuestas principalmente por tres tipos de formaciones:
Sulfatos de baja solubilidad: cristales aciculares de yeso CaSO4.2H2O y precipitados pulverulentos de anglesita PbSO4, cuando se tiene una concentración de plomo mayor a 25 mg/l.
Precipitados ferruginosos de color ocre amarillento: costras y geles de jarosita KFe3(SO4)2-(OH)6, hidroniojarosita H2Fe3(SO4)2(OH)7, natrojarosita NaFe3(SO4)2(OH)6, goethita -FeOOH, pequeñas cantidades de Fe(OH)2.7Cl0.3 y Fe(OH)3.
Cristales cúbicos de cloruro de sodio NaCl.
La temperatura tiene un muy ligero efecto sobre la cristalización de sales del agua de mina. Un incremento de temperatura durante la evaporación favorece a la precipitación de las sales y óxidos hidratados de hierro. Sin embargo, la solubilidad de los sulfatos es ligeramente mayor siendo menor su cristalización.
Si bien termodinámicamente es posible la formación de óxidos de hierro hematita, Fe2O3, maghemita Fe2O3 y magnetita Fe3O4, cinéticamente es demasiado lenta, por lo que su precipitación no puede ocurrir bajo las condiciones estudiadas. Es posible en todo caso la hidrólisis de estos óxidos formando goethita e hidróxido férrico
Las soluciones evaporadas hasta un 75% son sobresa-turadas con respecto a la sal mirabilita Na2SO4.10H2O. Un descenso en la temperatura hasta aproximadamente -8 -C, induce a la cristalización de esta sal, apareciendo cristales prismáticos los cuales al ser expuestos al aire sufren una deshidratación formando la sal anhidra thenardita Na2SO4; por lo tanto, el enfriamiento es el único medio de separar sulfatos de sodio.
Los iones Cd, Cu, Fe2+, Mg, Zn son prácticamente imposible de eliminar. Cd, Cu y Zn, se hallan formando complejos acuosos con el anión Cl-, siendo las especies más estables conforme aumenta el porcentaje de evaporación. Los iones Fe2+ y Mg, forman los pares iónicos respectivos con el anión SO42-, siendo las especies acuosas más estables, a medida que la evaporación es mayor, sin llegar a cristalizar como sulfatos.
El ión Pb, pese a tener una mayor tendencia a formar complejos clorurados acuosos, es posible ser eliminado de la solución como el sulfato insoluble anglesita PbSO4, durante las primeras evaporaciones.
El ión Fe3+ puede ser eliminado de la solución mediante la evaporación en forma de jarositas y óxidos hidratados; sin embargo, su precipitación no es total ya que conforme aumenta la evaporación, tiende a formar complejos acuosos estables con el anión Cl-.
El ión potasio K, es únicamente removido de la solución al ser precipitado en forma de jarosita. Por otro lado, el ión sodio sí es eliminado de las solución tanto como sulfato por enfriamiento y como cloruro por evaporación.
A medida que la evaporación aumenta en la solución el pH de la misma baja hasta valores muy ácidos, por efecto de las reacciones de precipitación de óxidos y jarositas de hierro. De este modo el ión sulfato deja de ser la especie estable SO42- pasando a la forma de ión bisulfato HSO4-. Por otro lado la actividad del ión Cl- incrementa con el aumento del % de evaporación, aumentando la concentración de las especies cloruradas acuosas de los iones metálicos.
Las soluciones saturadas son las responsables para que se dé el proceso de cristalización. Es por lo tanto posible la precipitación continua de sólidos por evaporación y con alimentación permanente de agua de mina fresca a estas soluciones.
Considerando la elevada radiación solar de nuestra región, la construcción de lagunas de evaporación se constituye en la alternativa pasiva más adecuada, para detener el actual daño al medio ambiente por bombeo de aguas ácidas de mina sin tratamiento alguno.
7. BIBLIOGRAFÍA
1. Dames & Moore Norge. "Feasibility and Design Study for trie Remediation of Sources of Contamination", San Jose Mine. Subproject N2 6, Progress Report. Oruro, november-1999. [ Links ]
2. Proyecto Piloto Oruro. "Evaluación de la Contaminación de Ríos y Lagos". Oruro-1996. [ Links ]
3. COMIBOL. "Acciones de Remediación Ambiental en la Mina San José. Proyecto de Medio Ambiente, Industria y Minería". Oruro-2000. [ Links ]
4. Richards, I. G., Palmer, J. P. Y Barrat, P. A. "The Reclamation of Former Coal Mines and Steelworks". Elsevier Science Publishers B. V. The Netherlands, 1993. [ Links ]
5. Ramírez, J. A. "Tratamiento de Aguas de Mina en Sistemas Pasivos". Información obtenida de Internet. [ Links ]
6. MDE-VMM-Unidad Sectorial de Medio Ambiente. "Guía Ambiental para el Manejo de Aguas en Actividades Minero-Metalúrgicas". La Paz-2001. [ Links ]
7. Formación y Manejo del Drenaje Ácido de Mina. Información obtenida de Internet. [ Links ]
8. Guzmán, S. 1st Environmental Workshop 1996, on Managing Acid Rock Drainage. Universidad Técnica de Oruro - Carrera de Metalurgia, 1996. [ Links ]
9. COMIBOL - División de Medio Ambiente. "Características Hidrogeológicas del Yacimiento de San José -Oruro". La Paz-1998. [ Links ]
10. Ministerio de Desarrollo Sostenible y Planificación. Reglamentos a la Ley del Medio Ambiente. Programa de Manejo Integrado del Medio Ambiente en la Pequeña Minería. La Paz-1996. [ Links ]
11. Mccabe, W. L. y SMITH, J. C. "Operaciones Básicas de Ingeniería Química". Volumen II. Editorial Reverte. Barcelona, 1980. [ Links ]
12. Otero De La Gándara, J. L. "Operaciones de Separación en Metalurgia Extractiva". Ed. Alhambra. España. [ Links ]
13. Habashi, F. A "Textbook of Hydrometallurgy". Metallurgie Extractive. Québec, Canadá. [ Links ]
14. Destro, J. Crystal Formation. http://www.rpi.edu/-deptchem-eng/Biotech-Environ/.htm" [ Links ]
15. Foust, A. S. et al. "Principios de Operaciones Unitarias". Compañía Editorial Continental, S.A. México, 1998 [ Links ]
16. Perry, R. H., Green, D. W. y Maloney, J. O. "Perry's Chemical Engineers' Handbook". McGraw-Hill. USA, 1999. [ Links ]
17. Butler, J. N. "lonic Equilibrium: A Mathematical Approach". Addison - Wesley. USA, 1964. [ Links ]
18. Fischer, R. B. y Peters, D. G. "Chemical Equilibrium". W. B. Saunders Company. USA, 1970. [ Links ]
19. Mineral Thermodinamic Properties. http://www-.science.ubc.ca/~geol323/thermo/robtoc.htm [ Links ]
20. Coulson and Richardson. "Chemical Engineering". Volume II. Pergamon Press. London, 1955 [ Links ]
21. Hounslow, A. W. Water Quality Data: Analysis and Interpretation. Lewis Publishers. New York, 1995. [ Links ]
22. Zamora, G. MET - 3321 Hidrometalurgia II, Apuntes de Cátedra. UTO-FNI, 1998. [ Links ]
23. Garrels, R. M. Y Christ, C. L. "Solutions, Minerals, and Equilibria". Harper & Row. New York, 1965. [ Links ]