Services on Demand
Article
Indicators
Related links
 Cited by SciELO
Cited by SciELO
 Similars in SciELO
Similars in SciELO
Bookmark
Revista Metalúrgica UTO
Print version ISSN 2078-5593
Rev. Met. UTO no.23 Oruro May 2002
ARTÍCULOS ORIGINALES
Tratamiento de minerales de Niobio y Tantalio con alto contenido de Uranio
Ing. Nélida Vilaseca Berrios* Dr. Ing. Gerardo Zamora E. ** Ing. Antonio Cárdenas***
* SPECTROLAB
**Carrera de Ingeniería Metalúrgica y Ciencia de Materiales
***Carrera de Ingeniería de Procesos Químicos
Universidad Técnica de Oruro
Resumen
Los concentrados procedentes de la zona del precámbrico cruceño se caracterizan por sus elevados contenidos de uranio y thorio, lo que dificulta su explotación y comercialización por sobrepasar los límites permisibles de radiación.
En esta investigación se han realizado una serie de pruebas de lixiviación oxidante a objeto de "limpiar" el uranio de minerales de tantalio y niobio, y facilitar su comercialización y transporte.
Se han estudiado alternativas de oxidación con diferentes agentes oxidantes; sin embargo, de los resultados obtenidos se demuestra que la oxidación con Fe+3 - bacterial es la más efectiva, alcanzándose eliminar los elementos radiactivos hasta en un 86% del mineral estudiado.
1. Introducción
Emergente del alza del precio del tantalio en el mercado internacional, se ha generado un inusitado interés tanto en la explotación como en la comercialización de minerales y concentrados de este metal procedentes de la zona del precámbrico boliviano, ubicado en el departamento de Santa Cruz.
El contenido mínimo de tantalio en los minerales o concentrados que permite su exitosa comercialización es de 40%. Por lo general, el mineral de tantalita o el concentrado enriquecido en tantalio, arrastra consigo la presencia de las impurezas radioactivas de uranio y thorio, las que superan el límite permisible de radioactividad de 12 Imp/s.
El alto costo del transporte, debido a la característica especial de empaque y manipuleo que requiere este tipo de material, hace necesario la implementación de una etapa de eliminación de uranio y thorio de estos materiales, previo a su exportación.
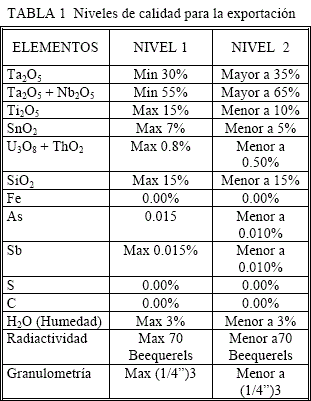
Actualmente la calidad de exportación de los óxidos de Ta2O5 estipulan los niveles mostrados en la tabla 1.
El alto grado de diseminación de los minerales de uranio y thorio en el mineral y/o concentrado, descarta la aplicación de procesos de concentración gravimétrica, por lo que la eliminación de los mismos por procesos hidrometalúrgicos, se constituye en la alternativa más adecuada.
2. Lixiviación ácida de óxidos de uranio
El ácido sulfúrico es el reactivo más comúnmente usado en la práctica industrial para la lixiviación de óxidos de uranio.
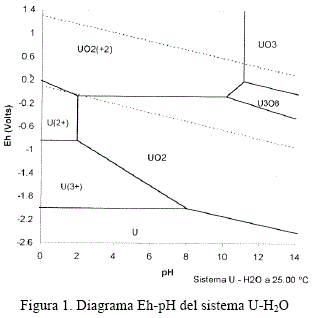
El fundamento teórico de la lixiviación puede ser mejor entendido mediante el diagrama Eh-pH del sistema uranio-H2O presentado en la figura 1, que establece que es termodinámicamente posible la disolución de uraninita (UO2) por cualquiera de los siguientes tipos de reacción:
Disolución química
![]()
Disolución oxidante
![]()
Disolución reductora
![]()
Este diagrama indica que el UO2 puede ser disuelto en medio ácido en presencia de un oxidante, mientras que el UO3 es soluble en medio ácido; y si el uranio no se encuentra oxidado, se requiere un alto potencial de oxidación para el acomplejamiento a ion uranilo.
En el caso de la pechblenda (U3O8), la siguiente ecuación muestra que sólo es posible su disolución oxidante según la reacción anódica de disolución:
![]()
El mecanismo de oxidación de los óxidos de uranio a su estado de oxidación de VI, puede estar representado por las siguientes reacciones:
![]()
La disolución en medio ácido del óxido formado está representada por:
![]()
El catión uranilo, ![]() en presencia del ion sulfato, forma sulfato de uranilo y sus complejos, según las reacciones siguientes:
en presencia del ion sulfato, forma sulfato de uranilo y sus complejos, según las reacciones siguientes:
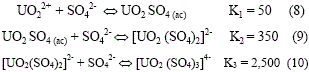
Por tanto, a mayores concentraciones de ![]() en la solución, la especie estable es la del sulfato de uranilo
en la solución, la especie estable es la del sulfato de uranilo ![]()
Generalmente, para la disolución de óxidos de uranio son utilizados MnO2 y FeCl3 como agentes de oxidación. El ion férrico es la especie en solución que es responsable directo para la reacción de oxidación, que se forma de acuerdo a la reacción siguiente:
![]()
La presencia de Fe+2 obedece a la disolución de minerales oxidados de hierro.
El ion Fe3+ generado, permite la disolución de los óxidos de uranio en su estado de oxidación de VI, según la reacción global siguiente:
![]()
El ion ferroso formado, es reoxidado por el oxidante O2, MnO2, o FeCl3 a hierro férrico para la oxidación posterior.
![]()
3. Aguas ácidas como agentes de bioxidación
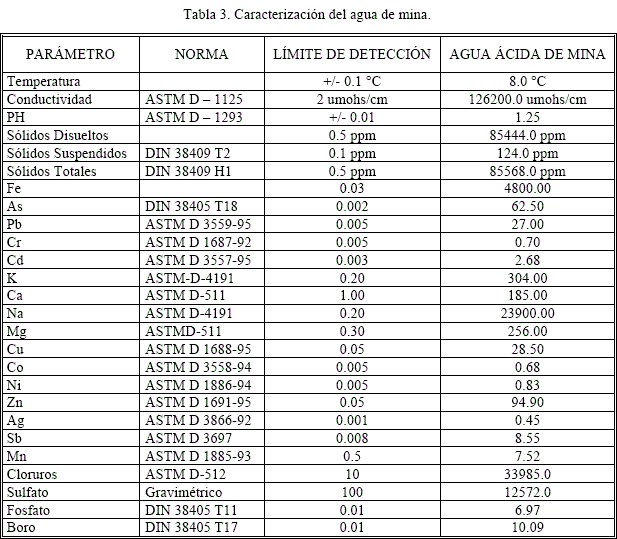
Las aguas ácidas de mina, formadas como un proceso natural de oxidación de minerales sulfurados y catalizado por microorganismos del género thiobacillus, ocurren de acuerdo a la siguiente reacción general:
![]()
Estas aguas, denominadas en nuestro medio como "aguas de copajira", constituyen hoy en día una de las principales fuentes de contaminación del medio ambiente en varias regiones mineras de nuestro país, debido a la presencia de una serie de metales pesados disueltos y a su carácter fuertemente ácido.
La biooxidación, considerada como un proceso de oxidación bioquímica que es catalizada por microorganismos, se constituye en una alternativa interesante para la eliminación de U y Th de minerales con contenidos de Nb y Ta.
Ciertas especies del género thiobacillus aceleran el proceso de oxidación del ion ferroso a férrico para captar energía requerida para la síntesis y el mantenimiento de la célula. Por otra parte, de acuerdo a la reacción 12, la disolución de minerales oxidados de uranio, se ve también favorecida.
3.1 Factores que influyen sobre la actividad bacterial
La actividad metabólica de los microorganismos, incluidos en la disolución de óxidos de uranio presentes en minerales de Nb y Ta, es afectada considerablemente por factores físicos y químicos, entre los que podemos mencionar:
Temperatura. La temperatura óptima para las bacterias thiobacillus ferrooxidans, por ser mesofílicas, está en el rango de 25 a 40 °C. Para la oxidación del ion ferroso se trabaja normalmente con temperaturas entre 28 a 40 °C.
pH. La oxidación biológica del ion ferroso incluye movimientos de hidrógeno así como de electrones; por lo tanto, el pH tiene un efecto definido sobre el metabolismo de las bacterias.
La influencia del pH sobre la actividad del thiobacillus ferrooxidans ha sido ampliamente investigada y se comprobó que la bacteria es más activa en el rango de pH de 1 a 3; inhibiéndose su reproducción a pH menor a 1 y mayor a 3.
Nutrientes. El thiobacillus ferrooxidans sintetiza sus materiales celulares a partir de fuentes inorgánicas que son: dióxido de carbono (como fuente de carbón para el crecimiento de la célula), sulfato de amonio, sulfato ácido de potasio (como fuente de nitrógeno y fosfato); cloruro de potasio, sulfato de magnesio y nitrato de calcio (como factores de crecimiento).
La investigación del efecto de la concentración de nutrientes sobre la actividad bacterial, mostró que la importancia de la presencia de componentes esenciales para el crecimiento bacterial. Por ejemplo, la concentración de sulfato de amonio controla el rendimiento y el fosfato ácido de potasio controla la velocidad de crecimiento.
CO2 y O2. La actividad de la bacteria thiobacillus ferrooxidans depende directamente del CO2 como fuente de carbón necesario para su crecimiento y de oxigeno para efectuar sus ciclos de oxidación. Al incrementar el contenido de CO2 del aire, se estimuló el crecimiento del thiobacillus ferrooxidans.
Con respecto al oxígeno, no existen muchos datos disponibles sobre el valor óptimo de la concentración de O2; sin embargo, es recomendable una aireación intensiva.
4. Procedimiento experimental
4.1 Materiales
La muestra empleada para realizar las pruebas experimentales, procede del precámbrico cruceño. Está compuesta por Ixiolita (Ta,Fe,Sn,Nb,Mn)O2, cuarzo y en menor proporción por hematita Fe2O3 y pirocloro (Na,Ca,U)2(Nb,Ta)2 O6
La radioactividad de la muestra fue medida con un contador Geiger GKAETZ X5 y tiene un valor de 32.8 I/s.
El peso específico real de la muestra es de 6.04 g/cm3. Fue determinado por el método del picnómetro con una fracción representativa de la muestra molida en seco a 100% -80 micrómetros.
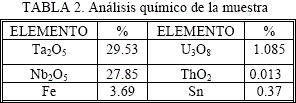
Los análisis químicos de la muestra se realizaron tanto en Spectrolab como en los laboratorios del Instituto de Mineralogía y Geoquímica de la Universidad de Freiberg-Alemania, y muestran la siguiente composición:
En la tabla 3, se muestran las características químicas y fisicoquímicas del agua de mina de San José, a partir de las cuales se obtuvieron los cultivos respectivos para las pruebas de bioxidación.
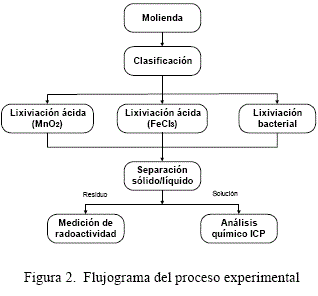
4.2 Flujograma experimental
Se ha estudiado el efecto de las siguientes variables sobre la lixiviación ácida del uranio:
- Concentración de H2SO4
- Granulometría
- Temperatura
utilizando los agentes oxidantes, MnO2, FeCl3, y oxidación bacterial.
Después de pruebas preliminares se han obtenido los tiempos del proceso de lixiviación diferenciado para cada agente oxidante, como sigue:
- MnO2: tiempo de proceso 24 horas
- FeCl3: tiempo de proceso 4 horas
- Bacterial: tiempo de proceso 2 horas
El proceso experimental seguido en la investigación en laboratorio se desarrolló de acuerdo al siguiente esquema:
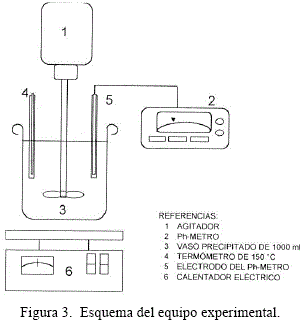
Para la realización de las pruebas experimentales se utilizó un equipo experimental a escala laboratorio de acuerdo al siguiente esquema:
5. Resultados
5.1 Efecto de la concentración de H2SO4
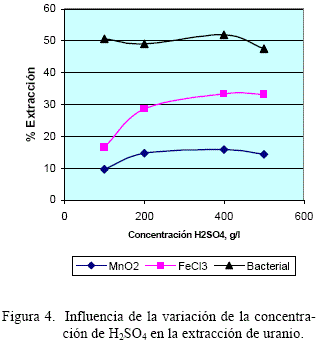
La dependencia del grado de extracción de uranio en función de la concentración de H2SO4 se muestra en la figura 4. Para los tres agentes oxidantes, se observa un relativo e insignificante incremento del grado de extracción cuando aumenta la concentración de H2SO4 en el rango de 100 a 500 gr/l. Esta tendencia es algo mayor para el agente oxidante FeCl3.
Por otra parte se observa que el efecto de la extracción de uranio del mineral es mayor, si se utiliza como agente oxidante de Fe3+ como resultado de la oxidación bacterial.
Haciendo un análisis por separado se puede observar que para el caso del agente oxidante MnO2 adicionado en una concentración estequiométrica genera, de acuerdo a la reacción (11), iones Fe3+ a partir de la oxidación de iones de Fe2+ resultado de la lixiviación de mineral de hierro presente en el mineral de tantalita.
Esta dependencia de generación del ion Fe3+ es insuficiente para lograr un alto grado de oxidación del U02 para su correspondiente lixiviación con el H2S04. Figura 4. Influencia de la variación de la concentración de H2SO4 en la extracción de uranio.
Por otra parte, si bien en el diagrama Eh-pH del sistema Mn - H2O la línea que separa las fases Mn++ y MnO2 tiene una orientación de tal forma que cuando aumenta la concentración de H2SO4, el potencial electroquímico de la reacción entre estas dos fases se hace más positivo, y la reducción del MnO2 a Mn2+ es más favorecida y por tanto prevalece aún mas la formación de Fe+3; La cinética de esta reacción es lenta y depende de la presencia de Fe+2 en la solución
Para el caso del agente oxidante FeCl3, los resultados muestran que una cantidad estequiométrica doble de este agente oxidante lleva a una oxidación de UO2 a ![]() . El incremento de la concentración de H2SO4, favorece la estabilidad del complejo
. El incremento de la concentración de H2SO4, favorece la estabilidad del complejo ![]() de acuerdo a las reacciones (8) a (10), por lo que para este caso parecen ser necesarias concentraciones aún mayores de FeCl3.
de acuerdo a las reacciones (8) a (10), por lo que para este caso parecen ser necesarias concentraciones aún mayores de FeCl3.
Finalmente, para el caso de la aplicación de Fe+3 -bacterial en la disolución de UO2, se establece que concentraciones mayores a 100 g/l de H2SO4 no favorecen a obtener una mayor disolución. Por el contrario, elevadas concentraciones generan ambientes tan fuertemente ácidos que inhiben la actividad bacterial.
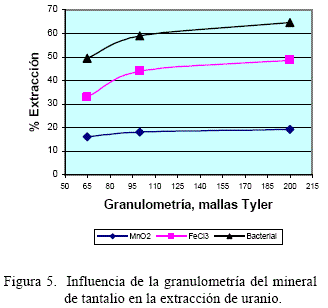
5.2 Efecto de la granulometría del mineral
Los resultados del estudio de la dependencia del grado de extracción de uranio en función de la granulometría son presentados en la figura 5. Para los tres agentes oxidantes utilizados, la tendencia es de un incremento del grado de extracción del uranio cuando disminuye el tamaño de grano de la muestra estudiada.
Este comportamiento ratifica la teoría en el sentido de que a menor tamaño de grano, se tiene una mayor superficie de contacto entre los cationes de Fe3+ y el óxido de uranio del mineral de tantalita.
Las mayores extracciones de uranio fueron obtenidas a - 200 mallas Tyler.
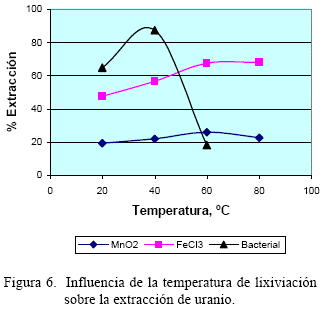
5.3 Efecto de la temperatura
Los resultados obtenidos en el estudio de la dependencia del grado de extracción de uranio en función de la temperatura, son representados en la figura 6.
Cuando se incrementa la temperatura de la solución lixiviante, mejora el grado de extracción de uranio con los tres agentes oxidantes estudiados.
Para el caso del agente oxidante MnO2 el grado de extracción sigue siendo menor en relación a los otros agentes oxidantes, y el efecto del aumento de la temperatura no es significante. Esto demuestra que la variable de mayor importancia es la concentración del ión ferroso en la solución.
Para el caso del agente oxidante FeCl3 se observa que el efecto del incremento de la temperatura permite elevar el grado de extracción de uranio aproximadamente de 47 a 68% en el rango de temperatura de 20 a 80 °C, demuestra que a mayor temperatura la cinética de disolución es favorecida.
El incremento de la temperatura utilizando el cultivo bacterial tiene sus limitaciones, puesto que a temperaturas por encima de 40 °C, la actividad del género thiobacillus ferroxidans es nula; por lo que la extracción de uranio empieza a disminuir.
Además, es importante recalcar que de acuerdo a la reacción (12), la disolución de UO2 en presencia de Fe+3 genera Fe+2, que a su vez es oxidado por las bacterias favoreciendo así la "regeneración" permanente del agente oxidante y por tanto dando lugar a una mejor extracción del uranio.
6. Conclusiones
Del trabajo de investigación realizado es posible establecer las siguientes conclusiones:
La mayoría de los minerales y/o concentrados, procedentes del oriente boliviano, con altos contenidos de tantalio presentan en su composición concentraciones elevadas de uranio y thorio que dificultan su comercialización por su alta radioactividad.
Los compuestos de uranio y thorio presentes en estos materiales están finamente diseminados en la estructura del material, por lo que el proceso de lixiviación ácida, en presencia de agentes oxidantes, se constituye en la alternativa más adecuada; descartándose su eliminación por procesos gravimétricos de concentración.
La lixiviación ácida en presencia de MnO2, como agente oxidante, no permite obtener un material comerciable, exento de castigo por contaminación en uranio, pues es posible sólo alcanzar apenas un 25.80 % de extracción bajo las condiciones más adecuadas de lixiviación.
El FeCl3, como agente de oxidación en la lixiviación ácida, permite obtener mejores extracciones de uranio a las obtenidas con MnO2; sin embargo, los residuos de la lixiviación todavía presentan rangos de concentración en uranio por encima de los permisibles para su exportación.
La oxidación con Fe3+ - bacterial, se constituye en la mejor alternativa de eliminación del uranio. Se han logrado extracciones de uranio de hasta 87% . Con lo que la radioactividad del producto lixiviado ha disminuido a niveles inferiores de 12 Imp/s, valor exigido por las leyes internacionales.
Se ha establecido una correlación lineal entre los resultados de análisis químico de uranio y thorio, obtenidos en el equipo de plasma (ICP-AES), y los determinados en el equipo de pulsaciones radioactivas Geiger. Esto implica que para un análisis semi-cuantitativo del contenido de uranio de muestras sólidas se puede rápidamente determinar mediante el contador Geiger.
7. Referencias
1. Crawford E. and James Paone. Facts concerning Uranium exploration and production United States 1958. [ Links ]
2. Habashi F. Extractive Metallurgy, Vol II, Hidrometallurgy, Gordon and Breach, Science Publishers,N.Y. 1969. [ Links ]
3. Haung H.L. Twidwel and J. Miller. Hidrometalurgia, Tomo II, traducido del inglés por L. Chia Aquije, impreso en el Perú, 1982. [ Links ]
4. Hurburt Dana: Manual de Mineralogía, Ed. Reverté, Argentina 1960. [ Links ]
5. Jackson E. Hydrometallurgical Extraction and Reclamation Press: A division of John Wulley and Sons, England, 1986. [ Links ]
6. Misari Ch F. "Tecnología de la Lixiviación Bacteriana de Minerales" 1ra Ed. Perú. 1984. [ Links ]
7. Oliver D. J. Effect of heavy metals on the ferrous iron oxidizing ability of thiobacillus ferrooxidans, marzo 1996. [ Links ]
8. Peters E.: Hidrometalurgia. Lixiviación de metales, óxidos y sulfuros. 1972. [ Links ]
9. Pourbaix M.: Atlas electrochemical equilibria in aqueous solutions. 1986. [ Links ]
10. Revista Hidrometalúrgica de Química Industrial Vol. 18, junio 1987. [ Links ]
11. Revista Hidrometalúrgica, Vol. 21, mayo 1989. [ Links ]
12. Rivas Salomón: "Los minerales de Bolivia y sus parajes" Tomo II Santa Cruz-Bolivia. 1998. [ Links ]
13. Standard Test Method for Columbium and Tantalum in Ores and Concentrates Involving Ion Exchange. ASTM 1988. [ Links ]
14. The Geology and Mineral resources of the Bolivian Precambrian British Geological Survey. London Her Majesties Stationary office. 1989. [ Links ]
15. Ullman Fritz, Enciclopedia de Química Industrial. [ Links ]
16. Zamora E. G. "Bioxidación de minerales refractarios de Au y Ag, como alternativa de pretratamiento" Tesis de grado- FNI- Metalurgia. 1990. [ Links ]