Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista de Investigación e Información en Salud
versión impresa ISSN 2075-6194
Rev. Inv. Inf. Salud v.12 n.29 Cochabamba 2017
ARTÍCULO CIENTÍFICO
PRODUCCIÓN DE BACTERIOCINAS POR BACTERIAS HALÓFILAS Y HALOTELERANTES DE LA LAGUNA CHAIRKOTA, POTOSÍ - BOLIVIA
BACTEORICIN PRODUCTION BY HALOPHILIC AND HALOTOLERANT BACTERIA FROM LAKE CHAIRKOTA, POTOSÍ - BOLIVIA
Lic. Paola V. Ayala Borda 1.
Dra. Virginia A. Vargas Calle 2.
Ing. Jerry L. Solis Valdivia 3.
1. Licenciada en Biología. Investigadora Júnior. Centro de Biotecnología, Universidad Mayor de San Simón, paola.ayala@gmail.com
2. Doctora en Biología Molecular. Docente Investigadora del Centro de Biotecnología, Universidad Mayor de San Simón, vargasvirginia@hotmail.com
3. Ingeniero Químico. Doctorando del Centro de Biotecnología, Universidad Mayor de San Simón, jelusov2012@gmail.com
Fecha de recepción: 31/01/17 Fecha de aprobación: 10/03/17
Resumen
En las últimas décadas se ha estudiado extensamente la capacidad de las bacterias halófilas de producir sustancias de interés biotecnológico. El Centro de Biotecnología de la Universidad Mayor de San Simón cuenta con un banco de microorganismos halófilos aislados del altiplano boliviano, de los cuales se seleccionó 71 cepas halófilas y halo tolerantes de la Laguna Chairkota para analizar su capacidad de producción de sustancias antibióticas o bacteriocinas. Se realizó un screening de las cepas en medio de cultivo sólido, utilizando la técnica de la doble capa, y se encontró 14 cepas capaces de producir bacteriocinas. Posteriormente se seleccionó a la cepa halo tolerante CH20 como mejor productora que al ser secuenciada, analizada filogenéticamente y caracterizada morfológica y bioquímicamente. Se encontró que pertenece a la especie Staphylococcus equorum, especie descrita en bibliografía, aislada de medios con alto contenido de sal. Se denominó a la cepa identificada como Staphylococcus equorum CH20. Esta investigación demuestra la capacidad biotecnológica de los microorganismos halófilos. Especialmente el potencial que tienen las cepas aisladas del altiplano boliviano, las cuales pueden ser utilizadas en un futuro como alternativa a los antibióticos comúnmente comercializados.
Palabras clave: Bacterias halófilas. Bacteriocinas. Staphylococcus equorum. Altiplano boliviano.
Abstract
Duríng the last decades, the ability of halophilic bacteria to produce substances of biotechnological interest has been extensively studied. The Center of Biotechnology of the University Mayor de San Simón holds a collection of halophilic microorganisms isolated form the Bolivian Altiplano, from which 71 halophilic and halotolerant strains form Lake Chairkota were chosen to study their capacity to produce antibiotic substances or bacteriocins. A screening of the strains was made on solid media, using a double layer technique and 14 strains were found to produce bacteriocins. Furthermore, the halotolerant strain CH20 was the best bacteriocin producer and was chosen to be sequenced, analyzed phylogenetically, characterized morphologically and biochemically and it was identified as Staphylococcus equorum, which was previously described in the literature, isolated from high salt containing environments. The identified strain was named Staphylocouccus equorum CH20. This research demonstrates the biotechnological potential of halophilic microorganisms especially that of strains isolated from Bolivian Altiplano, which can be used in the future as an alternative to commonly commercialized antibiotics.
Keywords: Halophilic bacteria. Bacteriocins. Staphylococcus equorum. Bolivian Altiplano.
INTRODUCCIÓN
Los microorganismos extremo filos han llamado la atención para su aislamiento y su explotación biotecnológica por su conocida capacidad de proliferar en ambientes en los cuáles la mayoría de los organismos vivos no puede sobrevivir; por tanto, las sustancias producidas por estos microorganismos tienen características similares a las de su cepa productora (1).
Las bacteriocinas son proteínas o péptidos sintetizados en el ribosoma, con capacidades antimicrobianas, que difieren de los antibióticos tradicionales en un punto crítico, tienen un espectro de acción relativamente estrecho e inhiben el crecimiento de bacterias estrechamente relacionadas e incluso a cepas diferentes dentro de la misma especie (2, 3,4).
Muchos de estos péptidos muestran una actividad impresionante contra bacterias que son resistentes a los antibióticos convencionales. El desarrollar estas sustancias antibióticas para ponerlas a disposición de la población no solo aumenta el número de medicamentos disponibles en farmacias, sino que le da un tiempo de uso más largo, haciendo que la resistencia a antibióticos se retrase (2, 5).
En éste estudio se describe el screening para la detección de producción de bacteriocinas de 71 cepas bacterianas halófilas y halo tolerantes aisladas de la laguna Chairkota de Potosí, Bolivia, del Centro de Biotecnología de la Universidad Mayor de San Simón. Además de la caracterización morfológica, bioquímica y taxonómica de la mejor cepa productora.
MATERIALES Y MÉTODOS
Producción de bacteriocinas
Para determinar la actividad antimicrobiana se utilizó una prueba de antagonismo mediante la técnica de la doble capa, la cual consiste en colocar una capa de 20 mi de agar sólido HM o QM (6), según el medio de aislamiento de la cepa, y una sobre capa de 5 mi de agar semisólido Brain Heart Infusión (BHI) en placas Petri. Se inoculó la sobre capa con 500 ul de un caldo de la cepa indicadora: Staphylococcus aureus con 108 UFC.ml-1 en medio BHI (7).
Una vez solidificados los medios, se transfirió una colonia de la cepa halófila o halo tolerante con 24 horas de crecimiento a la sobre capa por punción. Como control positivo se utilizó 4 ul de ampicilina (100ug.ml-1)(7).
Se realizó esta prueba para cada microorganismo en el medio correspondiente para la productora (HM o QM), sin NaCI para los microorganismos halo tolerantes, y con 5% de NaCI para los halófilos (7).
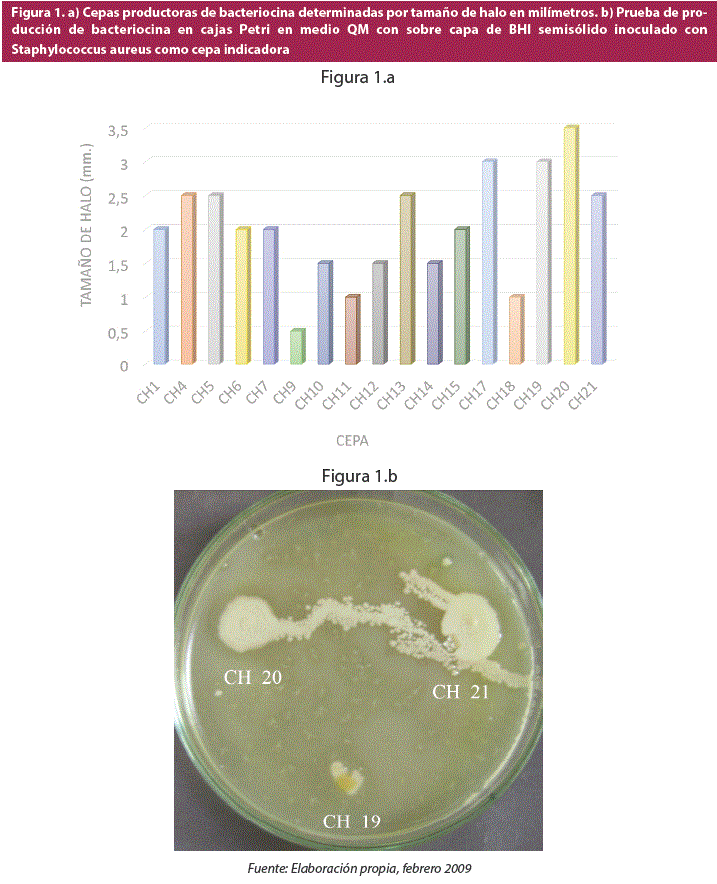
Se dejó incubar las cajas Petri por un periodo entre 24 y 48 horas a 30° C. Las bacterias que presentaron un halo transparente alrededor de la colonia se consideraron como cepas productoras de sustancias antimicrobianas o bacteriocinas (7).
Finalmente, dado que las colonias presentaron crecimiento irregular, se midió el halo desde el borde de la colonia hasta el borde del halo de inhibición.
Secuenciación del gen 16S rDNA y construcción del árbol filogenético
La extracción de ADN bacteriano y secuenciación del gen 16S rDNA fueron llevadas a cabo en los laboratorios de Bio Basic Inc en Canadá a partir de muestras bacterianas frescas, cultivadas en medio sólido e incubadas por una noche.
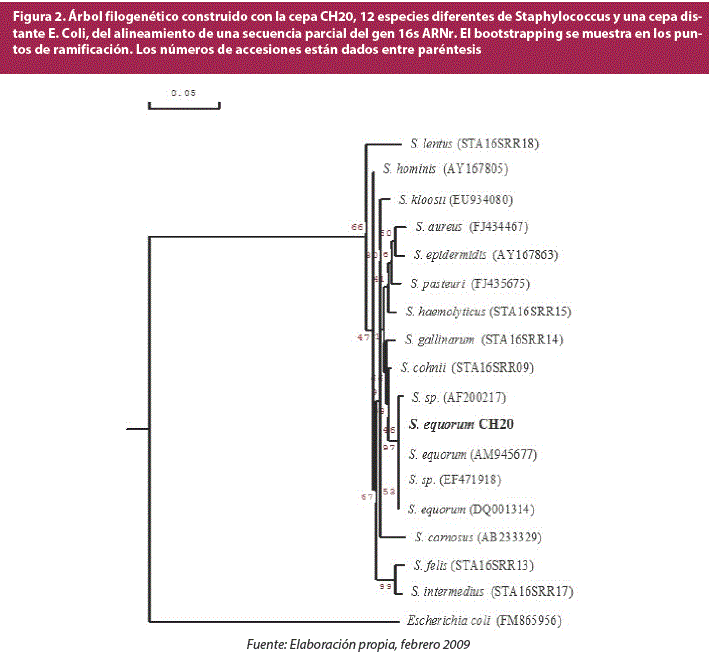
Finalmente, se realizó un análisis filogenético de las cepas secuenciadas con ayuda de los programas de computación Chromas y DNAMAN y se construyó un árbol filogenético con cepas conocidas para determinar la ubicación de la cepa seleccionada.
Caracterización y pruebas bioquímicas
Inicialmente, se cultivó a la cepa seleccionada en el medio utilizado en el aislamiento para describir a la colonia y posteriormente realizar una tinción Gram para describir la morfología celular. A continuación, se realizó un análisis de las condiciones óptimas de crecimiento de la cepa, variando la concentración de NaCI (0 a 10 %), pH (5 a 11) y temperatura (12 °C a 50
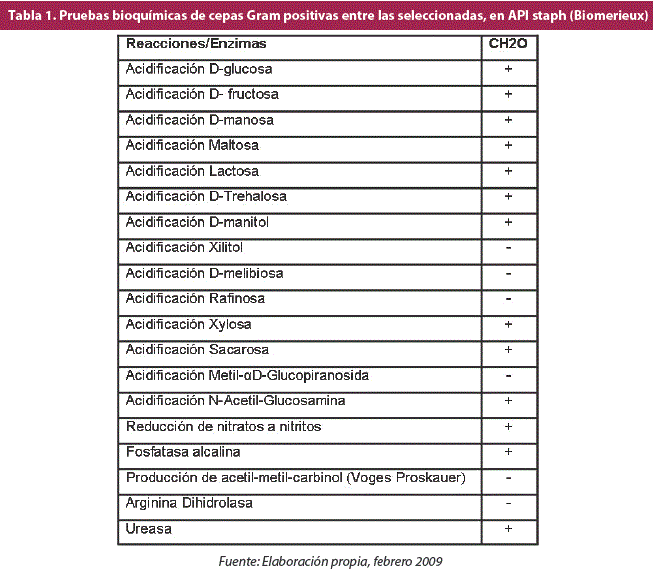
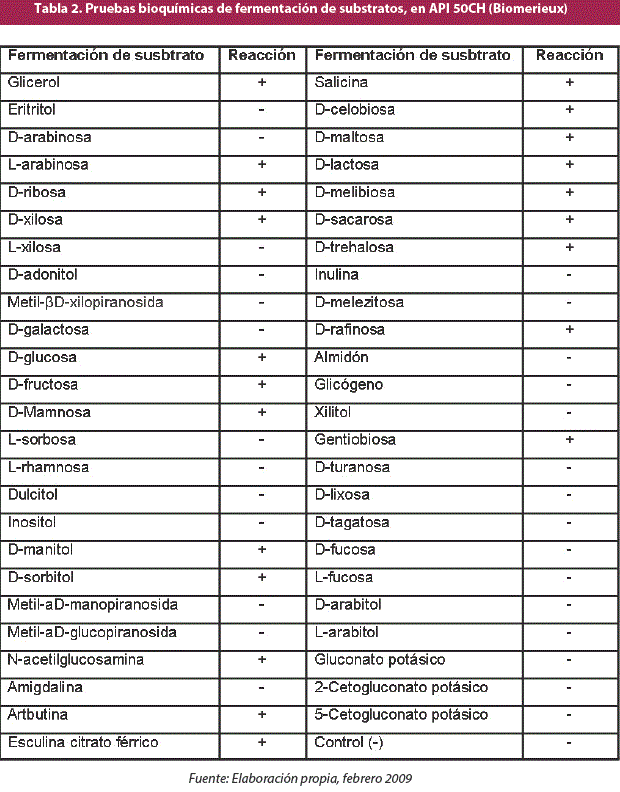
Se realizaron las pruebas bioquímicas correspondientes para identificar a la cepa seleccionada, según la coloración Gram, utilizando las tiras de pruebas bioquímicas API staph (Biomeriéux) para bacterias Gram positivas. Por último, se determinó el metabolismo de carbohidratos utilizando las batería de pruebas bioquímicas API 50CH para la determinación de fermentación de carbohidratos (Biomeriéux).
RESULTADOS
Se encontró un total de 14 cepas productoras de bacteriocinas, solo en medio QM: CH1, CH4, CH5, CH7,CH9,CH10,CH11,CH12,CH13,CH14,CH15,CH17,CH18,CH19,CH20y CH21 (figura 1a),de las cuáles la cepa CH20 presentó el mayor halo de inhibición con 3.5 mm (figura 1b) y por tanto fue seleccionada para ser identificada y caracterizada bioquímicamente.
Árbol filogenético
La cepa CH20 presenta una secuencia de 1261 nucleótidos, la cual fue comparada con la base de datos del GenBanky dio un 100% de similitud con la especie Staphylococcusequorum. En la construcción del árbol filogenético se halló un 99.92% de similitud con la cepa Staphylococcusequorum (DQ001314), por tanto, se denominó a la cepa CH20 como Staphylococcus equorum CH20 (figura 2).
Caracterización y pruebas bioquímicas
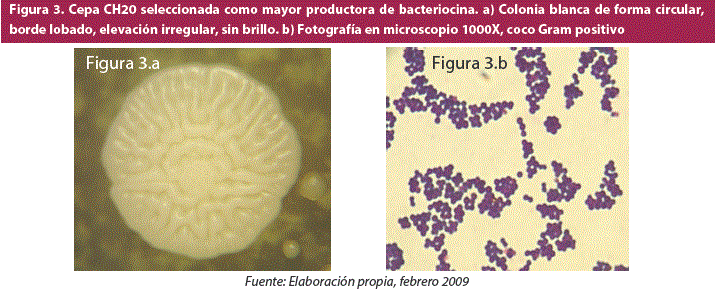
Se describió a la colonia de la cepa S. equorum CH20 (figura 3a) que es de color blanca, circular, con borde lobado, con una elevación irregular, mostrando muchas arrugas en la superficie, sin brillo. De igual manera se describió la forma celular mediante una tinción Gram, donde se pudo ver al microscopio que la cepa es un coco Gram positivo (Figura 3b).
A continuación, las pruebas de variación de NaCI, pH y temperatura en el medio dieron como resultado que las condiciones de crecimiento óptimas de la cepa CH20 son de 0% de NaCI, pH 8 y 17 °C.
Se realizó una caracterización bioquímica de la cepa S. equorum CH20 con el uso de las pruebas bioquímicas de Biomerieux.
DISCUSIÓN
Al realizar el screening de las cepas halófilas y halo tolerantes aisladas del altiplano boliviano, se encontró 14 cepas capaces de producir sustancias antimicrobianas o bacteriocinas, entre las cuales las cepas CH18 y CH19 son halófilas y el resto son cepas halo tolerantes, todas aisladas en medio QM.
En la bibliografía se ha descrito la producción y purificación de bacteriocinas de diferentes cepas halófilas con potencial biotecnológico a partir de diferentes orígenes: océanos, lagos hipersalinos y alimentos (8, 9; 10,11).
La posibilidad de usar sustancias de bacterias halófilas en procesos industriales tiene la ventaja que éstas presentan actividad óptima en altas concentraciones de sal. El interés de estas enzimas yace tanto en su potencial biotecnológico para nuevas aplicaciones, como en la necesidad de un mejor entendimiento de sus propiedades intrínsecas de resistencia a la sal y sus mecanismos de estabilización que permiten a las enzimas extracelulares de halófilos a tener actividad en ambientes extremos en los que estos microorganismos generalmente viven (12).
Mediante el análisis de la secuencia 16SrDNAsepudo determinar que la cepa CH20, identificada como mejor productora del grupo, pertenece a la especie Staphylococcus equorum, cuya caracterización bioquímica confirmó los resultados comparados con la bibliografía que describe a la especie.
La cepa Staphylococcus equorum CH20 dio negativo solamente a las pruebas de acidificación de xilitol, D-melibiosa, rafinosa, metil-a-D-glucopiranosida, Voges Proskauer y arginina dihidrolasa, resultados que coinciden tanto con Nováková y colaboradores (13), así como con Sadfi-Zouaoui y colaboradores; (14) por tanto, se confirma que la cepa CH20 pertenece a la especie Staphylococcus equorum (Tabla 1).
La caracterización de la cepa Staphylococcus equorum CH20 presenta condiciones de crecimiento óptimas de 0 % de NaCI, pH 8 y 17 °C. Según Nováková y colaboradores (13) el Staphylococcus equorum crece preferiblemente a 30 °C, a diferencia de Staphylococcus equorum CH20 que crece muy bien a 30 °C, pero presenta un mayor crecimiento a 17 °C, lo cual tiene que ver con el ambiente del cual fue aislada, al ser la Laguna Chairkota una laguna del altiplano que atraviesa por cambios bruscos de temperatura a lo largo del día.
Las cepas de Staphylococcus equorum que coinciden con Staphylococcus equorum CH20 fueron aisladas en otros trabajos de diferentes fuentes, como muestras clínicas, queso, muestras marinas y suelos hiper-salinos (15,16, 13); así también se han realizado estudios sobre su capacidad de producir bacteriocinas y sus aplicaciones en la industria alimenticia como inhibidor de contaminantes o patógenos: moho, Listeria monocytogenes o Plasmodium falciparum (16, 17, 14).
El aumento y la difusión rápida de patógenos bacterianos multiresistentes obliga a considerar métodos alternativos para combatir las infecciones. Dado el amplio espectro, y ya que los antibióticos son usados con frecuencia, resulta en una presión de selección muy fuerte para la evolución de resistencia a antibióticos en bacterias tanto patógenas como comensales. Aunque hay varias alternativas para solucionar éste problema, las bacteriocinas son una de las alternativas más atrayentes, por su relativamente estrecho espectro de acción, pueden ser consideradas "drogas diseñadas" con un blanco a patógenos bacterianos específicos. Muchos de estos péptidos muestran una actividad impresionante contra bacterias que son resistentes a los antibióticos convencionales. Ésto no solo aumenta el número de medicamentos disponibles en farmacias, si no que le da un tiempo de uso más largo, haciendo que la resistencia a antibióticos se retrase (2, 5).
Existen también bacteriocinas producidas por bacterias acidolácticas, utilizadas para la preservación de alimentos en la producción de alimentos fermentados. Debido a que las bacterias acidolácticas han sido utilizadas por siglos en alimentos fermentados, son consideradas como seguras (GRAS) por la FDA (Food and Drug Administration) de Estados Unidos. Esto permite su uso en alimentos fermentados sin aprobación regulatoria adicional (2,18,19,4). Dentro de este grupo también se clasificó a las cepas de Staphylococcus equorum como cepas seguras para la alimentación (16).
CONCLUSIONES
Se encontró 14 cepas bacterianas, entre halófilas y halotolerantes, que presentan actividad antimicrobiana de las 71 cepas que fueron aisladas de la Laguna Chairkota del altiplano boliviano.
La cepa CH20 fue seleccionada para ser identificada y caracterizada, por registrar los halos de inhibición más grandes en la prueba de antagonismo.
Mediante la secuenciación del gen 16S rDNA y las pruebas bioquímicas se determinó y confirmó que la cepa CH20 corresponde a la especie Staphylococcus equorum y fue denominada S. equorum CH20.
Se demostró que las cepas halófilas y halotolerantes del banco de microorganismos del Centro de Biotecnología tienen la capacidad de producir sustancias antibióticas, demostrando así el potencial biotecnológico de las mismas para ser usadas en el futuro como alternativa a los antibióticos comercializados comúnmente.
RECOMENDACIONES
• Se recomienda estudiar el modo de acción, la secuencia de aminoácidos, las características genéticas y los mecanismos de biosíntesis de la bacteriocina producida por la cepa Staphylococcus equorum CH20.
• Realizar pruebas de antagonismo con diferentes cepas para determinar el rango de acción de la bacteriocina.
• Finalmente, se recomienda caracterizar e identificar al resto de las cepas que presentaron una capacidad de producir bacteriocinas.
AGRADECIMIENTOS
Al Centro de Biotecnología de la Universidad Mayor de San Simón y a la Cooperación Sueca (ASDI-SAREC), quienes dieron apoyo financiando el estudio y proveyendo el material y los ambientes necesarios, sin los cuales este trabajo no hubiera sido posible.
REFERENCIAS BIBLIOGRÁFICAS
1. VAN DEN BURG, B. Extremophiles as a sourcefor novel enzymes. Current Opinión in Microbiology. 2003.6: 213-218. [ Links ]
2. RILEY, M. A. AND WERTZ, J. E. Bacteriocin diversity: ecological and evolutionary perspectives. Biochimie. 2002.84:357-64. [ Links ]
3. JACK R. W., TAGG, J. R. AND RAY, B. Bacteriocins of Gram- positive bacteria. Microbiol Rev. 1995. 59:171 - 200. [ Links ]
4. CHEN, H. AND HOOVER, D. G. Bacteriocins and their Food Applications. Comprehensive Reviews in Food Science and Food Safety. 2003. 2: 82- 100. [ Links ]
5. MOLL, G.N., KONINGS, W. N. and DRIESSEN, A. J. M. Bacteriocins: mechanism of membrane insertion and pore formation. Antonie van Leeuwenhoek. 1999. 76:185 - 198. [ Links ]
6. QUILLAGUAMÁN J., DELGADO, O., MATTIASSON, B. AND HATTI-KAUL, R. Chromohalobacter sarecensis sp. nov., a psychrotolerant moderate halophile isolated from the saline Andean región of Bolivia. International Journal of Systematic and Evolutionary Microbiology. 2004.54:1921 - 1926. [ Links ]
7. ARAGAO, R. Actividad antimicrobiana de bacterias halófilas y halotolerantes del altiplano boliviano. Tesis de grado para obtener el Diploma Académico de Licenciatura en Biología. Universidad Mayor de San Simón. Cochabamba - Bolivia. 2006. [ Links ]
8. ATANASOVA, N.S., PIETILÁ, M. K. AND OKSANEN, H.M. Diverse antimicrobial interactions of halophilic archaea and bacteria extended over geographical distances and cross the domain barrier. Microbiology Open. 2013. 2(5): 811 - 825. [ Links ]
9. AZEMIN, A., KLAPPA, P. AND OMAR, M.S.S. Bacteriocin isolated from Halomonas sp.: a bacterial DING protein? The Malaysian Journal of Analytical Sciences. 2015.19(4): 831 -840. [ Links ]
10. BISCOLA, V., TODOROV, S.D., CAPUANO, V.S.C., ABRIOUEL, H., GÁLVEZ, A. AND FRANCO, B.D.G.M. Isolation and characterization of a nisin-like bacteriocin produced by a Lactococcus lactis strain isolated from charqui, a Brazilian fermented, salted and dried meat product. Meat Science. 2013.93: 607 - 613. [ Links ]
11. JEONG, D.W., HAN, S. AND LEE, J.H. Safety and technological characterization of Staphylococcus equorum isolates from jeotgal, a Korean high-salt-fermented seafood, for starter development. International Journal of Food Microbiology. 2014.188:108- 115. [ Links ]
12. SÁNCHEZ-PORRO, C, MELLADO, E., BERTOLDO, C, ANTRANIKIAN G. AND VENTOSA, A. Screening and characterization of the protease CP1 produced by the moderately halophilic bacterium Pseudoalteromonas sp. Strain CP76. Extremophiles. 2003. 7: 221 - 228. [ Links ]
13. NOVÁKOVÁ, D., SEDLÁCEK, I., PANTUCEK, R., STETINA, V., SVEC, P. AND PETRÁS, P. Staphylococcus equorum and Staphylococcus succinus isolated from human clinical specimen. Journal of medical Microbiology. 2006. 55: 523 - 528. [ Links ]
14. SADFI-ZOUAOUI, N., ESSGHAIER, B., HAJLAOUI, M. R., FARDEAU, M. L, CAYAOL, J. L, OLLIVIER, B. AND BOUDABOUS, A. Ability of Moderately Halophilic Bacteria to Control Grey Mould Disease on Tomato Fruits. Journal of Phytopathology. 2008.156:42 - 52. [ Links ]
15. ANAND, T. P., BHAT, A. W., SHOUCHE, Y. S., ROY, U., SIDDHARTH, J. AND SARMA, S. P. Antimicrobial activity of marine bacteria associated with sponges from the waters of the coast of South East India. Microbiological Research. 2006.161 (3): 252 - 262. [ Links ]
16. CARNIO, M. C, HOLTZEL, A., RUDOLF, M., HENLE, T., JUNG, G. AND SCHERER, S. The Macrocyclic Peptide Antibiotic Micrococcin P1 is Secreted by the Food-Borne Bacterium Staphylococcus equorum WS 2733 and Inhibits Listeria monocytogenes on Soft Cheese. 2000.66(6): 2378-2384.
17. CARNIO, M. C, STACHELHAUS, T., FRANCIS, K. P. AND SCHERER, S. Pyridinil polythiazole class peptide antibiotic micrococcin P1, secreted by foodborne Staphylococcus equorum WS2733, is biosynthesized nonribosomally. Eur. J. Biochem. 2001.286:6390 - 6400. [ Links ]
18. KHOUITI, Z. AND SIMÓN, J. P. Detection and partial characterization of a bacteriocin produced by Carnobacterium piscicola 213. Journal of Industrial Microbiology & Biotechnology. 1997.19: 28 - 33. [ Links ]
19. JACK, R., WAN, J., GORDON, J., HARMARK, K., DAVIDSON, B. E., HILLIER, A. J., WETTENHALL, R. E. H., HICKEY, M. W. AND COVENTRY, M. J. Characterization of the Chemical and Antimicrobial Properties of Piscicolin 126, a Bacteriocin Produced by Carnobacterium piscicola JG126. Applied and Environmental Microbiology. 1996.62(8): 2897 - 2903. [ Links ]