Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista de Enfermedades Infecciosas y Tropicales
versión impresa ISSN 2074-4625
Rev. enferm. infecc. trop. v.1 n.1 Santa Cruz 2009
ARTICULOS ORIGINALES
Tentativa de cultivo in vitro del agente que produce la Lobomicosis
Rommel Gutiérrez
Servicio de Laboratorio Clínico. Clínica Médica Gonzales. Villa 1ro de Mayo, avenida Principal esquina calle 7. Santa Cruz de la Sierra, Bolivia
RESUMEN
Se prepararon una serie de medios para cultivar a Lacazia loboi. Los complejos [Cu(CN)4]3- y CuY2- se adicionaron a ciertos medios para conferirles un potencial electroquímico. En otros medios se agregó L-DOPA y en otros medios se agregaron los complejos de cobre y la L-DOPA. Células de L. loboi provenientes de un boliviano con lobomicosis fueron inoculadas en todos los medios de cultivo. El potencial de los medios se cuantificó mediante un potenciómetro conectado a electrodos de Pt y de Ag/AgCl. Se aislaron cinco hongos contaminantes (un Aspergillus versicolor, dos Mucor sp. y otros dos no identificados). L. loboi no se cultivó en ninguno de los medios analizados, se considera que este es un parásito obligatorio que no se desarrolla en medios de cultivo inertes. El potencial de los medios cuya única variable fue las concentraciones de los complejos de cobre, experimentó mínimas variaciones. Pero en los medios con dos variables -las concentraciones de los complejos y la concentración de L-DOPA-, sus potenciales inicialmente disminuyeron y posteriormente se incrementaron. Además en estos medios se observó la presencia de un pigmento negruzco, que era soluble en KOH e insoluble en HCl. La prueba de Thormählen fue positiva en dichos medios. Por estas evidencias se concluye que el [Cu(CN)4]3- y el CuY2- catalizan la oxidación de L-DOPA a dopaquinona, la cual sufre modificaciones que culminan en la formación de eumelanina.
INTRODUCCIÓN
La lobomicosis es una enfermedad fúngica subcutánea, producida por el microbio levaduriforme cuya nomenclatura es una controversia, que tiende a la aceptación del binomio Lacazia loboi21. Lobo describió por primera vez en 1930, la enfermedad en Brasil8. Recacoechea & Vargas fueron los primeros en documentar en 1982, un caso de lobomicosis en Bolivia16.
Varios medios de cultivo se emplearon infructuosamente para cultivar a L. loboi. El mismo Lobo inoculó agar Sabouraud con tejido proveniente del primer enfermo descrito por él21. Carneiro et al, citados por Lacaz et al 11, utilizaron agar Sabouraud al que incorporaron aceite de maní. El agar con infusión de cerebro y corazón fue empleado por Vanbreuseghem et al23. Herr et al introdujeron tejido con lobomicosis en agar Sabouraud y agar sangre8. Sampaio informó que cultivó al hongo en el medio 199, el cual también contenía fitohemaglutinina (una lecitina vegetal), suero fetal bovino, penicilina y anfotericina B. Pero este autor utilizó en su experimento tejido que muy probablemente no contenía hongos viables; además no reprodujo la enfermedad inoculando en animales las células de L. loboi supuestamente cultivadas y así no cumplió uno de los postulados de Koch. Su afirmación, de que ninguna razón especial lo llevó a usar el medio indicado, es sorprendente17.
Se conoce que el cultivo de los hongos dimórficos es influenciado por factores como la concentración de CO2, la temperatura, el potencial electroquímico y los nutrientes. Particularmente el desarrollo de Histoplasma capsulatum como levadura, es favorecido por la cisteína un agente reductor que modifica el potencial redox. Su grupo sulfhidrilo durante la transición de micelio a levadura de H. capsulatum, estimula la actividad de la cadena de transporte de electrones que se halla casi paralizada y así favorece que la transformación a levadura prosiga. Por el contrario cuando se aplica al hongo ácido p-cloromercurifenilsulfónico, que se une al sulfhidrilo e inhibe sus propiedades redox, el cambio de micelio a levadura no ocurre13. Koneman et al10 afirman que el potencial redox del tejido humano normal es 150 mV, pero Brooks et al2 indican que es 120 mV.
Las paredes celulares de ciertos hongos poseen melanina. Estos sintetizan el pigmento a través de por lo menos dos rutas metabólicas. En una de ellas participa el precursor 1,8-dihidroxinaftaleno y se denomina vía de los pentacétidos. En la segunda vía la substancia de partida es un orto o para hidroxifenol, por ejemplo la 3,4-dihidroxi-L-fenilalanina o L-DOPA (9, 15; véase la fig. 5). El medio CN screen contiene 0,02% de L-DOPA y se emplea para cultivar e identificar a Cryptococcus neoformans3. Las melaninas de los hongos aumentan su capacidad de sobrevivencia, favorecen su virulencia y los protegen de los oxidantes producidos por las células del sistema inmunológico. La tinción histoquímica de Fontana-Masson reveló que la pared celular de L. loboi contiene melanina20.
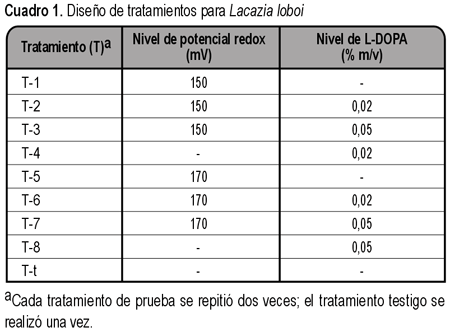
Para obtener el cultivo de L. loboi se prepararon medios con una o dos variables: una de ellas confiere un potencial electroquímico mediante los complejos [Cu(CN)4]3- y [Cu(EDTA)]2- (CuY2-) que originan el par redox Cu+- Cu2+ y la otra utiliza L-DOPA como precursor de la melanina.
MATERIALES Y MÉTODOS
El estudio se ejecutó en las Unidades Funcionales de Micología y Serología del Centro Nacional de Enfermedades Tropicales (CENETROP) y en el Laboratorio de Fitoquímica de la Universidad Autónoma "Gabriel René Moreno".
Caso clínico y muestra. Se extirparon dos lesiones nodulares del brazo y antebrazo izquierdos, de un varón de 80 años, que padecía una lobomicosis polimórfica y diseminada y procedía de Riberalta, Beni. La muestra se introdujo en solución fisiológica estéril, fue refrigerada con hielo seco y aerotransportada a Santa Cruz el mismo día de su recolección. Se trituró la muestra en un homogeneizador de tejidos esterilizado y fue mezclándose con solución fisiológica estéril. Se examinó directamente esta suspensión en un microscopio de luz blanca. Una porción de la muestra se estudió histopatológicamente y se usó la tinción del ácido peryódico de Schiff.
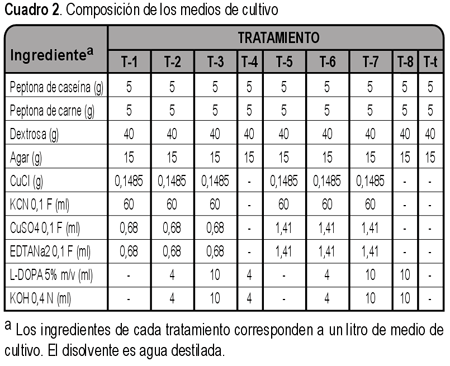
Medios de cultivo. Los ingredientes básicos de todos los medios fueron los del agar Sabouraud dextrosado (ver cuadro 2). El potencial redox de los medios o tratamientos (T) 1, 2, 3, 5, 6 y 7, fue modificado por el par Cu+- Cu2+ cuyo potencial de electrodo es Eº = 150 mV (5), dichos cationes procedían del CuCl y CuSO4. Se realizaron pruebas previas para solubilizar al CuCl, con HCl, CH3CH2OH, NH3, NH4OH, sin embargo fue complejado con KCN y el CuSO4 se complejó con EDTANa2. Los equilibrios originados por los complejos formados son:

Después de ensayar varias concentraciones, se decidió emplear las concentraciones iniciales de CuCl 1,5x10-3 F, KCN 6x10-3 F y CuSO4 y EDTANa2 6,82x10-5 F para producir el potencial 150 mV. Las concentraciones iniciales de CuCl 1,5x10-3 F, KCN 6x10-3 F y CuSO4 y EDTANa2 1,41x10-4 F se usaron para alcanzar 170 mV. Se emplearon soluciones de KCN, CuSO4 y EDTANa2 0,1 F, que se diluyeron para la preparación de los medios correspondientes. Cada uno de los medios T-1, T-2, T-3, T-5, T-6 y T-7, se prepararon formando los complejos [Cu(CN)4]3- y CuY2- en recipientes separados, luego se reunieron, se adicionaron los componentes del agar Sabouraud, se completó el volumen con agua destilada y se esterilizó en autoclave a 121ºC durante 15 minutos. Sin embargo después del autoclavado, a T-2, T-3, T-6 y T-7, fue necesario agregarles otras substancias.
T-2, T-3, T-4, T-6, T-7 y T-8 poseían L-DOPA en concentraciones de 0,02 y 0,05% m/v. Para alcanzar estas concentraciones se usó una solución de L-DOPA al 5% m/v, disuelta en HCl 0,4 N. A fin de evitar la alteración del pH de los medios se añadió KOH 0,4 N. Las soluciones de L-DOPA y KOH se esterilizaron por medio de filtros de acetato de celulosa, de 0,2 µm. Luego de su esterilización T-2, T-3, T-4, T-6, T-7 y T-8 se mantuvieron fundidos a 50ºC y se adicionaron la L-DOPA y el KOH. Además de los medios que contenían las variables, se prepararon otros que solo poseían los ingredientes del agar Sabouraud, estos constituyen el tratamiento testigo (T-t). Se vertieron 20 mL de cada tipo de medio en cajas Petri de 10 cm de diámetro.
Se introdujo 0,5 a 1 mL del tejido homogeneizado en los medios correspondientes. Se suspendieron células de C. neoformans en solución fisiológica estéril y se inocularon en medios de control. Un conjunto de medios se incubó a 29ºC y otro conjunto a 37ºC. Se prepararon placas adicionales de T-1, T-2, T-3, T-5, T-6, T-7 y T-t, se colocaron 14 mL de estos medios en cajas Petri de 5,5 cm de diámetro y se incubaron a 29 y 37ºC, en ellos se estudió el comportamiento del potencial redox en función del tiempo.
Viabilidad y concentración fúngicas. La tinción fluorescente con diacetato de fluoresceína y bromuro de etidio, descrita por Vilani-Moreno & Opromolla24, fue empleada para determinar la viabilidad de L. loboi. Esta tinción requiere una solución preparada con NaCl 0,1454 F (0,85% m/v), Na2HPO4 0,04 F, NaH2PO4 0,017 F y agua destilada, su pH es 7,2. La concentración de levaduras se midió en una cámara de Neubauer, en la misma área donde se cuentan hematíes. El número hallado se multiplicó por 50.
Medida del potencial redox. Se realizó aplicando los procedimientos publicados por Seip & Evans19 y la American Society for Testing and Materials1. Se usó un electrodo de Pt y un electrodo de Ag/AgCl, ambos constituyen el instrumento SCHOTT-GERäTE Pt 42 A, el electrodo de Ag/AgCl contiene KCl 3 M y su potencial redox es 207 mV22. Los electrodos se conectaron a un medidor SCHOTT-GERäTE pH-Meter CG841. Para constatar el funcionamiento correcto de los electrodos se sumergieron en 3 soluciones de prueba SCHOTT-GERäTE L 4648 cuyos potenciales eran 220, 470 y 640 mV. Los valores medidos de estas soluciones se hallaban dentro de un rango de +/- 10 mV alrededor del valor dado por el fabricante.
Cada una de las placas cuyo voltaje correspondía medir se dividió en dos fracciones (fI y fII), cada fracción se colocó en un tubo de ensayo, luego se desmenuzó concienzudamente con bajalenguas. Se prepararon dos baños María de 29 y 37 ºC. Los tubos con medios incubados a 29 ºC se llevaron a un baño y aquellos incubados a 37 ºC se introdujeron en el otro baño. Se internaron los electrodos en todos los tubos. Se midieron sucesivamente las fracciones fI y fII del mismo tipo de medio, el voltaje de ambas no varió en más de 10 mV y se obtuvo un promedio.
Al voltaje medido por el potenciómetro (Eobs), se sumó 207, para obtener el potencial redox del medio de cultivo relativo al electrodo de hidrógeno (Eh), la unidad de los potenciales es mV: Eh = Eobs + 207.
Cultivo sobre portaobjetos. Se efectuó para identificar a los hongos que crecieron en algunos medios. Se utilizaron fragmentos de agar Sabouraud dextrosado. Se cubrió el fondo de las cajas Petri en las que estos se hallaban, con agua destilada estéril. Los subcultivos se mantuvieron a la temperatura del laboratorio. Su montaje se realizó al cabo de 14 días de incubación.
Criterios químicos para reconocer melaninas. Debido a resultados inesperados se realizaron pruebas para reconocer melaninas. Las eumelaninas característicamente son insolubles en ácidos fuertes y solubles en bases fuertes9. La prueba cualitativa de Thormählen permite identificarlas (dicho análisis contribuye al diagnóstico de la melanuria), su fundamento es que los precursores de las melaninas reducen el nitroferricianuro de sodio hasta ferrocianuro férrico. Se ha señalado que el 5,6-dihidroxiindol, ácido-5,6-dihidroxiindol-2-carboxílico, 5-hidroxi-6-metoxiindol y otras substancias causan una reacción de Thormählen positiva18.
Para las pruebas de solubilidad se prepararon los medios T-6 y T-7, la solución T-7 (a diferencia del medio T-7 no poseía los ingredientes del agar Sabouraud) y la solución T-7i (que no poseía agar Sabouraud, ni CuY2-). Los solventes empleados fueron KOH 3 N y HCl 3 N, 5 mL de solvente se mezcló con 1 g del medio sólido o 0,5 mL de solución. La solubilidad se estudió cuando los medios y las soluciones presentaban un color marrón negruzco (esto ocurrió varios días después de su preparación).
La prueba de Thormählen se practicó en los medios T-2 y T-3, las soluciones T-2 y T-3 (estas no contenían agar Sabouraud) y las soluciones T-3i y T-3ii (ambas no contenían agar Sabouraud, T-3i y T-3ii carecían de CuY2- y [Cu(CN)4]3- respectivamente). A 5 mL de medio (o solución) se adicionaron 6 gotas de Na2[Fe(CN)5NO] 5% m/v, luego 0,5 mL de NaOH 40% m/v, se mezcló, se introdujo en un baño de agua fría y se añadió CH3COOH 33% v/v hasta llevar el pH a la acidez (esto se constató con papel tornasol). La reacción es positiva si se observa un color verdoso o azulado. Esta prueba se ejecutó 2 horas después de la preparación de los medios y las soluciones.
RESULTADOS
Viabilidad y recuento de Lacazia loboi. La viabilidad de los hongos fue 18%. La concentración fue 5,5x102 levaduras/mL de suspensión. La suspensión observada directamente en el microscopio, se ve en la figura 1.
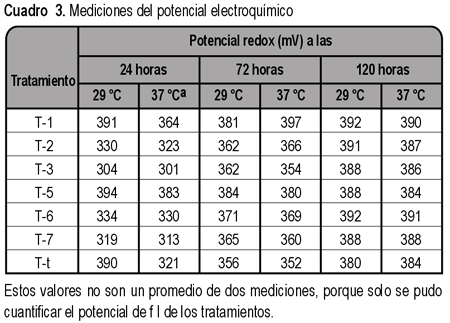
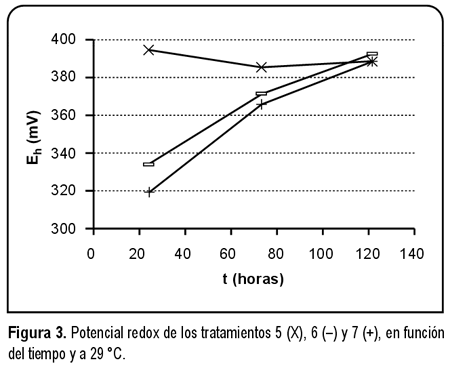
Inspección de los voltajes redox. Los potenciales de los medios T-1 y T-5, que contenían los complejos [Cu(CN)4]3- y CuY2-experimentaron mínimas variaciones. Por ejemplo los potenciales del medio T-5 a 29 ºC fueron 394 y 388 mV, cuando se midieron a las 24 y 120 horas respectivamente (ver cuadro 3 y fig. 3). Los voltajes de los medios T-2, T-3, T-6 y T-7, que poseían [Cu(CN)4]3- y CuY2- y también DOPA, sufrieron una reducción inicial de sus voltajes en confrontación con los medios T-1 y T-5. Después de esta reducción inicial ocurrió una oxidación. Por ejemplo el voltaje del medio T-6 a 29 ºC y a las 24 horas fue 334 mV, luego se elevó a 371 mV (a las 72 horas) y a 392 mV (a las 120 horas; ver cuadro 3 y fig. 3).
Examen macroscópico. En cinco placas inoculadas con L. loboi se observó el crecimiento de hongos filamentosos, las siguientes descripciones de sus colonias corresponden a los 48 días de incubación. En las demás placas no hubo desarrollo o, se produjo un crecimiento bacteriano.
T-129 (medio T-1 a 29 ºC). Colonia algodonosa, de bordes irregulares, blanca, ciertas áreas presentaban diminutos hundimientos. El reverso era café claro con varios plegamientos.
T-329. Colonia filamentosa, de bordes irregulares, poseía una región excéntrica donde confluían varios dobleces, esta era blanca y el resto de la colonia crema. El reverso era oscuro, con cinco plegamientos convergentes, semejantes a una estrella.
T-429. Colonia que cubría toda la superficie del medio, café oscuro, algodonosa, la altura de su micelio aéreo era homogénea como el césped bien recortado, ciertas regiones eran granulosas. El reverso era marrón.
T-637. Colonia glabra, granulosa, café negruzca, cubría toda la superficie del medio, poseía varios plegamientos convergentes. El reverso era café.
T-729. Colonia algodonosa, blanquecina, el desarrollo del micelio aéreo era limitado en algunas regiones y mayor en otras, sobre las últimas existían estructuras amarillentas como gotas de rocío. El color negro del medio dificultaba la observación del reverso.
En las placas donde se inoculó C. neoformans, se desarrollo esta levadura.
Examen microscópico. Del subcultivo sobre portaobjetos y del cultivo primario en placa.
T-129. Hifas gruesas y delgadas, hialinas y tabicadas, las hifas delgadas poseían clamidoconidios esféricos intercalares y terminales, en ciertas regiones las hifas gruesas y delgadas se enrollaban adoptando una disposición en espiral.
T-329. Largos conidióforos, tabicados y no tabicados, hialinos, sus extremos libres poseían vesículas esféricas, sobre toda la superficie de estas aparecían métulas, que sostenían a fiálides rectangulares, de las fiálides surgían fialoconidios no pigmentados formando cadenas.
T-429. Hifas aseptadas, hialinas, de donde nacían esporangióforos únicos o en pares, aseptados, hialinos, largos y cortos, su extremo distal poseía esporangios esféricos, que contenían esporangiosporas circulares, hialinas. No habían rizoides.
T-637. Filamentos gruesos, aseptados, hialinos, de ellos surgían esporangióforos, cuyos extremos libres llevaban esporangios, con esporangiosporas café oscuro, sus paredes eran lisas o equinuladas. No habían rizoides.
T-729. Hifas tabicadas, entrelazadas y ramificadas, en ciertas regiones su superficie presentaba diminutas estructuras claviformes. No se hallaron órganos asexuales.
Detección de melaninas. En los medios T-2, T-3, T-6 y T-7, donde se combinaron los complejos [Cu(CN)4]3- y CuY2- con la L-DOPA, se observó algo inesperado. La superficie y la porción subyacente a esta de dichos medios se colorearon de negro, posteriormente las porciones restantes de las placas también se tiñeron de negro. El pigmento de los medios T-6 y T-7 y las soluciones T-7 y T-7i, era soluble en KOH e insoluble en HCl (ver cuadro 4). La prueba de Thormählen fue positiva en los medios T-2 y T-3 y las soluciones T-2, T-3, T-3i y T-3ii (ver cuadro 5).
DISCUSIÓN
El tejido utilizado en este estudio, se recolectó del mismo enfermo que fue atendido por Recacoechea & Vargas en 198216. La baja viabilidad de los hongos presentes en él (de 18%), puede relacionarse con la lobomicosis crónica del enfermo, o sea en las lesiones antiguas se encontraría un pequeño número de hongos viables24. Debido a la necesidad de contar con un volumen de tejido homogeneizado suficiente para inocular 34 placas, se prepararon 30 mL de una suspensión cuya concentración de hongos era disminuida. L. loboi no se desarrolló en ninguno de los medios estudiados, aún cuando en todos ellos se inoculó la suspensión con una cantidad de hongos disminuida y en varios de ellos se implantaron fragmentos de tejido que poseían una cantidad extraordinaria de levaduras.
Los medios T-1 y T-5 experimentaron una pequeña variación de su potencial (ver cuadro 3 y figuras 2 y 3), en contraste con los demás tratamientos y con otros medios de cultivo. Cuando se estudiaron en anaerobiosis los agares Schaedler, con digesto tríptico de soja y Columbia, sus potenciales en un lapso de 1,67 horas se alteraron muy grandemente19. No se procuró modificar el voltaje de estos medios incorporando alguna substancia en sus estados oxidado y reducido. Pero a los medios T-1 y T-5 sí se añadió el par Cu+- Cu2+ y sus potenciales experimentaron mínimas variaciones durante un período de 120 horas. Sin embargo estos sobrepasaron los valores proyectados de 150 mV (para
T-1) y 170 mV (para T-5). Posiblemente las discrepancias entre los potenciales experimentales y los potenciales proyectados, se debieron a las bajas concentraciones de los agentes redox empleados. T-1 y T-5 poseían cantidades bajas de CuCl, CuSO4, KCN y EDTANa2, porque una cantidad elevada de KCN podría ser tóxica para L. loboi.
Se observaron dos alteraciones en el voltaje de los medios T-2, T-3, T-6 y T-7 (que poseían [Cu(CN)4]3- y CuY2- y también L-DOPA), inicialmente su voltaje se redujo en confrontación con T-1 y T-5 (que no contenían L-DOPA). Después ocurrió una oxidación (ver cuadro 3 y figuras 2 y 3). Estas alteraciones podrían entenderse así: la L-DOPA es capaz de disminuir el voltaje de un sistema y en presencia de [Cu(CN)4]3- y CuY2- sufre una oxidación, que se manifiesta en la elevación del potencial del medio de cultivo. Se ha indicado que los amortiguadores ácido-base más eficaces poseen concentraciones elevadas de un ácido y su base conjugada5, considerando las similitudes entre estos y los amortiguadores redox, es posible que las bajas concentraciones de Cu+ y Cu2+ fuesen insuficientes para imposibilitar que la L-DOPA disminuya el potencial. El aumento de voltaje a las 72 y 120 horas sugiere que la L-DOPA se oxidó por acción de [Cu(CN)4]3- y CuY2- y posiblemente oxidaciones espontáneas posteriores también contribuyeron a este aumento.
En las placas T-129 rI y T-729 rI se cultivaron hongos contaminantes no identificados, en la placa T-329 rI creció Aspergillus versicolor y en las placas T-429 rII y T-637 rI se desarrolló Mucor sp. La morfología de estos microorganismos, la ausencia de cultivos primarios repetidos de ellos y su crecimiento en agar Sabouraud cuando fueron subcultivados, indican que no son L. loboi. En el pasado también se intentó cultivar la levadura pero se cultivaron contaminantes como A. penicillioides, Sterigmatomyces halophilus entre otros6. Sobre la base de los resultados del presente estudio y de estudios previos, se considera que L. loboi es un parásito obligatorio que no se desarrolla en medios de cultivo inertes.
El pigmento negruzco que se desarrolló inesperadamente en los medios T-2, T-3, T-6 y T-7, era soluble en KOH e insoluble en HCl. La prueba de Thormählen empleada en dos de estos medios fue positiva. Tales evidencia sugieren que el pigmento era eumelanina. En los seres vivos la formación de eumelanina requiere que la L-DOPA -por acción de un catalizador- se oxide a dopaquinona12. A medida que la concentración de L-DOPA disminuye la concentración de dopaquinona se eleva, lo que ocasiona un incremento del potencial elctroquímico. Además es posible que otras oxidaciones espontáneas, de leucodopacromo a dopacromo y de ácido-5,6-dihidroxiindol-2-carboxílico a ácido indol-5,6-quinona-2-carboxílico, también contribuyeron a la elevación del potencial.
Los catalizadores implicados en la modificación de monofenoles y/o difenoles hasta compuestos pigmentados, son metaloenzimas que contienen cobre. Tal es el caso de la tirosinasa de mamíferos que hidroxila tirosina y oxida L DOPA, su sitio activo posee dos iones cobre que se reducen a Cu+ y oxidan a Cu2+ 12,14. La difenoloxidasa (o lacasa) de los hongos Polyporous versicolor y C. neoformans, oxida difenoles pero no monofenoles, además posee Cu+ y Cu2+ 4, 25. Las metaloenzimas con cobre son moléculas complejas, sin embargo compuestos de cobre más sencillos también catalizan la oxidación de fenoles, como ser CuCl disuelto en piridina o en 2-ona-N-metilpirrolidina4, se puede preparar melanina con estos catalizadores y el precursor adecuado. En otra síntesis se oxida una solución de 5,6-dihidroxiindol, donde esta sumergido un electrodo en cuya superficie se deposita melanina7, 9.
Por los datos de la prueba de Thormählen, solubilidad y potencial electroquímico, es posible que los complejos [Cu(CN)4]3- y CuY2- catalicen la oxidación de la L-DOPA y posibiliten la formación de eumelanina. De acuerdo a nuestra revisión de la literatura, esta actividad catalítica es conocimiento nuevo.
AGRADECIMIENTOS
Agradezco el apoyo que recibí en el CENETROP, de parte del Dr. Jorge Vargas, la Dra. Yelin Roca, la Dra. Lorena Soleto y de sus grupos de trabajo.
Este estudio no podría haberse realizado sin la cooperación del Dr. Angel Clavel, quien recolectó los tejidos con lobomicosis y me los envió. Mi gratitud por su ayuda es grande.
REFERENCIAS
1. American Society for Testing and Materials. Standard Practice for Oxidation-Reduction Potential of Water. Standard D 1498-00. Pensilvania, 2000. [ Links ]
2. Brooks GF, Butel JS, Ornston LN. Microbiología médica de Jawetz, Melnick y Adelberg. 15 ed. México: El Manual Moderno, 1996.
3. Cooper BH. Clinical laboratory evaluation of a screening medium (CN screen) for Cryptococcus neoformans. J Clin Microbiol, 1980; 11: 672-674. [ Links ]
4. Cotton FA, Wilkinson G. Química Inorgánica Avanzada. 4 ed. México: Limusa Noriega, 1993.
5. Day RA, Underwood AL. Química Analítica Cuantitativa. 5 ed. México: Prentice-Hall Hispanoamericana, 1989.
6. Fonseca OJM, Lacaz CS. Estudo de culturas isoladas de blastomicose queloidiforme (doença de Jorge Lôbo). Denominação ao seu agente etiológico. Rev Inst Med trop S Paulo, 1971; 13: 225-251. [ Links ]
7. Gidanian S, Farmer PJ. Redox behavior of melanins: direct electrochemistry of dihydroxyindole-melanin and its Cu and Zn adducts [resumen]. J Inorg Biochem, 2002; 89: 54-60. [ Links ]
8. Herr RA, Tarcha EJ, Taborda PR, Taylor JW, Ajello L, Mendoza L. Phylogenetic analysis of Lacazia loboi places this previously uncharacterized pathogen within the dimorphic Onygenales. J Clin Microbiol, 2001; 39: 309-314. [ Links ]
9. Jacobson ES. Pathogenic roles for fungal melanins. Clin Microbiol Rev, 2000; 13: 708-717. [ Links ]
10. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn WC. Diagnóstico Microbiológico. Texto y Atlas color. 5 ed. Buenos Aires: Editorial Médica Panamericana, 1997.
11. Lacaz CS, Porto E, Martins JEC. Micología médica: fungos, actinomicetos e algas de interesse médico. 7 ed. San Pablo: Sarvier, 1984.
12. Lozano JA, Iborra JL. Bioquímica de la melanización. En: Ochoa S, Leloir LF, Oro J, Sols A. Bioquímica y Biología Molecular. Temas de actualidad para graduados. Barcelona: Salvat, 1991; p 249-253. [ Links ]
13. Maresca B, Kobayashi GS. Dimorphism in Histoplasma capsulatum: a model for the study of cell differentiation in pathogenic fungi. Microbiol Rev, 1989; 53: 186-209._ [ Links ]
14. Matoba Y, Kumagai T, Yamamoto A, Yoshitsu H, Sugiyama M. Crystallographic evidence that the dinuclear copper center of tyrosinase is flexible during catalysis. J Biol Chem, 2005; 281: 8981-8990. [ Links ]
15. Plonka PM, Grabacka M. Melanin synthesis in microorganisms -biotechnological and medical aspects. Acta Biochim Polon, 2006; 53: 429-443. [ Links ]
16. Recacoechea M, Vargas J. Experiencia con el ketoconazole en el primer caso de lobomicosis en Bolivia. Bol Inf CENETROP, 1982; 8: 23-26. [ Links ]
17. Sampaio MM. A note on the cultivation of the aetiological agent of Jorge Lobo's disease in 199 T. C. medium containing phytohaemagglutinin. Preliminary report. Rev Inst Med trop S Paulo, 1974; 16: 121, 122. [ Links ]
18. Schultz AL. Melaninas. En: Pesce AJ, Kaplan LA. Química Clínica. Métodos. 1 ed. Buenos Aires: Editorial Médica Panamericana, 1990; p 759-763.
19. Seip WF, Evans GL. Atmospheric analysis and redox potentials of culture media in the GasPak System. J Clin Microbiol, 1980; 11: 226-233. [ Links ]
20. Taborda VBA, Taborda PRO, McGinnis MR. Constitutive melanin in the cell wall of the etiologic agent of Lobo's disease. Rev Inst Med trop S Paulo, 1999; 41: 9-12.21. Taborda PR, Taborda VA, McGinnis MR. Lacazia loboi gen. nov., comb. nov., the etiologic agent of lobomycosis. J Clin Microbiol, 1999; 37: 2031-2033. [ Links ] [ Links ]
22. Tauber G. Useful facts and information concerning electrodes from SCHOTT-GERäTE. Electrodes for the Laboratory and the Field. Catalogue 3105. Hofheim: SCHOTT-GERäTE GmbH, 1989. [ Links ]
23. Vanbreuseghem R, De Vroey Ch, Takashio M. Guide pratique de Mycologie Médicale et Vétérinaire. 2 ed. París: Masson, 1978.
24. Vilani-Moreno FR, Opromolla DVA. Determinação da viabilidade do Paracoccidioides loboi em biópsias de pacientes portadores de doença de Jorge Lobo. An bras Dermatol, 1997; 72:
433-437.
25. Williamson PR. Biochemical and molecular characterization of the diphenol oxidase of Cryptococcus neoformans: identification as a laccase. J Bacteriol, 1994; 176: 656-664. [ Links ]
26. Williamson PR, Wakamatsu K, Ito S. Melanin biosynthesis in Cryptococcus neoformans. J Bacteriol, 1998; 180: 1570-1572. [ Links ]