Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.20 n.1 La Paz jun. 2012
ARTÍCULO ORIGINAL
Capacidad decolorativa de Coriolopsis polyzona, Pycnoporus sp. y Penicillium sp. sobre Reactive Black 5 a diferentes condiciones de cultivo
Decolorizing capacity of Coriolopsis polyzona, Pycnoporus sp. and Penicillium sp. on Reactive Black 5 under different culture conditions
Daniel Martin Salas Veizaga 1, Isabel Morales Belpaire1, EnriqueTerrazas Siles (†)2
1 Instituto de Biología Molecular y Biotecnología. Campus Universitario Cota Cota. Calle 27 s/n. Universidad Mayor de San Andrés. La Paz, – Bolivia. E-mail: danielsalas.bo@gmail.com
2Instituto de Investigaciones Fármaco Bioquímicas. – Universidad Mayor de San Andrés. – Facultad de Ciencias Farmacéuticas y Bioquímicas. La Paz, – Bolivia.
Dirección para correspondencia: Daniel Salas. Instituto de Biología Molecular y Biotecnología. Campus Universitario Cota Cota. Calle 27 s/n. Universidad Mayor de San Andrés. La Paz, Bolivia
E mail: danielsalas.bo@gmail.com
Recibido para publicación en: 10/02/12
Aceptado en: 14/06/12
RESUMEN
Durante la tinción de textiles, una parte de los tintes es eliminada en los efluentes, pudiendo causar contaminación en cuerpos de agua. Una alternativa para la degradación de estos colorantes son las enzimas extracelulares fúngicas, mayormente los denomidados Hongos de la Podredumbre Blanca. El presente estudio evaluó la capacidad biodegradadora de tres hongos sobre el colorante Reactive Black 5 mediante seguimiento de la decoloración en cultivos sólidos y líquidos a distintas de temperaturas, como en presencia de inhibidores enzimáticos. Las cepas de Coriolopsis polyzona y Pycnoporus sp. mostraron variaciones de su capacidad de decoloración con respecto a la temperatura. La cepa Coriolopsis polyzona tuvo mayor actividad a 32 °C, disminuyendo ésta a temperaturas menores. La cepa Pycnoporus sp. evidenció mayor actividad a temperaturas menores a 25 °C. La temperatura tuvo poco efecto sobre la capacidad de decoloración de Penicillium sp. Los inhibidores enzimáticos fueron monovanadato de amonio, que causó una inhibición parcial en la decoloración por las cepas fúngicas, mientras el nitrato de cadmio causó inhibición total. Este último evidenció toxicidad sobre los micelios y precipitación del colorante. Los resultados indicarían que C. polyzona y Pycnoporus sp., realizan decoloración por biodegradación, mientras que Penicillium sp. causó decoloración por adsorción, esto explica el diferente comportamiento de las cepas frente a la temperatura. El efecto de los inhibidores pudo deberse a la inactivación de las enzimas y a su toxicidad hacia los micelios; en efluentes contaminados con estos metales, el proceso de decoloración podría verse afectado.
Palabras Cclave.-: Decoloración, Reactive Black 5, Coriolopsis polyzona, Pycnoporus sp., Penicillium sp.
ABSTRACT
During the textile dyeing process, a part of the dyes is eliminated in effluents, possibly polluting rivers. An alternative for the degradation of these dyes is the use of extracellular enzymes produced by fungi, mainly those belonging to the White-rot fungi group. The present study evaluated the decolorizing capacity of three fungal strains on Reactive Black 5. We followed de decolorization of the dye in solid and liquid culture media at different temperatures and in the presence of enzymatic inhibitors. The decolorizing capacity of the Coriolopsis polyzona and Pycnoporus spp. strains varied with temperature. The C. polyzona strain showed higher capacity at 32°C, decreasing with lower temperatures. The Pycnoporus strain showed higher capacity for temperatures under 25°C. Temperature had little effect on the decolorizing capacity of Penicillium sp. strains. The enzymatic inhibitors tested were ammonium monovanadate, which caused partial inhibition of the decolorizing process, and cadmium nitrate, which caused total inhibition of the process. Cadmium nitrate also showed toxicity on mycelia and caused precipitation of the dye. These results suggest that for C. polyzona and Pycnoporus sp. strains, decolorization is caused by biodegradation, while the Penicillium sp. strain caused decolorization by bioadsorption. This could explain the different behaviors of the strains with temperature. The effect of the inhibitors can be caused by enzyme inactivation as well as by toxicity on fungi. In effluents that contain the tested metals, the decolorization process was inhibited.
Key Words: Decolorization, Reactive Black 5, Coriolopsis polyzona, Pycnoporus spp., Penicillium spp.
INTRODUCCIÓN
La incorporación, hace casi un siglo, de colorantes artificiales dentro del proceso de tinción en la industria textilera dio lugar al incremento de efluentes contaminados por los excedentes de colorantes1. Los tintes artificiales utilizados por las industrias se caracterizan por presentar alta resistencia al agua, luz, químicos e incluso a microorganismos, pero, por contraparte, estas características dan lugar a efluentes con altos grados de toxicidad que afectan a los ecosistemas y posiblemente a los humanos, incluso a bajas concentraciones 1, 2, 3, 4.
Se tienen diversas estrategias para minimizar los efectos negativos de este tipo de compuestos contaminantes. Se pueden nombrar métodos físicos y químicos como la adsorción, floculación, oxidación, reducción, intercambio iónico, cloración/ozonización e incineración. Estos métodos, mostraron ser efectivos en los procesos de reducción de los colorantes, pero son poco rentables económicamente1, 3, 5.
Los tratamientos biológicos para la decoloración de efluentes que contienen tintes, aparecen como una alternativa prometedora. Se requieren, sin embargo, de mayores estudios para poder pasar a aplicaciones prácticas. El uso de microorganismos ha sido una de las opciones estudiadas, pero se han observado limitantes por diversas causas, tales como la poca adaptabilidad para una amplia gama de colorantes6, 7. Una alternativa que podría obtener mejores resultados consiste en utilizar enzimas extracelulares de hongos descomponedores de lignina, mayormente aquellas provenientes de los denominados Hongos de la Podredumbre Blanca (White-rot fungi). Estos hongos tienen la capacidad fisiológica de liberar al medio enzimas extracelulares que degradan lignina a compuestos útiles para su crecimiento y metabolismo8, 9, 10. Tres son las enzimas extracelulares principales excretadas por este tipo de hongos, dos peroxidasas: Lignina y Manganeso Peroxidasa (LiP y MnP, respectivamente) y una fenil-oxidasa cooperadora: Lacassa (Lac)11. Las enzimas degradadoras de lignina son poco específicas y se ha observado su acción sobre una gran diversidad de sustratos entre los cuales se encuentran diversos xenobióticos con resultados positivos12, 13.
La efectividad que pueden tener las enzimas degradadoras de lignina, como las posibilidades de crecimiento y adaptación de los hongos que las producen, dependen fuertemente del sustrato a degradar, pero también de las condiciones del ambiente en que se encuentran estos sustratos: temperatura, presencia de metales, compuestos químicos inhibidores, etc. Por tanto, se requieren de estudios sobre el comportamiento de los hongos frente a diferentes variables, de tal forma que se determinen condiciones óptimas para el proceso de eliminación de los colorantes industriales.
Por esas razones, el objetivo de este estudio es evaluar el potencial biodegradador de cepas fúngicas bolivianas Pycnoporus sp. y Penicillium sp., comparándolas con Coriolopsis polyzona MUCL33483, sobre el colorante industrial Reactive Black 5 (RB5). Para esto, se ha analizado la capacidad decolorativa de estas tres cepas a diferentes concentraciones del tinte, determinándose además los efectos de la temperatura y de compuestos inhibidores de las enzimas LiP y MnP.
MATERIAL Y MÉTODOS
Cepas fúngicas. Coriolopsis polyzona MUCL33483 fue donada por Hubert Cabana, Ph D. de la Universidad de Sheerbrooke. Pycnoporus sp. fue colectada en el departamento de La Paz y aislada en la Unidad de Biotecnología Ambiental del Instituto de Biología Molecular y Biotecnología de la Universidad Mayor de San Andrés. Penicillium sp., fue gentilmente otorgada por el Instituto de Investigaciones Fármaco Bioquímicas (IIFB) de la Universidad mayor de San Andrés.
Colorante. El colorante Reactive Black 5 (RB5) C26H21O19N5S6Na4, de peso molecular de 991.8g/mol14, conocido comercialmente como Remazol Black B14, colorante reactivo, tipo dis-azo en polvo con pureza de 82.5%15 fue otorgado por el IIFB de la Universidad Mayor de San Andrés.
Decoloración de Reactive Black 5 a diferentes concentraciones. Se colocó Agar Extracto de Levadura (1 g/L) suplementado con concentraciones de RB5 a 50, 100, 200 y 1000 ppm en placas Petri previamente esterilizadas (121 °C por 20 min). Se sembraron dos trozos de micelio de las tres cepas fúngicas en dos extremos de las placas Petri. Se colocaron las muestras dentro de una estufa a 32 °C por 14 días. Se realizaron tres réplicas por cada concentración de RB5 utilizado, teniéndose controles sin inóculo. Para las evaluaciones, se realizaron inspecciones visuales a los 7 y 14 días de cultivo.
Decoloración de Reactive Black 5 a diferentes temperaturas. Esta prueba fue realizada únicamente para la concentración de 50 ppm, por ser la única concentración de RB5 que fue decolorada considerablemente por las tres cepas fúngicas. Para la prueba a diferentes temperaturas se utilizó el medio Extracto de Levadura (1g/L) suplementado con RB5 (50 ppm). Una vez autoclavado el medio de cultivo se procedió a colocar 80 ml del mismo a frascos de cultivo hasta que el medio enfriara. Posteriormente se colocaron dos inóculos de cada una de las tres cepas fúngicas. La incubación fue realizada a tres temperaturas: 32 °C, 25 °C y temperatura ambiente (oscilante entre 11 y 22 °C) por 14 días. Para cada temperatura se realizaron tres réplicas y se tuvo un frasco de cultivo control sin inóculo, totalizando un total de 10 frascos por cepa fúngica estudiada.
Decoloración de Reactive Black 5 en presencia de posibles inhibidores enzimáticos. Se utilizó el medio de cultivo Extracto de Levadura (1g/L) conteniendo RB5 a 50 ppm, además se colocaron inhibidores enzimáticos específicos de las enzimas extracelulares peroxidasas de White-rot fungi. Se utilizó monovanadato de amonio ((NH4)2VO3) como inhibidor de la LiP y nitrato de cadmio (Cd(NO3)2) como inhibidor de la MnP en una concentración de 0.1 g/L para ambos16, 17, 18. Para cada una de las cepas estudiadas se utilizaron los inhibidores por separado, es decir, se prepararon medios que contenían nitrato de cadmio y medios que contenían monovanadato de amonio, estos fueron incubados a 32 °C por 14 días. Para cada cepa se prepararon 10 frascos de cultivo por cepa, tres contenían a RB5 con el inhibidor de la LiP, tres contenían RB5 con el inhibidor de la MnP, tres frascos con medio de cultivo con RB5, sin inhibidores y un frasco con medio de cultivo con RB5, sin inhibidores y sin inóculo fúngico.
Análisis de datos. De los frascos de cultivo se extrajeron 5 ml de muestra líquida a los 3, 7, 10 y 14 días de cultivo. Estas alícuotas se colocaron en tubos de ensayo y se las centrifugó a 3000 rpm por 10 min. Posteriormente se procedió a la lectura de absorbancia de los sobrenadantes en un espectrofotómetro Spectrophotometer UNICO Model S2100+ de United Products and Instruments a una longitud de onda de 597 nm19, 20, 21, 22, 23. Como blanco de lectura se utilizó al medio de cultivo Extracto de levadura (1 g/L) sin colorante.
Se determinó el porcentaje de decoloración tal como fue descrito por Rodríguez et al. (2003)24; Mazmanci y Ünyayar (2005)25; Parshetti et al. (2007)26.

Se determinó asimismo la velocidad de decoloración. Esta expresa el porcentaje de decoloración con respecto al tiempo y se calcula mediante la pendiente de la curva de porcentaje de decoloración en los días en que se realizaron las lecturas espectrofotométricas.
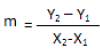
m es la velocidad de decoloración [%decol./día], Y2 y Y1 es el porcentaje de decoloración el día final e inicial de la lectura espectrofotométrica respectivamente, X2 y X1 es el día final e inicial de la lectura espectrofotométrica respectivamente.
Se realizó una prueba estadística no paramétrica Kruskal-Wallis con el programa SPSS18 para las absorbancias obtenidas a los 14 días de cultivo. Con la finalidad de observar la existencia o no de diferencias significativas en la decoloración de RB5 por las tres cepas estudiadas.
RESULTADOS
Decoloración de Reactive Black 5 a diferentes concentraciones. Los resultados evidenciaron que la cepa C. polyzona mostró mayor crecimiento de micelios y decoloración de RB5, después de 14 días de cultivo. A la concentración de 50 ppm se obtuvo una decoloración del 100% de RB5 (Tabla 1).

En concentraciones mayores del colorante, el porcentaje de decoloración disminuyó. Finalmente, a 1000 ppm (concentración mayor utilizada), solo se observó crecimiento fúngico superficial, pero no decoloración del tinte (Figura 1).

Por otra parte Pycnoporus sp. y Penicillium sp., mostraron halos decolorativos considerables a la concentración mínima de colorante, superando el 75% de degradación. A concentración de 100 ppm de RB5 solo se obtuvo un 50% de halo decolorativo, a concentraciones de 200 y 1000 ppm no se presentó crecimiento de micelios, ni decoloración significativa por parte de las cepas fúngicas.
Decoloración de Reactive Black 5 a diferentes temperaturas. El porcentaje de decoloración de RB5 en medio líquido para tres temperaturas testeadas mostró comportamientos distintos entre las tres cepas estudiadas. C. polyzona mostró mayor actividad decolorativa a una temperatura de 32 °C, Pycnoporus sp. evidenció mejor decoloración a temperaturas menores a 25 °C, mientras que Penicillium sp. presentó, a lo largo de los 14 días de cultivo, resultados similares para todas las temperaturas testeadas (Tabla 2; Figura 2).

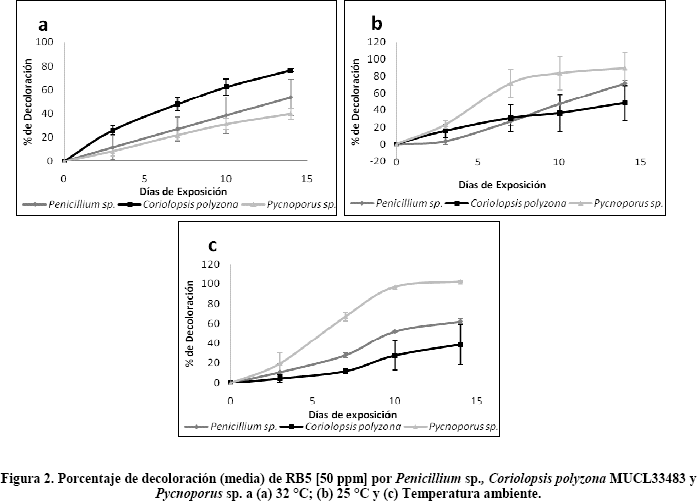
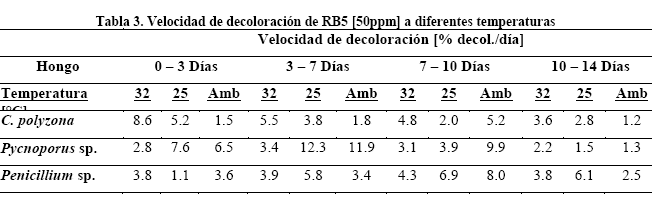
Se observó además que C. polyzona posee mayor velocidad de decoloración en los primeros tres días de cultivo para las temperaturas 32 y 25 °C, mientras que, a temperatura ambiente la mayor velocidad se mostró entre los 7 y 10 días de cultivo (Tabla 3). Pycnoporus sp. evidenció mayores velocidades de decoloración para las tres temperaturas testeadas entre los 3 y 7 días de cultivo, por otra parte, las menores velocidades se obtuvieron entre los 10 y 14 días de cultivo. Finalmente Penicillium sp. evidenció mayor velocidad de decoloración entre los 7 y 10 días de cultivo para las tres temperaturas testeadas.
Decoloración de Reactive Black 5 en presencia de posibles inhibidores enzimáticos. En presencia de monovanadato de amonio ((NH4)2VO3) se observó una inhibición parcial de la capacidad de decoloración en comparación a los controles en ausencia del inhibidor. En presencia de monovanadato de amonio, C. polyzona, Pyconoporus sp. y Penicillium sp. dieron lugar a valores menores al 50% de decoloración (Tabla 4).

La presencia de nitrato de cadmio (Cd(NO3)2) en el medio de cultivo dio lugar a un efecto tóxico sobre los micelios que no mostraron crecimiento, observándose asimismo la precipitación del tinte dentro del medio de cultivo (Figura 3).

DISCUSIÓN
Decoloración de Reactive Black 5 a diferentes concentraciones. C. polyzona, a diferencia de Pycnoporus sp. y Penicillium sp., mostró capacidad de poblar por completo las placas Petri en todas las concentraciones de colorante evaluadas, incluso a 1000 ppm donde no se observó decoloración. Pycnoporus sp. y Penicillium sp. sólo alcanzaron a poblar parte de la placa Petri en las concentraciones más bajas de Reactive Black 5, pero, aun en ausencia del mismo, la superficie de micelios formados nunca logró formar un tapete sobre toda la placa Petri. La capacidad de metabolizar colorantes en medio sólido se ve afectada por tres razones principales: la concentración de los tintes, la poca accesibilidad de los colorantes dentro de un medio agarizado y por la poca dispersión de los micelios17. La dispersión de micelios dentro del medio agarizado fue observada únicamente en Penicillium sp. (Dispersión no provocada), obteniéndose mejor decoloración en placas donde se tenía mayor dispersión de colonias.
Decoloración de Reactive Black 5 a diferentes temperaturas. La respuesta metabólica de las dos cepas de White-rot fungi en medios de cultivo bajo diferentes temperaturas, permitió evidenciar que C. polyzona posee mayor actividad decolorativa a 32 °C, mientras que Pycnoporus sp. actuó mejor a temperaturas menores (25 °C y temperatura ambiente).
La relación existente en la capacidad decolorativa de los hongos y la temperatura puede estar asociada a la termosensibilidad de sus enzimas a la hora de actuar sobre un sustrato específico. Lee (2005)27 menciona que los valores óptimos de incubación de los WRF están alrededor de los 27 °C. Por otro lado, las temperaturas óptimas de las enzimas degradadoras de lignina, oscilan alrededor de los 40 °C28. C. polyzona, comparte las mismas características de decoloración óptima a temperaturas mayores a 30 °C con otros WRF, como Trametes versicolor6 y Aspergillus niger26. Estos resultados muestran que las respuestas de los hongos a diferentes temperaturas dependen más de la propia fisiología fúngica, que de las temperaturas óptimas para las enzimas aisladas.
Pycnoporus sp. mostró mejores actividades decolorativas a temperaturas menores, durante el estudio fue la única cepa cultivada en medio líquido en la que todas las repeticiones realizadas obtuvieron el 100% de decoloración al cabo de los 14 días de cultivo. Las especies más estudiadas del género Pycnoporus spp. en cuanto a su capacidad de degradación de colorantes son P. cinnabarius y P. sanguineus17, 29, 30. Para las especies nombradas, se ha observado poco crecimiento y poca capacidad decolorativa a temperaturas bajas. Pointing et al. (2000)17 mencionan que una temperatura de cultivo menor a 25 °C es desfavorable para la decoloración de colorantes del tipo azo para P. sanguineus. Estos resultados contrastan con lo observado para la especie de Pynoporus sp. evaluada en el presente estudio. Tomando en cuenta la actividad Lacasa, la más abundante para este género, las temperaturas de mejor actividad oscilarían entre los 30 a 60 °C31. La cepa evaluada de Pycnoporus sp. mostró mejor actividad para temperaturas de 12 a 22 °C (temperatura ambiente).
Sólo un estudio realizado por Asgher et al. (2008)28 menciona buenos resultados de decoloración para P. sanguineus a temperaturas estándar de cultivo a 25 °C. De todas maneras, no necesariamente existe una relación directa entre el comportamiento de los micelios frente a cambios de temperatura (cambios en cuanto a desarrollo, excreción de enzimas y otros) y el comportamiento de enzimas producidas por estos micelios cuando encuentran de forma aislada.
Penicillium sp. mostró tener menor sensibilidad a los cambios de temperatura. Esto podría ser explicado por la alta capacidad de adsorción de esta cepa durante el proceso de crecimiento de los micelios y de decoloración. Si bien la adsorción puede ser afectada en cierta medida por la temperatura26 las variaciones no son tan notables como las presentadas a nivel de actividad enzimática.
El cultivo en medio líquido fue realizado de manera estática (sin agitación contínua). En estas condiciones, las tres cepas mostraron adsorción del colorante en los micelios durante los primeros días de cultivo. Acorde a Revankar y Lele (2007)32, la adsorción es una característica de este tipo de cultivos. C. polyzona y Pycnoporus sp. perdieron la coloración en los micelios conforme pasaron los días de cultivo. Penicillium sp. fue la única cepa que mantuvo constante la coloración de los micelios a lo largo del tiempo de cultivo. Por lo tanto el mecanismo mayor de decoloración del medio por esta cepa fue aparentemente la adsorción. Esta característica posee una ventaja sobre la degradación enzimática, pues se reducen los riesgos de liberación de metabolitos secundarios de mayor toxicidad al medio3.
Si bien la actividad enzimática específica no fue medida durante el estudio, los resultados mostrados de velocidad de decoloración concuerdan con los picos de excreción especificados por bibliografía. Pycnoporus sp. mostró, para las tres temperaturas testeadas, mayor velocidad de decoloración entre los 3 a 7 días, coincidente con el pico de excreción de lacasa reportado por Vanhulle et al. (2007)30 quienes describen picos de expresión de lacasa entre los 5 y 11 días. Los mismos autores describen además que, a partir del décimo día, la velocidad de decoloración desciende, coincidente con los resultados mostrados por Pycnoporus sp.
Decoloración de Reactive Black 5 en presencia de nitrato de cadmio (Cd(NO3)2) y monovanadato de amonio ((NH4)2VO3). El ión vanadato es considerado como un inhibidor de la enzima lignina peroxidasa28. Durante el estudio se observó que, a una concentración de 0.81 mM de monovanadato de amonio, ninguna de las tres cepas mostró una completa inhibición en el proceso decolorativo del Reactive Black 5. Otros estudios, para otros colorantes reactivos muestran completa inhibición de procesos decolorativos en presencia del vanadato. La diferencia entre los resultados presentados en otros estudios y los nuestros pueden deberse, por un lado, a que la lignina peroxidasa no sea la enzima que juega el rol principal en la degradación de RB5. Por otro lado, dado que se ha trabajado con cultivos fúngicos y no con enzimas aisladas, no se conoce cuál es la concentración efectiva de vanadato al que las enzimas han sido expuestas y cuáles son los efectos adicionales que tiene el vanadato sobre los micelios.
El ión cadmio es inhibidor de la enzima extracelular manganeso peroxidasa16. Durante el estudio, con una concentración de 0.1 g/L (0.46 mM) de nitrato de cadmio, se observó un efecto tóxico de este metal sobre los micelios de las tres cepas de hongos. Pointing et al. (2000)17, al utilizar una concentración de cadmio de 0.5 mM en procesos decolorativos con P. sanguineus mostraron los mismos patrones que en el presente estudio. Sin embargo Baldrían y Gabriel (2002)18 utilizaron concentraciones de cadmio de 5 mM como inductor de actividad enzimática lacasa (principal enzima excretada por el género Pycnoporus spp.). Es posible que las diferentes respuestas frente al ión cadmio sean características de las diferentes cepas fúngicas. Por otra parte, durante el estudio no se pudo determinar la causa de la precipitación del tinte en presencia de nitrato de cadmio durante el cultivo.
Las cepas Coriolopsis polyzona MUCL33483, Pycnoporus sp. y Penicillium sp. dieron lugar a la decoloración del tinte Reactive Black 5. En C. polyzona y Pycnoporus sp. la decoloración se dio por degradación de las moléculas de colorante, mientras que para la cepa Penicillium sp., el mecanismo principal de pérdida de color del medio parece ser por adsorción en sus micelios.
Los inhibidores enzimáticos empleados mostraron con monovanadato de amonio un efecto inhibitorio parcial de la capacidad de decoloración de las tres cepas, mientras que el nitrato de cadmio mostró toxicidad en micelios y precipitación del colorante, no pudiendo demostrarse un efecto inhibitorio enzimático.
Para la cepa boliviana Pycnoporus sp., que ha mostrado como característica sobresaliente el producir mejor decoloración a bajas temperaturas, se recomiendan estudios específicos sobre las enzimas extracelulares que produce. La adsorción evidenciada por Penicillium sp. podría ser una posible herramienta de bioremediación, especialmente si se obtuviesen similares resultados con el uso de la biomasa muerta.
AGRADECIMIENTOS
Al Instituto de Biología Molecular y Biotecnología y al instituto de Investigaciones Fármaco Bioquímicas, por el continuo apoyo a lo largo del estudio. Al Instituto de Ecología por el financiamiento que fue de gran utilidad en el desarrollo del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Wesenberg D, Kyriakides I, Agathos SN. White-rot fungi and their enzymes for the treatment of industrial dye effluents. Biotechnol Adv. 2003; 22:161-187. [ Links ]
2. Abadulla E, Tzanov T, Costa S, Robra KH, Cavaco-Paulo A, Gübitz GM. Decolorization and Detoxification of Textile Dyes whit a Laccase from Trametes hirsuta. Appl Environ Microbiol. 2000; 66 (8): 3357-3362. [ Links ]
3. Robinson T, McMullan G, Marchant R, Nigam P. Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative. Bioresour Technol. 2001; 77: 247-255. [ Links ]
4. Sharma P, Sigh L, Dilbaghi N. Optimization of process variables for decolorization of Disperse Yellow 221 by Bacillus subtilis using Box-Behnken design. J Hazard Mat. 2009; 164: 1024-1029. [ Links ]
5. Cristovâo RO, Tavares APM, Ferreira LA, Loureiro JM, Bioaventura RAR, Macedo EA. Modeling the discoloration of a mixture of reactive textile dyes by comercial laccase. Bioresour Technol. 2009; 100: 1094-1099. [ Links ]
6. Toh YC, Lin YJJ, Obbard JP, Ting YP. Decolourisation of azo dyes by white-rot fungi (WRF) isolated in Singapore. Enzyme Microb Technol. 2003; 33: 569-575. [ Links ]
7. Sutherland T, Horne I, Weie K, Coppin C, Williams M, Selleck M, Russel R, Oakeshott J. Enzymatic bioremediation: From enzyme discovery to applications. Clin Exp Pharmacol Physiol. 2004; 31: 817-821. [ Links ]
8. Blanchette R. Degradation of lignocelluloses complex in wood. Can J Bot. 1995; 73(1): 999-1010. [ Links ]
9. Haglund C. Biodegradation of xenobiotics compounds by white-rot fungus Trametes trogii. Master´s degree project. Uppsala University School of Engineering, Molecular Biotechnology Programe. 1999. [ Links ]
10. Cullen D, Kersten P. Enzymology and molecular biology of lignin degradation. Biochemistry and Molecular Biology. Segunda Edición. Springer-Verlag. Berlin Heildenberg. 2004; 250-263. [ Links ]
11. Pointing SB. Feasibility of bioremediation by white-rot fungi. Appl Microbiol Biotechnol. 2001; 57: 20-33. [ Links ]
12. Bending G, Friloux M, Walker A. Degradation of contrasting pesticides by white rot fungi and its relationship with lignolytic potential. FEMS Microbiol Lett. 2002; 212: 59-63. [ Links ]
13. Terrazas SE, Álvarez T, Guieysse B, Mattiasson B. Isolation and characterization of the white rot fungus Bjerkandera sp. Strain BOL13 capable of oxidizing phenanthrene. Biotechnol Lett. 2005; 27: 845-851. [ Links ]
14. Alaton IA, Balcioglu IA. Photochemical and heterogeneous photocatalytic degradation of waste vinylsulphone dyes: a case of study with hydrolysed Reactive Black 5. J Photochem Photobiol A: Chem. 2001; 141: 247-254. [ Links ]
15. Mai BH, Ehrhardt A, Bechtold T. CI Reactive Black 5 dye as a visible crosslinker to improve physical properties of lyocell fabrics. Cellulose. 2009; 16: 27-35. [ Links ]
16. Youngs HL, Sundaramoorthy M, Gold MH. Effects of Cadmiun on Manganese Peroxidase. Competitive inhibition of MnII oxidation and thermal stabilization of the enzyme. Eur J Biochem. 2000; 267: 1761-1769. [ Links ]
17. Pointing SB, Bucher VVC, Vrijmoed LPP. Dye decolorization by sub-tropical basidiomycetous fungi and the effect of metals on decolorizing ability. World J Microbiol Biotechnol. 2000; 16: 199-205. [ Links ]
18. Baldrian P, Gabriel J. Copper and cadmium increase laccase activity in Pleurotus ostreatus. FEMS Microbiol Lett. 2002; 206: 69-74. [ Links ]
19. Swamy J, Ramsay JA. The evaluation of white rot fungi in the decoloration of textile dyes. Enzyme Microb Technol. 1999; 24: 130-137. [ Links ]
20. Peralta ZP, Pereira CM, Tiburtius ERL, Moraes SG, Rosa MA, Minussi RC, Durán N. Decolorization of reactive dyes by immobilized laccase. Appl Catal B: Environ. 2003; 42: 131-144. [ Links ]
21. Meriç S, Kaptan D, Ölmez T. Color and COD removal from wastewater containing Reactive Black 5 using Fenton´s oxidation process. Chemosphere. 2004; 54: 435-441. [ Links ]
22. Murugesan K, Dhamija A, Nam IH, Kim YM, Chang YS. Decolourization of reactive black 5 by laccase: Optimization by response surface methodology. Dyes Pigm. 2007; 75: 176-184. [ Links ]
23. Faraco V, Pezzella C, Giardina P, Piscitelli A, Vanhulle S, Sannia G. Decolourization of textile dyes by the White-rot fungi Phanaerochaete chrysosporium and Pleurotus ostreatus. J Chem Technol Biotechnol. 2009; 84: 414-419. [ Links ]
24. Rodríguez S, Fernández M, Bermúdez RC, Morris H. Tratamiento de efluentes industriales coloreados con Pleurotus spp. Rev Iberoam Micol. 2003; 20: 164-168. [ Links ]
25. Mazmanci MA, Ünyayar A. Decolourisation of Reactive Black 5 by Funalia trogii inmobilised on Luffa cylindrical sponge. Process Biochem. 2005; 40: 337-342. [ Links ]
26. Parshetii GK, Kalme SD, Gomare SS, Govindwar SP. Biodegradation of Reactive blue-25 by Aspergillus ochraceus NCIM-1146. Bioresour Technol. 2007; 98: 3638-3642. [ Links ]
27. Lee MK. Application of White-rot Fungi for the biodegradation of natural organic matter in wastes. Tesis para optar al grado de master en ingeniería. Universidad MRMIT. Melbourne – Australia. 2005. [ Links ]
28. Asgher M, Bhatti HN, Ashraf M, Legge RL. Recent developments in biodegradation of industrial pollutants by white rot fungi and their enzyme system. Biodegradation. 2008; 19: 771-783. [ Links ]
29. Balan D, Monteiro R. Decolorization of textile indigo dye by lignolytic fungi. J Biotechnol. 2001; 89:141-145. [ Links ]
30. Vanhulle S, Enaud E, Trovalset M, Nouaimeh N, Bols CM, Keshavars T, Tron T, Sannia G, Corbisier AM. Overlap of laccases/cellobiose dehydrogenase activities during the decolourisation of anthraquinonic dyes whit closer chemical structures by Pycnoporus strains. Enzyme Microb Technol. 2007 40: 1723-1731. [ Links ]
31. Lu L, Zhao M, Zhang BB, Yu SY, Bian XJ, Wang W, Wang Y. Purification and characterization of laccase from Pycnoporus sanguineus and decolorization of an anthraquinone dye by the enzyme. Appl Microbiol Biotechnol. 2007; 74: 1232-1239. [ Links ]
32. Revankar MS, Lele SS. Synthetic dye decolorization by white rot fungus, Ganoderma sp. WR – 1. Bioresour Technol. 2007; 98: 775-780 [ Links ]












