Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.20 n.1 La Paz jun. 2012
ARTÍCULO ORIGINAL
Polimorfismos genéticos de la GSTM1 y GSTT1 como modificadores de riesgo mutagénico en agricultores bolivianos expuestos a plaguicidas
Genetic polimorphism of GSTM1 and GSTT1 as mutagenic risk modifiers in bolivian farmers exposed to pesticides
Noemí Tirado Bustillos, María Eugenia Ascarrunz G., Ximena Aguilar M., Ana Rada T.
Unidad de Genética Toxicológica, Instituto de Genética, Universidad Mayor de San Andrés. La Paz – Bolivia.
Dirección para correspondencia: Noemí Tirado MSc. Instituto de Genética, Facultad de Medicina, Universidad Mayor de San Andrés. Av. Saavedra Nº 2246, 9º Piso, Miraflores. La Paz, Bolivia. Telf. 2229613.
E mail: noemitirado@yahoo.com
Recibido para publicación en: 16/01/12
Aceptado en: 13/06/12
RESUMEN
Los plaguicidas son uno de los químicos tóxicos más frecuentemente encontrados en el ambiente. Los agricultores son blanco de una exposición crónica constante constituyéndose así en un grupo de riesgo interesante de monitorear por las repercusiones a que puede conllevar en términos de riesgo a desarrollar enfermedades derivadas de tal exposición derivándose un problema de salud pública para el país. En el presente trabajo se estudió la frecuencia y la influencia de los polimorfismos de la GSTM1 y GSTT1 sobre los biomarcadores de exposición Colinesterasa, intercambios entre cromátides hermanas (ICH), Porcentaje de células con alta frecuencia de intercambios (%HFC), Índice de proliferación celular (PRI), micronúcleos en células binucleadas (MNCB) y el índice de división nuclear (IDN). Participaron 142 personas (99 agricultores expuestos y 43 controles).
Nuestros datos revelan que en la comunidad de Palca la frecuencia de MN (o MNCB aclarar) fue superior a los encontrados en Caravani p=0,000, mientras que esta última mostró mayor frecuencia de ICH en relación a Palca p=0,004.
Con relación a los parámetros citogenéticos analizados, el efecto del genotipo GSTM1 (-) en la frecuencia de MN mostró valores inferiores a los del genotipo GSTM1 (+) aunque estadísticamente no significativos p=0,075. Respecto al genotipo GSTT1 (-) éste presentó una frecuencia de MN igual al genotipo GSTT1 (+). La influencia del GSTM1 nulo sobre los ICH se mostró como un ligero incremento en las frecuencias de este parámetro, mientras que la influencia del GSTT1 (-) sobre los ICH se mostró con una ligera disminución en relación a los individuos GSTT1 (+).
El análisis para el cálculo de la magnitud de asociación entre polimorfismos de las GSTs y daño genotóxico, muestra que la población GSTM1 (-) incrementa el riesgo 0.38 veces más de presentar daño genotóxico en relación a la población que tiene el gen. El análisis realizado sobre la magnitud de asociación entre polimorfismos de las GSTs y otros factores adicionales a la exposición a plaguicidas (edad, sexo, ocupación, habito de fumar, consumo de alcohol, exposición a rayos X), mostró que el consumo de alcohol es un factor de riesgo significativo.
Palabras Clave: Exposición a plaguicidas, genotoxicidad, polimorfismos GST, Bolivia
ABSTRACT
Pesticides are one of the toxic chemicals most frequently found in the environment. Farmers who are exposed to pesticides suffer from constant and chronic exposure and thus constitute a risk group. The present study investigated the frequency and the influence of GSTM1 and GSTT1 polymorphisms in the exposure (cholinesterase) and effect (sister chromatid exchanges (SCEs), percentage of high frequency of interchanges (%HFC), proliferative rante index (PRI), micronuclei (BCMN), nuclear division index (NDI)) biomarkers. The participants were 142 persons (99 exposed farmers and 43 controls). The BCMN and SCE frequencies showed statistically significant differences in data collected from populations and it was observed that in the community of Palca there are high values in the frequency of MN compared to Caranavi (p=0.000), the community analysis for SCE showed higher values in Caranavi than in Palca (p=0.004). With regard to the cytogenetic parameters analyzed, the effect of the GSTM1 (−) genotype in the MN frequency shows lower values compared to those of the GSTM1 (+) genotype, although they were not statistically significant p=0.075. The GSTT1 (–) genotype presented a MN frequency similar to the GSTT1 (+) genotype. The influence of the null GSTM1 on SCEs showed a slight increment in the frequencies of this parameter, while the influence of GSTT1 (–) on the SCEs was shown with a slight decrease in relation to GSTT1 (+) individuals. The analysis of the magnitude of the association between polymorphisms of the GSTs and genotoxic damage shows that the GSTM1 (–) population increases the risk 0.38 times more than the population that has the gene. Analyses carried out on the magnitude of the association between GSTs polymorphisms and other factors in addition to pesticide exposure (age, sex, occupation, smoking habit, alcohol consumption, x-ray exposure) showed that alcohol consumption is a significant risk factor.
Key Words: Pesticides exposure, genotoxicity, GST polymorphisms, Bolivia
INTRODUCCIÓN
Los plaguicidas son productos químicos tóxicos utilizados para prevenir, destruir o controlar cualquier plaga, incluyendo vectores de enfermedades humanas y animales, además de especies indeseadas de plantas que causen daño a la producción, procesado, almacenamiento, transporte o comercialización de los alimentos1.
Aunque el uso de plaguicidas refuerza la productividad de la cosecha, los humanos también pagan un precio por los beneficios, traducidos en efectos sobre la salud. Alrededor del mundo, se ha informado aproximadamente 3 millones de envenenamientos agudos y 220 000 muertes al año, por la exposición a plaguicidas2. Además se ha descrito que los granjeros con exposición prolongada a bajas dosis de plaguicidas eventualmente desarrollan a largo plazo efectos sobre la salud, similares a aquellos que han recibido exposiciones agudas con altas dosis, por ejemplo, las anormalidades del comportamiento neuronal, resultados reproductivos adversos, y aumento de la incidencia de cáncer (leucemia, linfoma no Hodking, y mieloma múltiple). Por consiguiente la exposición crónica a plaguicidas puede causar serios efectos a la salud de los agricultores expuestos que no tengan historia de envenenamiento agudo.
Entre los diversos daños que puede sufrir el material genético, como consecuencia de condiciones ambientales perjudiciales, están las mutaciones puntuales y cromosómicas, que pueden propiciar la transformación celular. Si tales alteraciones ocurren en proto-oncogenes o genes supresores de tumores, involucrados en el crecimiento y diferenciación celulares, pueden propiciar el desarrollo de cáncer en el órgano comprometido, contribuir al envejecimiento prematuro y producir enfermedades vasculares, autoinmunes o degenerativas. Si ocurren en la línea germinal, pueden originar problemas reproductivos (infertilidad) y en la descendencia aumento de enfermedades genéticas, tanto monogénicas como complejas. La evidencia toxicológica de la acción mutagénica y carcinogénica de varios plaguicidas y la exposición ocupacional o accidental de grandes poblaciones humanas a estos compuestos, han centrado la atención de muchos estudios citogenéticos. En varios estudios que buscaron evaluar el riesgo genético de exposición ocupacional se demostró una asociación entre exposición ocupacional a plaguicidas y la presencia de aberraciones cromosómicas y/o intercambios entre cromátides hermanas y/o micronúcleos2,3,4,5,6,7,8.
La susceptibilidad genética a los efectos adversos de la exposición a plaguicidas constituye un concepto nuevo e importante para futuros estudios y aplicación, y puede representar la línea de corte de la investigación de los efectos a salud de los plaguicidas. Puede ser un factor mediador para explicar mecanismos para la salud de los trabajadores, variaciones en los resultados entre grupos étnicos, y resultados de mezclas en estudios epidemiológicos. En otras áreas de salud ambiental y evaluación de riesgo, los polimorfismos genéticos han sido investigados como predictores de cáncer de pulmones en fumadores9, y la severidad del envenenamiento por plomo en niños10. La búsqueda de metabolizadores lentos genéticamente susceptibles ciertamente ofrece esperanza para prevenir el cáncer en el futuro, educando a aquellos quienes son más susceptibles a efectos a la salud por plaguicidas para limitar su exposición a estos compuestos.
En Bolivia, la actividad agropecuaria representa uno de los principales componentes de la economía. Este sector aporta el 21% del Producto Interno Bruto contribuyendo con alrededor del 20% del total de las exportaciones. Ocupa un poco más del 39% de la población económicamente activa, abarcando una superficie cultivada por año agrícola de cerca de dos millones de hectáreas. Durante los años 1997 y 1998, para una superficie de 1.241.621 has. (65 % de la superficie sembrada es dedicada al cultivo de la soya, arroz, algodón, maíz, girasol, caña, tomate y papa), se utilizaron 6.762,88 toneladas métricas, con un costo aproximado de 92.061 millones de dólares americanos. En el año 2003 los registros de importación de insumos agropecuarios mostraron un total de 17. 128. 402.79 kilogramos de los que alrededor de un 50% correspondieron a plaguicidas, sin tomar en cuenta la cantidad de ellos que ingresan por la vía del contrabando, estimada en un 30% adicional. Este importante uso de plaguicidas en Bolivia durante los últimos 40 años, se traduce en la actualidad en la existencia de alrededor de 300 toneladas de plaguicidas obsoletos encontrados a lo largo del territorio, entre los que figuran organoclorados, organofosforados, piretroides, ditiocarbamatos e inorgánicos entre los principales, lo que implica un importante riesgo para la salud.11
En vista de que en nuestro país los agricultores que están expuestos a los plaguicidas, sufren una exposición crónica constante y además realizan un manejo inadecuado de los mismos (sin normas de seguridad), ellos constituyen un grupo de riesgo, como se pudo evidenciar en un primer estudio de evaluación de daño genotóxico realizado. Estos antecedentes mostraron la necesidad de realizar estudios de susceptibilidad genética a través de la determinación de los genotipos de las isoenzimas de biotransformación de plaguicidas y su relación con la magnitud de daño al material genético como modificadores de riesgo de futuras enfermedades (como el cáncer), con el propósito de contribuir a las políticas de prevención del sector salud.
MATERIAL Y MÉTODOS
Se realizó un estudio de casos y controles anidado en un estudio de corte transversal. La población analizada en este estudio fue de 142 personas, divididas en dos grupos: expuestos y controles, que se diferencian en su exposición a plaguicidas. Los controles fueron profesores y personal de salud de las localidades en estudio. Ambos grupos expuestos y no expuestos respondieron un cuestionario validado y firmaron el consentimiento informado.
La distribución general de la población de estudio por localidad es la siguiente: Caranavi (33,8%), Guanay (12,7 %), Mecapaca (8,5%) y Palca (41,5%).
Determinación de la actividad colinesterasa. La actividad de colinesterasa en suero fue medida en el laboratorio del Instituto Nacional de Salud Ocupacional por un método espectrofotométrico, cuyo fundamento se basa en que la colinesterasa se utiliza en el primer paso de la reducción del potasio hexacianoferrato produciéndose un cambio en el color que se puede medir con una variación debajo de 2,3% dentro del mismo sistema de análisis.
El daño genotóxico fue evaluado a través del ensayo de micronúcleos en linfocitos de sangre periférica, para medir el daño clastogénico y/o aneugénico y mediante la técnica de intercambio entre cromátides hermanas. La obtención de todas las muestras de sangre periférica fue realizada por punción venosa en tubos Vacutainer con heparina.
Las muestras fueron procesadas de acuerdo a protocolos estandarizados que serán detallados a continuación.
Ensayo de micronúcleos células binucleadas. Después de homogenizar la muestra, se agregaron 0,5 mL de sangre total a 4,5 mL de medio de cultivo RPMI 1640 (Sigma), suplementado con 10% de suero bovino fetal, 1% de una solución de antibiótico antimicótico (Sigma), los linfocitos se estimularon con 1% de fitohemaglutinina (PHA) Gibco. Los cultivos se incubaron a 37º C durante 72 h, lo que corresponde a dos ciclos celulares. Pasadas las 44 h de cultivo se agregó citocalasina B (Sigma) a una concentración final de 6µg/mL. Se ha demostrado que esta concentración permite detener la citocinesis de forma óptima, obteniendo mejores valores del índice de división celular y una mejor estima de la frecuencia de MN, al evitarse la sobrevaloración ya que se puede diferenciar con mayor precisión las células correspondientes a la segunda división mitótica12. Pasadas las 72 horas de incubación, los cultivos se centrifugaron a 800 r.p.m durante 8 min. Después de aspirar el sobrenadante, las células fueron sometidas a choque hipotónico mediante una solución de KCl 0,075 M a 37º C, agitando enérgicamente en el vórtex; de esta manera se eliminan los hematíes preservando el citoplasma de los leucocitos, luego se incubó a 37º C durante 5 min. Después de centrifugar nuevamente los tubos en las mismas condiciones y eliminar el sobrenadante, se procedió a la fijación de células con una solución de metanol y ácido acético fría en proporción de 5:1 (vol/vol), recién preparada, agregándola suavemente para evitar precipitados celulares. Se centrifugó nuevamente para eliminar el sobrenadante, repitiendo el proceso dos veces o más hasta que el botón celular quedó suficientemente limpio.
El botón celular se re suspendió en una pequeña proporción de la solución de fijación y se goteó sobre portaobjetos limpios y fríos. Las preparaciones se dejaron secar a temperatura ambiente para luego ser teñidas con una solución de Giemsa al 6% (Merck) en tampón Sörensen (pH 6.8) durante 12 minutos.
Una vez teñidas, las placas fueron examinadas para determinar la frecuencia de MN. Los portaobjetos de todos los individuos, tanto expuestos como controles, se codificaron en ciego por una tercera persona antes de su análisis para evitar al máximo la subjetividad en el recuento.
De cada individuo se analizaron 1000 células binucleadas con el citoplasma bien conservado. La observación de los núcleos se realizó con microscopio óptico (Leitz Laborlux D, Alemania) con el objetivo de 1000 aumentos. La evaluación microscópica se realizó en 1000 células binucleadas para cada individuo en placas codificadas, y se contaron el número total de MN y la frecuencia de células con MN (MNBN). Se contó además 500 linfocitos para evaluar el porcentaje de células con 1,2, 3 ó 4 núcleos, y se calculó el índice de división nuclear (IDN) de acuerdo a-Fenech y col. 13,14
Intercambios entre cromatides hermanas (ICH). Los linfocitos fueron incubados en medio RPMI-1640 (Sigma), suplementado con 1.5% penicilina-estreptomicina (5000 IU/ml–5000 g/ml, respectivamente y 1% l-glutamina (Sigma), 5-bromo-deoxyuridine (BrdU) (Sigma) (20 uM) y Phytohaemagglutinine (PHA) 2,5 mg/ml, en la oscuridad por 72 h en estufa a 37ºC y las metafases fueron bloqueadas durante las 2 últimas horas con colchicina (Sigma). Las células fueron colectadas por centrifugación, re suspendidas en una solución hipotónica precalentada a 37ºC (0.075 M KCl) por 15 min y fijadas en una solución fría de metanol y ácido acético (3:1 v/v). El botón celular se re suspendió en una pequeña proporción de la solución de fijación y se goteó sobre portaobjetos limpios y fríos. Las placas de vidrio fueron secadas al aire y teñidas con Giemsa al 6% (Merck) en buffer Sörensen a pH 6.8, de acuerdo al método propuesto por Perry y Wolf 15 (1974). Las placas de cada cultivo fueron randomizadas y evaluadas a doble ciego, observándose ICH/célula en 30 metafases en segunda división por cada individuo.
Para la observación de ICH/célula se registraron 30 metafases en segunda división por cada individuo. El índice de proliferación celular (PRI) fue calculado con la formula RI = 1M1 + 2M2 + 3M3/100, donde M1, M2 y M3 son metafases de primera, segunda y tercera división respectivamente. El análisis del % HFCs fue realizado de acuerdo a Carrano y Moore.16. Una célula con alta frecuencia de intercambios (HFC) fue definida como una célula que presenta un número mayor a 10 ICHs/célula.
Análisis de los genotipos. La extracción del DNA se realizó con el kit Wizard genomic DNA purification (Promega).
Los polimorfismos GSTM1 y GSTT1 se analizaron en una prueba de PCR multiplex.
El PCR multiplex se realizó en un volumen final de 25 μl conteniendo 100 ng de DNA genómico, 100 ng de cada primer, 2 mM de dNPTPs, 2.5 μl de buffer para PCR 10X (1X: 200 mM Tris HCl, 500 mM KCl, pH 8,4), 2,0 mM de MgCl 2, y 1.25 U de DNA taq polimerasa (Gibco - invitrogen). Los primers que se utilizaron (GSTM1 y GSTT1) en la PCR, la secuencia de los mismos, la longitud de los productos amplificados en pares de bases (pb) y la secuencia del control interno (exón 7 del gen CYP1A1).

Análisis estadístico. Se realizó un análisis descriptivo e inferencial a través de un diseño de casos y controles anidado en estudio de corte transversal. Para realizar el análisis estadístico de los datos obtenidos en el estudio, primero se confeccionó una base de datos completa incluyendo tanto los datos obtenidos a través de la encuesta, como los resultados de los análisis de las muestras procesadas en el laboratorio. La base de datos se confeccionó utilizando el paquete estadístico SPSS versión 11.5. Para determinar la normalidad de los datos, se aplicó la prueba no paramétrica de Kolmogórov- Smirnóv.
Para determinar la significancia estadística de los resultados, en el caso de que la variable tuviera una distribución normal de los datos, se aplicó la prueba de t de Student para la comparación de medias de dos grupos independientes. En caso de que los datos no presentaron una distribución normal, se utilizó la prueba de Mann Whitney para la comparación de medias de dos grupos independientes y Kruskal Wallis para la comparación de medias de más de dos grupos independientes. En ambos casos el nivel de confianza empleado fue el 95%. Para la determinación del factor de riesgo (OR) de la presencia o ausencia de los polimorfismos en relación al daño genotóxico se clasificó la población en dos grupos, casos y controles.
RESULTADOS
Descripción de poblacional. De las 142 personas que participaron en el estudio, 99 (70%) fueron de ocupación agricultores, el 30% restante fue personal de salud y educación. El 25,4% fue del sexo femenino y el 74,6% del sexo masculino; el 27% tienen hábito tabáquico; el 41,8% consume bebidas alcohólicas. Sólo el 23% ha sido sometido alguna vez a rayos X. El 42,1% chaquean. El 57,1 % mastica hojas de coca y el 42,1% consume mate de coca. Un porcentaje muy bajo 4,3% tiene antecedentes familiares de cáncer. Del total de trabajadores agrícolas, el 49,2% utilizaron organofosforados, el 9,8% y 8,8 % fungicidas y piretrinas o piretroides respectivamente.
Colinesterasa. Los resultados mostraron que no existen diferencias estadísticamente significativas en los niveles de colinesterasa entre los expuestos y no expuestos. Con valores de 0,388 ± 0.078 en el grupo control y 0.403 ± 0.077 en el grupo de expuestos.

Biomarcadores de efecto biológico MNs e ICHs en linfocitos. En la Tabla 1 se observan los datos de los biomarcadores citogenéticos analizados por comunidad donde se observan diferencias estadísticamente significativas entre las comunidades.

Al analizar la variable MNBN en la población total separada por sexo se pudo ver que la población de mujeres presenta mayor frecuencia de daño citogenético con un valor estadísticamente significativo (p=0,026).
Biomarcadores de susceptibilidad individual. La población estudiada en este trabajo cuenta con 55 personas que presentan deleción del gen GSTM1, lo que representa un 38,6% del total de la población. Estos datos concuerdan con frecuencias encontradas en estudios realizados en poblaciones caucásicas17, donde reportan que un 38 – 62% de las poblaciones presentan la deleción del gen GSTM1. Para el genotipo GSTT1 un 40.8% de la población presenta el genotipo salvaje y un 59,2% presenta la deleción del gen.

Asociación de la presencia de los polimorfismos de la GSTM1 y la GSTT1 con el daño genotóxico
Al evaluar la asociación de los polimorfismos de la GSTM1 y GSTT1 con el daño genotóxico en sujetos expuestos se observó que la presencia del genotipo GSTM1 (positivo) presentó una frecuencia de MN superior en relación al genotipo GSTM1 nulo, aunque estadísticamente no significativo (p=0,075). Por otro lado el genotipo GSTT1 nulo presentó una frecuencia de MN igual al genotipo GSTT1 positivo.

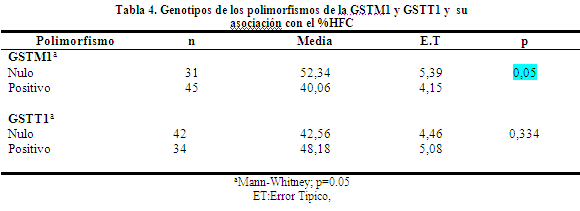
Porcentaje de células con alta frecuencia de intercambios. En el caso del porcentaje de células con alta frecuencia de intercambios se observó que en los individuos con el genotipo GSTM1 nulo los valores estaban incrementados en relación a los individuos GSTM1 positivo con una asociación significativa (p=0.05). Mientras que al analizar los individuos con el genotipo GSTT1 nulo en relación a los que presentan el genotipo GSTT1 positivo se observó un efecto contrario, sin embargo no fue estadísticamente significativo.
DISCUSIÓN
En los resultados obtenidos tal como puede observarse, la exposición a los plaguicidas no ha supuesto un aumento significativo de las frecuencias de MNBN, es decir, el hecho de ser agricultor laboralmente expuesto a tales compuestos químicos no se refleja en un incremento de daño genético en forma de MNBN, datos comparables con los resultados de estudios de biomonitorización de poblaciones expuestas a plaguicidas publicados por Joksic y col. y otros investigadores18, 19, 20, 21, 22, 23,24, 7.
El hecho de no haber encontrado un incremento significativo de MN en los agricultores expuestos a plaguicidas indica simplemente que no se han producido roturas ni pérdidas cromosómicas a niveles estadísticamente significativos. Esta falta de daño genético no se puede atribuir a una baja exposición, ya que todas las comunidades analizadas desarrollan una actividad agrícola intensa. Tal vez el punto más importante esté en los plaguicidas utilizados. En las poblaciones del presente estudio, una amplia variedad de productos son utilizados en mayor o menor proporción. La gran mayoría están clasificados como seguros, aunque realmente muchos están probados únicamente en animales de laboratorio y de manera individual (no mezclas).
Al realizar el análisis por poblaciones se observó que en la comunidad de Mecapaca existen valores inferiores en la frecuencia de MNBN en relación a Caranavi, Guanay y Palca, notándose valores superiores en la frecuencia de MN en Palca con una diferencia estadísticamente significativa en relación a Caranavi (p=0,000).
Al evaluar los MN en linfocitos también se calculó el índice de duplicación nuclear (IDN) con bloqueo de la citocinesis. El IDN da cuenta de la velocidad de división celular y se usa como indicativo del grado de toxicidad al que se encuentran expuestas las células ya que a mayor toxicidad disminuye la velocidad de división celular. Un hecho interesante es que los plaguicidas parecen influir en la cinética de proliferación celular induciendo alteraciones, tales como retraso en el ciclo celular y reducción de la proliferación de linfocitos25. En referencia al IDN, del total de los 142 individuos, el grupo de expuestos a plaguicidas mostró un descenso pero no significativo respecto a los no expuestos. Los resultados del IDN analizados por comunidad mostraron que los pobladores de Caranavi presentaban mayor grado de toxicidad celular con un descenso estadísticamente significativo en relación a los pobladores de Palca (p=0,01).
La reducción de los valores del IDN en los agricultores expuestos a plaguicidas demuestra que estos productos tienen actividad citotóxica, que podría manifestarse como genotoxicidad o enmascarar la posible actividad genotóxica, ya que, según Kirsh-Volders y Fenech26, las exposiciones continuas a toxinas, como podrían ser los plaguicidas, y a niveles bajos, se puede traducir en una respuesta adaptativa relacionada con un incremento en la sensibilidad a la apoptosis y/o un retraso más extendido del ciclo celular, lo que daría tiempo a una reparación del daño inducido inicialmente.
Existen numerosos artículos publicados utilizando la técnica de intercambios entre cromátides hermanas como biomarcador en biomonitoreo de poblaciones expuestas a plaguicidas desde los años 70 tales como Crossen y col., Carbonell y col.27, 28. El análisis por comunidades mostró mayor número de ICH en Caranavi en relación a Palca con diferencias estadísticamente significativas (p=0,004).
Al realizar el análisis del %HFC se evidenció que no existían diferencias estadísticamente significativas entre el grupo de expuestos y controles, sin embargo el análisis de %HFC por comunidad mostró diferencias estadísticamente significativas entre Caranavi y Palca (p=0,001) y entre Guanay y Palca (p=0,032). En un estudio realizado por Shaham y col. 200129 en un grupo de floricultores de Sharon (Israel) se reportó un incremento significativo de SCE tanto en número como en HFC en el grupo agrícola comparado con el control.
Se consideró oportuno el realizar el estudio de los genes GSTM1 y GSTT1, como fuente de variabilidad individual, que podía afectar a los resultados citogenéticos. La metodología utilizada no permite determinar el número de copias para el gen, simplemente la presencia o ausencia del mismo. Este análisis se realizó en todas las poblaciones involucradas en el estudio, los resultados obtenidos mostraron que 55 personas presentan deleción del gen GSTM1, lo que representa un 38,6% del total de la población. Estos datos concuerdan con frecuencias encontradas en otros estudios en el ámbito mundial en individuos sanos donde reportan entre 23% y 41% en la población afroamericana y africana, 33% y 69% en asiáticos, 39% y 62% en europeos, 38% – 62% en poblaciones caucásicas30, 17.
Para el genotipo GSTT1 un 40.8% de la población presenta el genotipo salvaje y un 59,2% presenta la deleción del gen, estos valores son similares a los obtenidos en estudios realizados en poblaciones chinas14 donde reportan de 58 – 62% de frecuencias de deleción del gen de GSTT1.
Como el cáncer es un proceso multifactorial, la presencia de los polimorfismos de la GSTM1 y GSTT1 en una población general no siempre pueden ser los factores determinantes para que se dé esta enfermedad, ya que puede existir la presencia de otras enzimas metabólicas (CYP2E1 y paroxone PON) cuyas actividades están alteradas por la presencia de polimorfismos que modifican el metabolismo de los plaguicidas.31, 32, 33.
Los polimorfismos de GSTM1 y GSTT1 modifican la actividad de estas enzimas, por lo que estas actividades podrían afectar los niveles de colinesterasa en sangre. En este estudio la presencia de polimorfimos GSTM1 y GSTT1 no afectaron significativamente los niveles de colinesterasa sérica estos resultados son comparables a los obtenidos por Pastor y col. 34
Con relación a los parámetros citogenéticos analizados, el efecto del genotipo GSTM1 nulo en la frecuencia de micronúcleos muestra valores inferiores a los del genotipo GSTM1 positivo aunque estadísticamente no significativos p=0,075, este hallazgo es comparable con los resultados del estudio realizado por Kirsch-Volders35 donde reportan que el efecto del genotipo GSTM1 nulo en la frecuencia de Mn fue mínimo y sólo significativo al límite y con los resultados de Ghita y Col.36, en otro estudio similar reportan que no observaron incrementos significativos de daño al ADN y frecuencias de MN relacionados con GSTM1, GSTT1, GSTP1, CYP1A1 y CYP2E1en individuos expuestos37, como en el estudio reportado por Scarpato y col38, donde investigaron la asociación entre dos genes de detoxificación (GSTM1 Y GSTT1) y un biomarcador de aberraciones cromosómicas en agricultores expuestos a plaguicidas cuyos resultados no mostraron ninguna asociación entre exposición a plaguicidas y frecuencia elevada de aberraciones cromosómicas, resultados comoparables con otros estudios que tampoco encontraron asociación entre estos genes y un incremento en el daño citogenetico2,4.
En relación al genotipo GSTT1 nulo, éste presentó una frecuencia de MN igual al genotipo GSTT1 positivo. La combinación de los polimorfismos GSTM1/GSTT1 mostró que el genotipo nulo de ambos presenta frecuencia de MN ligeramente inferior en relación al genotipo positivo de ambos aunque sin diferencias estadísticamente significativas. Estos datos se asemejan a los resultados del estudio realizado por Kirsch-Volders35 donde los sujetos que tenían genotipos GSTM1 y GSTT1 nulos, mostraron frecuencias de micronúcleos más bajas en relación a sus contrapartes positivas cuando eran expuestos a genotoxinas ocupacionales (p=0,039).
La influencia del GSTM1 nulo sobre los ICH se mostró como un ligero incremento en las frecuencias de este parámetro, aunque sin significancia estadística, mientras que la influencia del GSTT1 nulo sobre los ICH se mostró con una ligera disminución en relación a los individuos GSTT1 positivos pero estadísticamente no significativa, como se puede observar en los resultados.
En relación a la influencia del genotipo GSTM1 nulo sobre el porcentaje de células con alta frecuencia de intercambios se observó con un incremento con significancia estadística (p=0.05), para corroborar esta asociación significativa se necesita aumentar el tamaño muestral. Al analizar los individuos con el genotipo GSTT1 nulo en relación a los individuos GSTT1 positivos se observó una disminución, pero con datos estadísticamente no significativos.
Los trabajos publicados sobre biomarcadores de susceptibilidad y su relación con plaguicidas son escasos y generalmente se relacionan con enfermedades y problemas en la salud. Se conocen algunos estudios que han relacionado las GSTs con los MN e ICH en poblaciones expuestas a plaguicidas38, 39, y en ningún caso se relaciona la frecuencia de MN en linfocitos con los alelos nulos GSTM1 y GSTT1, lo que concuerda con nuestros resultados. Quizá los MN constituyan un biomarcador difícil de relacionar con las GSTs. No obstante, dado el conocimiento que tenemos de estos polimorfismos y la función que realizan, junto con los resultados que relacionan incrementos de ICH y AC en fenotipos nulos a determinadas exposiciones40, 41 estos marcadores de susceptibilidad son útiles en estudios citogenéticos en humanos aportando una información de indudable interés.
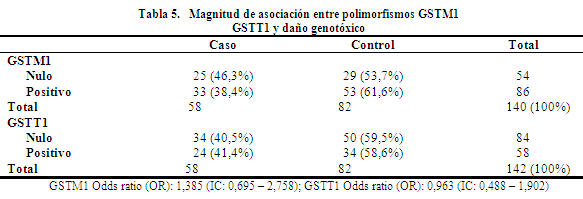
El análisis para el cálculo de la magnitud de asociación entre polimorfismos de las GSTs y daño genotóxico, muestra que la población con ausencia del GSTM1 incrementa el riesgo 0.38 veces más de presentar daño genotóxico en relación a la población que tiene el gen. Este análisis realizado para los polimorfismos de la GSTT1 no mostró ninguna asociación.
En relación a la magnitud de asociación entre polimorfismos GSTM1 y daño genotóxico medido por la prueba de MN, el valor de odds ratio con un intervalo de confianza del 95% (0,897 – 5,250) indica que la ausencia del gen incrementa 1.17 veces más la probabilidad de presentar daño cromosómico. En referencia al daño citotóxico (IDN) el valor de odds ratio con un IC al 95% (0,568 – 2,617) indica que la ausencia del gen GSTM1 incrementa 0.21 veces más el riesgo de presentar daño citotóxico. Sin embargo los valores de odds ratio encontrados al incluir el uno en el IC no pueden ser extrapolados a la población en general. Los resultados de un estudio realizado por Singh S. y cols.42 sugieren que los genotipos GSTM1 nulos, y una asociación de genotipos NAT2 acetilación lenta con CYP2C9 * 3 / * 3 o genotipos GSTM1 nulo puede modular el daño del ADN en los trabajadores ocupacionalmente expuestos a órganofosforados.
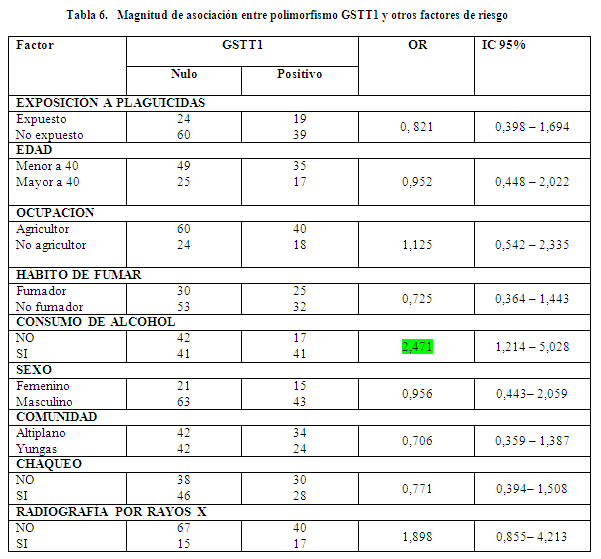
El análisis realizado sobre la magnitud de asociación entre polimorfismos de las GSTs y otros factores adicionales a la exposición a plaguicidas como la edad, la ocupación, el hábito de fumar, el consumo de alcohol, el sexo, el chaqueo y la exposición a rayos x, mostraron que, el consumo de alcohol es un factor de riesgo significativo (IC: 1,214 – 5,028), aumentando 1,47 veces la probabilidad de presentar daño genotóxico en personas con el gen GSTT1 nulo.
Existen trabajos reportados en la literatura que hacen referencia a que el genotipo GSTT1 nulo está involucrado en la modulación del riesgo de cáncer43,44. Este riesgo está fuertemente asociado al consumo de alcohol y al hábito de fumar que incrementan la carga de toxinas carcinogénicas. La detoxificación de tales compuestos dañinos ocurre generalmente por la vía II de detoxificación donde están involucradas enzimas como las GSTs.
AGRADECIMIENTOS
A todas las personas (agricultores, profesores y personal de salud) que participaron voluntariamente para la realización de este trabajo; a la Profesora Dra. Catarina Takahashi Universidad USP Ribeirao Preto - SP- Brasil por los reactivos para las pruebas de genotipificación y por su apoyo técnico; al Dr. Rafael Cervantes e Ing. Omar Huici del proyecto PLAGBOL por su colaboración para realizar las tomas de muestra de los participantes en el estudio.
REFERENCIAS
1. Jors E. Acute pesticide poisonings among small-scale farmers. La Paz County, Bolivia: University of Copenhagen;. Master thesis. 2004. [ Links ]
2. Au WW, Sierra-Torres CH, Cajas-Salazar N, Shipp BK, Legator MS. Cytogenetic effects from exposure to mixed pesticides and the influence from genetic susceptibility. Environ Health Perspec 1999; 107: 501–505. [ Links ]
3. Antoccia G.A., I.M. De Syllos Colus IM. 2000. Chromosomal aberrations analysis in a Brazilian population exposed to pesticides. Teratogenesis, Carcinogenesis, Mutagenesis. 20: 265-272.
4. Bolognesi C. 2003. Genotoxicity of pesticides: A review of human biomonitoring studies. Mutat. Res. 543: 251-272.
5. Garaj-Vrhovac V, Zeljezic D. 2002. Assessment of genome damage in a population of Croatian workers employed in pesticide production by chromosomal aberration analysis, micronucleus assay and Comet assay. J Appl Toxicol; 22:249–255. [ Links ]
6. Paramjit G., Danadevi K., Mahboob M., Rozati R., Saleha B., Rahman MF. 2003. Evaluation of genetic damage in workers employed in pesticide production utilizing the Comet assay. Mutagénesis. 18: 201-205. [ Links ]
7. Pastor S, Gutierrez S, Creus A, Cebulska-Wasilewska A, Marcos R. 2001. Micronuclei inperipheral blood lymphocytes and buccal epithelial cells of Polish farmers exposed to pesticides. Mutat Res 495:147–156. [ Links ]
8. Paz- y -Miño C., Dávalos MV., Sánchez ME, Arévalo M., Leone P. 2002. Should gaps be included in chromosomal aberration analysis? Evidence based on the comet assay. Mutat. Res. 516:57-61.
9. Cajas-Salazar N, Au WW, Sierra-Torres CH, Slama SA, Alpard SK, Tyring SK. 2003. Effects of epoxide hydrolase polymorphisms on chromosome aberrations and risk for lung cancer. Cancer Genet. Cytogenet; 145(2):97–102. [ Links ]
10. Long J, Covington F, Delaney-Black V, Nordstrom B. Allelic variation and environmental lead exposure in urban children. AACN Clinical Issues 2002; 13(4):550–556. [ Links ]
11. Cervantes R, Henao G, Morales L, Varona M, Condarco G, Huici O. 2006. Fortalecimiento de la vigilancia en salud pública de los plaguicidas entre Colombia y Bolivia Organización Panamericana de la Salud. Organización Mundial de la Salud; Instituto Nacional de Salud de Colombia; Instituto Nacional de Salud Ocupacional Bolivia. 12-14p. [ Links ]
12. Surrallés J. Antoccia A, Degrassi F. Tanzarella C. 1994. The effect of cytochalasyn –B concentration on the frequency of micronucleus induced by four standard mutagens. Results from two laboratories. Mutagenesis 9: 347-353, 1994. [ Links ]
13. Tirado N, Navia M.P, Cuti M. Pesquisa de daño genotóxico en personal médico y paramédico del Hospital Obrero N°1. 2002 Cuadernos del Hospital de Clínicas ISSN – 1562 – 6776 – 47 (2) p. 33-40.
14. M. Fenech, S. Bonassi, J. Turner, C. Lando, M. Ceppi, W.P. Chang, N. Holland, M. Kirsch- Volders, E. Zeiger, M.P. Bigatti, C. Bolognesi, J. Cao, et.al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes. Results of an international slide-scoring exercise by the HUMN project, Mutat. Res.2003; 534 (1–2) 45–64.
15. Perry P and Wolf R. 1974. New giemsa method for differential staining of sister chromatid. Nature 251: 156-158.
16. Carrano A.V., Moore D. H. The rationale methodology for quantifying sister-chromatid exchanges in humans Heddie J. A. eds. . New Horizons in Genetic Toxicology, Vol. 99: 267- 304, Academic Press New York 1982. [ Links ]
17. Gaspar PA, Hutz MH, Salzano FM, Hill K, Hurtado M, Petzl-Erler ML, y col. 2002. Polymorphisms of CYP1A1, CYP2E1, GSTM1, GSTT1, and TP53 genes in Amerindians. Am J Phys Antrophol; 119:249-56. [ Links ]
18. Joksic G, Vidakovic A, Spasojevic-Tisma V. 1997. Cytogenetic monitoring of pesticide sprayers. Environ Research. 75(2):113-118. [ Links ]
19. Titenko-Holland N., Windham G., Kolachana P, Reinish F, Parvatham S, Osorio A.M, Smith M.T. 1997. Genotoxicity of Malathion in human lymphocytes assessed using the micronucleus assay in vitro and in vivo: a study of malathion-exposed workers, Mutat. Res. 388: 85-95. [ Links ]
20. Calavert G M, Talaska G, Mueller C.A, Ammenheuser M.M, Au W.W, Fajen J.M, Fleming L.E, Briggle T, Ward E. 1998. Genotoxicity in workers exposed to methylbromide. Mutat. Res., 417: 115- 128 [ Links ]
21. Davies H.W, Kennedy S.M, Teschke K, Quintana P.J. E, 1998. Cytogenetic analysis of South Asian berry pickers in British Columbia using the micronucleus assay in peripheral lymphocytes, Mutat. Res. 416: 101 – 113. [ Links ]
22. Venegas W, Zapata I, Carbonell E, Marcos R,. 1998. Micronuclei analysis in lymphocytes of pesticide sprayers from Concepción, Chile. Teratolog. Carcing. Mutagen. 18:123-129. [ Links ]
23. Windham Gc. Titenko-Holland N, Osorio Am, Gettner S, Reinisch F, Haas R, Smith M. 1998. Genetic monitoring of malathion-exposed agricultural workers. Am J Med. 33(2):164-74. [ Links ]
24. Figgs L.W, Holland N.T, Rothman N, Zahm S.H, Tarone R.E, Hill R, Vogt R.F, Smith M.T, Boysen C.D, Holmes F.F, Van Dyck K, Blair A. 2000. Increased lymphocyte replicative index following 2,4 – dichlorophenoxyacetic acid herbicide exposure. Cancer Causes Control, 11: 373 – 380.
25. Rupa DS, Reddy PP, Sreemannarayana K, Reddi OS. 1991. Frequency of sister chromatid Exchange in peripheral lyjmphocytes of male pesticide applicators. Environ. Molec. Mutagen. 18: 1b-138. [ Links ]
26. Kirsch-Volders M, Fenech M. 2001. Inclusion of micronuclei in non-divided mononuclear lymphocytes and necrosis/apoptosis may provide a more comprehensive cytokinesis block micronucleus assay for biomonitoring purposes. Mutagenesis, 16: 51- 58. [ Links ]
27. Crossen P.E, Morgan W.F. 1978. Cytogenetic studies of pesticides and herbicides sprayers. N.Z. Med. J. 88:192 – 195. [ Links ]
28. Carbonell E, Xamena N, Creus A, Marcos R. 1993. Cytogenetic biomonitoring in a Spanish group of agricultural workers exposed to pesticides. Mutagenesis; 8:511–517 [ Links ]
29. Shaham, J., Kaufman, Z., Gurvich, R. and Levi, Z. 2001. Frequency of sister-chromatid exchange among greenhouse farmers exposed to pesticides. Mutat Res 491: 71-80.
30. Raunio H, Pursiainen KH, Antilla S, Hietanen E, Hirvonen A, Pelkonen O. Diagnosis of polymorphisms in carcinogen-activating and inactivating enzymes and cancer susceptibility - a review. Gene 1995; 159:113-21. [ Links ]
31. Sultatos LG.1992. Role of glutathione in the mammalian detoxification of organophosphorus insecticides. In: Organophosphorus Chemistry, Fate and Effects. New York: Academic Press; 155 – 168. [ Links ]
32. Sultatos LG. 1994. Mammalian Toxicology of organophosphorous pesticides J. Toxicol. Environ. Health, 43: 271 – 289. [ Links ]
33. Humbert R, Adler DA, Disteche CM, Hassett C, Omiecinski CJ, Furlong CE. 1993. The molecular basis of the human serum paraoxonase activity polymorphisms. Nat. Genet. 3: 73-76. [ Links ]
34. Pastor BS. 2002. Biomonitorización citogenética de cuatro poblaciones agrícolas Europeas, expuestas a los plaguicidas, mediante el ensayo de micronúcleos. Universidad Autónoma de Barcelona. Facultad de ciencias departamento de genética y de microbíologia. Grupo Mutagenesis. Tesis Doctoral.
35. Kirsch-Volder M., Mateuca R.A., Antonina R., Roelants M., Tremp A., Zeiger E., Stefano B. , Holland N., Peter W., Vande P., DeBoeck M., Godderis L., Haufroid V., Ishikawa H., Laffon B., Marcos R., Migliore L, Norppa H., Teixeira J., Zijno A., Fenech M. 2006. The Effects of GSTM1 and GSTT1 Polymorphisms on Micronucleus frequencies in Human Lymphocytes In vivo. Cancer Epidemiol Biomarkers Prev; 15(5). [ Links ]
36. Ghita C.M. Falck, Ari Hirvonen , Roberto Scarpato, Sirkku T. Saarikoski, Lucia Migliore, Hannu Norppa, 1999. Micronuclei in blood lymphocytes and genetic polymorphism for GSTM1, GSTT1 and NAT2 in pesticide-exposed greenhouse workers. Mutat. Res. 441: 225–237.
37. Juliana da Silva, Camila R. Moraes, Vanina D. Heuser, Vanessa M. Andrade, Fernanda R. Silva Katia Kvitko,Vanessa Emmel, Paula Rohr, Diana Lilian Bordin, Ana Cristina Andreazza, Mirian Salvador, Joao A.P. Henriques and Bernardo Erdtmann. Evaluation of genetic damage in a Brazilian population occupationally exposed to pesticides and its correlation with polymorphisms in metabolizing genes. Mutagenesis vol. 23 no. 5 pp. 415–422, 2008.
38. Scarpato R, Miliore L, Hirvonen A, Falck G, Norppa H. 1996. Cytogenetic monitoring of occupational exposure to pesticides: characterization of GSTM1, GSTT1 and NAT2 gentoypes. Environ. Mol. Mutagen., 27: 263 – 269.
39. Falck G.C, Hirvonen A, Scarpato R, Saarikoski S.T, Migliore L, Norppa H. 1999. Micronuclei in blood lymphocytes and genetic polymorphisms for GSTM1, GSTT1 and NAT2 in pesticide – exposed greenhouse workers. Mutat. Res., 44: 225-237.
40. Kelsey KT, Wienke JK, Ward J. 1995. Sister Chromatid exchanges, glutathione S-transferase θ deletion and cytogenetic sensitivity to diepoxybutane in lymphocytes from butadiene monomer production workers. Mutat. Res. 335: 267-273. [ Links ]
41. Scarpato R, Migliore L, Hirvonen A, Falck G, Norppa H. 1997. Influence of GSTM1 and GSTT1 polymorphism on the frequency of chromosome aberrations in lymphocytes of smokers and pesticide – exposed greenhouse workers. Mutat. Res. 389: 227-275 [ Links ]
42. Singh S, Kumar V, Singh P, Banerjee BD, Rautela RS, Grover SS, Rawat DS, Pasha ST, Jain SK, Rai A. 2011. Influence of CYP2C9, GSTM1, GSTT1 and NAT2 genetic polymorphisms on DNA damage in workers occupationally exposed to organophosphate pesticides. Mutat Res. 24;741(1-2):101-8.
43. Inoue M, Tajima K, Hirose K, Kuroishi T, Gao CM, Kitoh T. 1994. Life-style and subsite of gastric cancer - joint effect of smoking and drinking habits. Int J Cancer; 54:494-9. [ Links ]
44. Oude Ophui Michel B, ManniJohannes J, PetersWilbert H. M. Glutathione S-transferase T1 null polymorphism and the risk for head and neck cancer 2006. Acta oto-laryngol.vol.126,No3; 311-317.












