Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.20 n.1 La Paz jun. 2012
ARTÍCULO ORIGINAL
Valoración de la prueba de inmunofluorescencia indirecta para diagnóstico de Hepatitis autoinmune tipo 1, que utiliza como sustrato cortes histológicos de estómago de ratón
Indirect immunofluorescence test for diagnosis of autoimmune hepatitis type 1: histological substrate used as mouse stomach
Sandra Grisel Vargas Nattez, Heidy Garcia, Luis Fernando Sosa Tordoya
Instituto de Servicios de Laboratorio de Diagnóstico e Investigación en Salud. Facultad de Ciencias Farmacéuticas y Bioquímicas. Universidad Mayor de San Andrés. La Paz, Bolivia.
Dirección para correspondencia: Sandra Vargas. Av. Saavedra 2224 (Edificio SELADIS, piso 4, Laboratorio de bacteriología clínica).
Tel. 76296674
E mail: gris66samy@gmail.com
Recibido para publicación en: 26/04/12
Aceptado en: 26/06/12
RESUMEN
La hepatitis autoinmune (HAI) es una enfermedad caracterizada por la presencia de anticuerpos dirigidos contra los filamentos de actina. La determinación de los anticuerpos antimúsculo liso (AML), se utiliza para apoyar el diagnóstico de HAI tipo 1. El objetivo de este trabajo es valorar una prueba optimizada de Inmunofluorescencia Indirecta (IFI), usada para la identificación de AML en pacientes con diagnóstico presuntivo de HAI tipo 1; para lo cual se utilizó como sustrato cortes histológicos de estómago de ratón. Los resultados obtenidos con respecto al estándar de oro (Kit comercial IFI-AML) para la prueba optimizada mostraron 100% de sensibilidad, 95% de especificidad, 96% de eficiencia y valores predictivos positivos y negativo de 89.3% y 100% respectivamente, el likelihood ratio (LR+) fue de 18,3 y el LR- fue de 0. También se determinó el grado de correlación existente entre los resultados de ambas pruebas en evaluación estándar de oro y la prueba optimizada, para tal efecto se utilizó el índice de Kappa que mostró un valor de 0.82 (p< 0,005), correlación muy buena. Los ensayos de repetitividad y reproducibilidad mostraron un 100% y un 90% respectivamente, para el método optimizado. Con los resultados obtenidos del presente estudio se demuestra que la prueba optimizada puede usarse como prueba de tamizaje para el diagnóstico de HAI tipo 1 y que la solicitud de esta prueba debe ser necesariamente acompañada de pruebas de mayor especificidad y sensibilidad como ser la prueba de anticuerpos anti-mitocondriales (AMA), para poder confirmar o descartar la presencia HAI tipo1 o de cirrosis biliar primaria (CBP).
Palabras Clave: Hepatitis autoinmune tipo I, cirrosis biliar primaria, test diagnóstico.
ABSTRACT
Autoimmune hepatitis (AIH) is a disease characterized by the presence of antibodies directed against actin filaments. The determination of smooth muscle antibodies (SMA) is used to support the diagnosis of type 1 AIH. The aim of this study was to assess an optimized indirect immunofluorescence test (IFI) used for the identification of AML in patients with presumptive diagnosis of type 1 AIH, for which a substrate based on histological sections of mouse stomach was used. The results obtained with respect to the gold standard (IFI-AML commercial kit) for the optimized test showed 100% sensitivity, 95% specificity, 96% efficiency, and positive and negative predictive values of 89.3% and 100%, respectively, the likelihood ratio (LR+) was 18.3 and the LR− was 0.0. Also, the degree of correlation between the results of the two tests compared to the gold standard and the optimized test was determined; for this purpose, we used the Kappa index, showing a value of 0.82 (p<0.005), a very good correlation. The repeatability and reproducibility tests were 100% and 90%, respectively, for the optimized method. The results obtained in this study show that the optimized test can be used as a screening test for diagnosis of type 1 AIH, and the this test must be accompanied by a test of greater specificity and sensitivity such as anti-mitochondrial antibodies (AMA) in order to confirm or rule out type 1 AIH or primary biliary cirrhosis (PBC).
Key Words: Type I autoimmune hepatitis, primary biliary cirrhosis, diagnostic test.
INTRODUCCIÓN
La hepatitis autoinmune es una enfermedad hepática crónica que se caracteriza por la destrucción gradual de los hepatocitos que conduce hacia fibrosis y cirrosis hepática. Esta enfermedad requiere de un diagnóstico rápido y certero, ya que el 40% de los pacientes con enfermedad severa no tratada mueren a los 6 meses del diagnóstico. De los que sobreviven, el 40% desarrollan cirrosis, el 54% desarrollan várices esofágicas a los 2 años después de la cirrosis; y el 20% de los individuos con várices esofágicas mueren por hemorragias. 1,2,3,4 Las enfermedades autoinmunes en la mayoría de los casos son difíciles de diagnosticar usando solo la sintomatología del paciente, la hepatitis autoinmune no es la excepción. Para a hacer un buen diagnóstico, tratamiento y control de la enfermedad, se necesita contar con una batería de pruebas de laboratorio que discrimine entre los diferentes tipos de enfermedades autoinmunes hepáticas, entre las más importantes se encuentran la detección de: anticuerpos antinucleares (ANA), anticuerpos antimitocondriales (AMA), anticuerpos antimúsculo liso (AML) y anticuerpos anti microsomas hepáticos y renales (sigla en inglés LKM). Estas pruebas deben presentar la máxima sensibilidad y especificidad posible para permitir hacer el diagnóstico y control del paciente de manera más eficiente. 5,6
La prevalencia e incidencia de la hepatitis autoinmune a nivel mundial es poco conocida. En la mayoría de los estudios realizados en Europa, la incidencia de HAI oscila entre 0.8-1.9 por 100,000 habitantes existiendo predominio del sexo femenino.7,8. En Bolivia, hasta el momento, no se han encontrado reportes acerca de la prevalencia de esta enfermedad. En la ciudad de La Paz el laboratorio de Histocompatibilidad e Inmunogénetica del Instituto SELADIS en el periodo de enero del 2009 a enero del 2010 se recibió alrededor de 80 solicitudes de determinación de anticuerpos antimusculo liso (AML), de las cuales 25 fueron confirmadas como positivas por el Kit comercial IFI-AML, dato que puede ser tomado en cuenta para posteriores estudios.
En las enfermedades autoinmunes hepáticas, la respuesta inmune humoral y/o celular puede estar debida a reacción cruzada por homología molecular con antígenos provenientes de patógenos (Virus del Epstein Bar, Neurospora y enterobacterias como E. coli)2,7 o estar dirigida contra otras antígenos propios del hígado, lo que constituiría una enfermedad autoinmune hepática. Si el blanco de la respuesta autoinmune son los conductos biliares, se asume como una Cirrosis Biliar Primaria (CBP) o Colangitis Esclerosante Primaria (CEP); y si los hepatocitos son los afectados, entonces se habla de HAI. 7,8,9
Los AML se utilizan principalmente para apoyar el diagnóstico de HAI tipo I, pero al igual que los ANA, pueden catalogarse como una prueba de tamizaje ya que su presencia no se asocia con la gravedad de la enfermedad o con la respuesta al tratamiento inmunosupresor. Este hecho se debe principalmente a que los AML no son específicos de la HAI, pudiendo detectarse en otras enfermedades hepáticas de naturaleza autoinmune frecuentemente mononucleosis infecciosa o asociarse a otras enfermedades autoinmunes como enfermedad tiroidea, esclerodermia, artritis reumatoidea, y lupus eritematoso sistémico, entre otras. En general, el curso de estas enfermedades inmunológicas es independiente del curso de la CBP. 10,11 Pero aun así, su presencia se considera de apoyo en el diagnóstico y descarte de cirrosis biliar primaria en caso de anticuerpos ANA y AML negativo. Además, es importante para la diferenciación entre la hepatitis autoinmune de tipo 1 de la de tipo 2. La hepatitis autoinmune de tipo 2 no presenta los AML1,12.
Otro parámetro no menos importante que debe ser tomado en cuenta es que, estas pruebas tengan un costo accesible para los pacientes, cabe destacar que utilizar un kit comercial para la determinación de anticuerpos antimúsculo liso, cuesta alrededor de 45 bolivianos por paciente y la realización de esta prueba con los materiales y reactivos del laboratorio cuesta 15 bolivianos (tres veces menos).
En el laboratorio de Histocompatibilidad e Inmunogenética del SELADIS-FCFB-UMSA, se han estandarizado, optimizado y validado una serie de pruebas de laboratorio que apoyan en el diagnóstico enfermedades autoinmunes que afectan al hígado. En el caso de la hepatitis autoinmune se ha optimizado una prueba de inmunofluorescencia que utiliza como sustrato, cortes histológicos a congelación de estómago de ratón, para detectar la presencia de AML; prueba optimizada a la cual hasta la fecha no se realizaron estudios para determinar su valor diagnóstico. El presente trabajo de investigación tiene como objetivo valorar la prueba de inmunofluorescencia indirecta para el diagnóstico de Hepatitis Autoinmune que utiliza como sustrato cortes histológicos de estómago de ratón frente a otro método comercial IFI-AML que utiliza el mismo sustrato. Para alcanzar este objetivo se determinaron la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), repetitividad, reproducibilidad y la eficacia del método optimizado en el laboratorio.
MATERIAL Y MÉTODOS
Muestras
Panel de sueros de individuos con la enfermedad. Constituido por un panel de 25 sueros de pacientes de ambos sexos, con diagnóstico de Hepatitis autoinmune, confirmados por estudios clínicos e inmunométricos (prueba de IFI), que acudieron al laboratorio de Histocompatibilidad e inmuogenética del instituto SELADIS, durante las gestiones 2009 a 2010.
Panel de sueros de individuos sin la enfermedad. Constituido por un panel de 55 sueros de pacientes de ambos sexos, en los cuales se demostró clínica e inmunométricamente la ausencia de anticuerpos anti músculo liso utilizando la prueba de IFI, que acudieron al laboratorio de Histocompatibilidad e inmuogenética del instituto SELADIS, durante las gestiones 2009 a 2010.
Todos los pacientes de quienes sus muestras de suero fueron utilizadas, dieron su consentimiento informado para la utilización de la misma en el presente estudio. El tamaño muestra fue definido de acuerdo al Manual de procedimientos de control de calidad para los laboratorios de serología de los bancos de sangre, como una publicación oficial de la Organización Panamericana de la Salud (OPS, 1994)13, que sugiere que para la validación de un procedimiento serológico frente a otro similar normalizado, el tamaño de muestra que constituye un panel de sueros positivos y negativos debe poseer por lo menos 50 sueros,
Preparación de la globulina antihumana, marcada con fluoresceína. Para el inicio de la investigación de anticuerpos antimúsculo liso por inmunofluorescencia se realizó la determinación del título óptimo de utilización del conjugado mediante el uso de sueros control positivo y negativo provenientes del Kit comercial de IFI para AML (ORGENNICS).
Para ello se realizaron diferentes diluciones (1/110, 1/100, 1/90 y 1/80) del conjugado (anti IgG humana- FITC) usando como diluyente PBS IFI (1X, pH 7.4 y concentración 0,015 M ), con las cuales se buscó el título con los patrones fluorescentes conocidos de los sueros control positivo y negativo.
Sustrato: cortes de tejido de estómago de ratones. Se realizaron cortes de tejido de estómago de ratón de la especie Swiss Albinos de 20 gramos de peso cada uno; obtenidos del bioterio de la Facultad de Ciencias Farmacéuticas y Bioquímicas.
Se utilizó un total de 10 ratones, a los que se les extrajo el estómago, mismo que se conservó en carboximetilcelulosa (CMC) al 4% en frío, para mantener la viabilidad de las células del tejido. Posteriormente éstos se almacenaron a -20 ºC hasta el momento de su uso.
Preparación de las improntas con cortes histológicos de estómago de ratón. Se realizaron cortes histológicos (improntas) de estómago de ratón con un espesor aproximado de 5 micras a -20ºC con ayuda de un criostato (Shanon, UK). Las improntas se depositaron sobre un portaobjetos y fueron llevadas a -20ºC. Posteriormente fueron fijadas durante 10 minutos con acetona fría (-20ºC), luego se hidrataron por 10 minutos sin agitación en una caja Koplin con PBS IFI, para finalmente secarlas y colocarlas en cámara húmeda para evitar la desecación del tejido en las improntas.
Siembra de los sueros. Se realizaron diluciones seriadas (1/10, 1/20, 1/40, 1/80) de sueros del panel, sueros control positivo y control negativo, con el tampón PBS IFI, para un volumen final de 200 µL.
Se depositaron 30 µL de cada una de las diluciones sobre los cortes de tejido, se incubaron por 30 minutos a temperatura ambiente. Durante los últimos 10 minutos, se preparó el diluyente del conjugado Azul de Evans - PBS IFI en una relación 100 µL de azul de Evans (0,4%) más 3.5 mL del tampón PBS IFI. Posteriormente se realizó una dilución 1/80 del conjugado (Anti IgG marcado con fluoresceína), pasado los 30 minutos, se lavaron las placas colocándolas en jarra Koplin con tampón PBS IFI por 10 minutos. Luego se añadió 30 µL del conjugado diluido a cada una de las improntas y se incubó 30 minutos a temperatura ambiente en oscuridad. Se repitieron los pasos de lavado y secado y se le añadió 1 gota de medio de montaje (1 vol de glicerina p.a.: 9 vol de PBS IFI) y se selló con un cubreobjetos. Las improntas se guardaron en oscuridad hasta el momento de la lectura en el microscopio de luz UV (Olympus BH-2).
Evaluación de la técnica
Las muestras fueron procesadas tanto por el método comercial como por el método optimizado en diferentes tiempos y por dos operadores diferentes.
Rango de trabajo, Una vez procesado el total de las muestras por el método comercial: IFI - AML Kit (Trinity Biotech) para la detección de Anticuerpos anti musculo liso (estándar de oro), se procedió a evaluar las muestras por el método optimizado; La lectura de los resultados fue realizada por un operador diferente quien no conocía los resultados de las pruebas obtenidas por el método comercial.
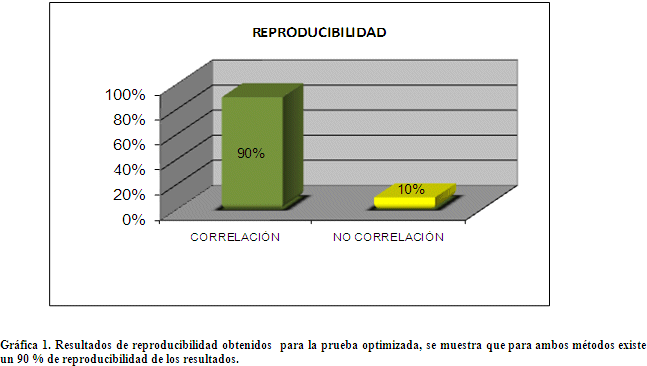
Reproducibilidad, Para determinar la reproducibilidad de los resultados emitidos por la prueba de inmunofluorescencia optimizada, se seleccionaron 20 muestras al azar y se determinó la presencia de AML en dos diferentes ensayos y por diferentes operadores.
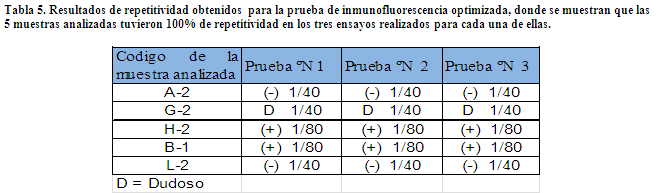
Repetitividad, Para determinar la repetitividad de los resultados emitidos por la prueba de inmunofluorescencia optimizada, se seleccionaron 5 muestras al azar y se determinó la presencia de AML en tres diferentes ensayos y por un mismo operador.
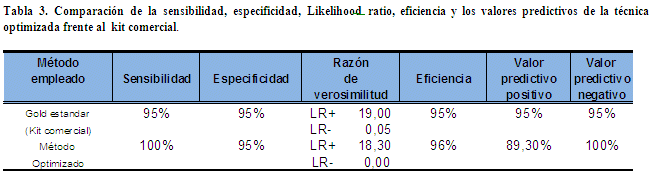
Análisis estadístico, Para el análisis estadístico de los resultados se utilizó una tabla de contingencia (Tabla 2) elaborada con ayuda del programa Microsoft Excel 2007, en la que se compararon los resultados del método comercial con los obtenidos mediante la técnica optimizada; Se utilizaron las siguientes fórmulas probabilísticas: sensibilidad, especificidad, eficiencia, valor predictivo positivo, valor predictivo negativo, Chi cuadrado, índice Kappa y el likelihood ratio (Tabla 3 y 4).
Interpretación de los resultados. Títulos iguales o menores a 1/20 fueron considerados negativos para Hepatitis autoinmune. Títulos iguales o mayores a 1/40 fueron considerados positivos para Hepatitis autoinmune.


RESULTADOS
Titulación del conjugado. Después de realizar el proceso de titulación del conjugado, se determinó que el título óptimo era de 1/80. A esta dilución del conjugado se encontró la intensidad fluorescente establecida por el fabricante (Trinity Biotech) para los sueros control positivo y negativo utilizado en el presente estudio.

Sensibilidad y especificidad de la prueba de AML-IFI optimizada
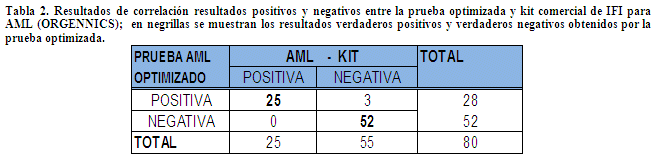
Correlación de resultados entre el método estándar y el método optimizado. El índice de Kappa encontrado para la correlación de resultados entre el método optimizado y en método estándar (kit comercial) fue de 0.82 (p>0,005), valor que corresponde a una concordancia muy buena. Por la prueba Chi cuadrado se obtuvo un resultado de 60.29 (p>0,005), valor mayor al valor crítico de 3.84 que se espera en casos de que exista independencia (sin relación) entre los resultados de dos métodos de diagnóstico. Por tanto, se asume que existe una relación de resultados entre ambos métodos.

Resultados obtenidos de las pruebas de repetitividad y reproducibilidad
A. REPETITIVIDAD
B. REPRODUCIBILIDAD
DISCUSIÓN
Con los resultados obtenidos en el presente estudio, se ha observado que la técnica optimizada alcanza una sensibilidad del 100% y una especificidad del 95%, lo que significa que este método tiene una alta capacidad de seleccionar a pacientes con sospecha de HAI tipo I. Sin embargo, cuando se obtiene un resultado positivo por cualquiera de los dos procedimientos de AML estudiados (Técnica optimizada o el kit comercial), este resultado debe correlacionarse con la clínica del paciente y otras pruebas de laboratorio de apoyo, ya que existe un 5% de resultados falsos positivos y la probabilidad del fenómeno de sobreposición con la Cirrosis biliar Primaria (AMA positivo)14,15. Las técnicas de inmunofluorescencia en general se consideran de tamizaje por el hecho de ser semicuantitativas. En un estudio similar Sosa et al., 2001 verificó que utilizando cortes histológicos para la determinación de anticuerpos antinucleares ANA se obtenía un alto porcentaje de falsos positivos ya que la especificidad de la prueba no superaba el 69%, y que a raíz de estos resultados obtenidos sugirió que para confirmar o descartar el resultado era necesario aplicar una prueba confirmatoria que presente mayor especificidad como ser la detección de anti-ds-DNA por ELISA16. Estos resultados confirman que el diagnóstico de la hepatitis autoinmune no solo debe basarse en la prueba de inmunofluorescencia, sino que es necesario utilizar otros marcadores como ser los ANA (realizados por IFI), AMA (realizado por ELISA) y ELISA frente a F-actina que recientemente ha sido descrito como un marcador específico de la enfermedad. El diagnóstico de HAI debe manejarse al igual que el resto de las enfermedades autoinmunes en donde es necesario evaluar al menos tres marcadores de laboratorio para confirmar o descartar una patología17,18.
En la fase experimental se encontró que, para evitar que los cortes histológicos se desprendan del portaobjetos durante los lavados con PBS IFI era necesario realizar una buena fijación de éstos sobre el porta objetos, para ello la acetona fría (-20 ºC) resultó ser un buen fijador. El preincubar 30 minutos las improntas a -20 ºC mejora el proceso de fijación del corte histológico al vidrio. Por otra parte, el grosor de los cortes no debe superar las 5 micras, caso contrario, se hace más difícil visualizar las estructuras de músculo liso del estómago de rata y se podría a dar un resultado erróneo de la prueba. También, se debe tomar en cuenta que para realizar una interpretación óptima de la lectura microscópica se debe evitar la desecación de las placas debido a que es necesario recorrer todos los campos para hacer una buena lectura y visualización del patrón fluorescente característico de AML.
Cuando se realiza un test diagnóstico para evaluar métodos diferentes frente a un mismo panel de sueros de referencia, se usan indicadores estadísticos de concordancia como ser el índice de Kappa. El análisis de concordancia aplicado entre el método optimizado frente al kit comercial, determinó que existía un índice Kappa de 0.82 (p>0,005), valor que corresponde a una concordancia muy buena entre ambos métodos. Similar hallazgo fue encontrado en los estudios de correlación obtenidos por Poma et al., 2009 quien realizó la evaluación de tres sustratos empleados en la prueba de IFI que mide anticuerpos antimitocondriales para el diagnóstico de cirrosis biliar primaria, donde encontró que la concordancia entre el método que usaba cortes criostáticos de riñón de ratón y el método de ELISA era muy buena ya que el índice Kappa fue de 0.84 (p>0,005). 19
Para validar plenamente un método se debe determinar la repetitividad y reproducibilidad de resultados del método. El método optimizado tiene un porcentaje de reproducibilidad del 90% y un 100% de repetitividad. Si sumamos este antecedente a los resultados de sensibilidad, especificidad , eficiencia del método del 96% (p>0,005) y los valores de LR+ = 0.18 y el OR- = 0 que nos dice que para que un método diagnóstico tenga utilidad se espera que su LR+ sea alto (idealmente> 5-10) y su LR- sea bajo (< 0,1-0,2); con todos estos datos obtenidos podemos constatar que el método optimizado está validado para ser empleado en el diagnóstico de laboratorio, pero siempre tomando en cuenta que para el correcto diagnóstico de una enfermedad autoinmune se requiere correlacionar la clínica con los hallazgos de laboratorio.
REFERENCIAS
1. Sherlock S. Primary biliary cirrosis, primary sclerosing cholangitis and autoimmune cholangitis: Clin Liver Dis.2000; 4:97-113. [ Links ]
2. Parés A. Hepatopatía autoinmune y anticuerpos antitisulares. Unidad de Hepatología: CIBEREHD: Progresos en hepatología. 2008. [ Links ]
3. Garassini M.A, Garassini ME . Hepatitis autoinmune: GEN. 1994; 48: 256-263.
4. Strassburg CP, Manns MP. Hepatitis autoinmune: Best Pract. Res Clin Gastroenterol. 2003; 17: 291-306.
5. Czaja A. Chronic Active Hepatitis: The challenge for a new nomemclature. An Interm Med. 1993; 119:510-517. [ Links ]
6. Figueroa R. Hepatitis Crónica. Rev Gastroent Perú. 1995; 1:577-588. [ Links ]
7. Silva C. Daño hepático crónico. 2004; 194 -198.
8. Loja D, Vilca V, Aviles G. Hepatitis autoinmune. Rev Med Hered. 1997; 123:122-125. [ Links ]
9. Mesa L, Cedeño M, Covos E, Montero E. Cirrosis biliar primaria. 4º ed. Bogota: Medisan; 2007. [ Links ]
10. Mesa L, Cobos E, García J, Zayas JR, Mesa M. Cirrosis biliar primaria. [articulo en linea]*: 2007 junio. [Acceso 3 de enero 2009]*. MEDISAN. 2007; 11(3). Disponible en: http://bvs.sld.cu/revistas/san/vol11_3_07/san12307.htm
11. Idrovo C . Cirrosis biliar primaria: tratamiento. Hospital Universitario Fundación Santa Fe Bogotá; 2008. [ Links ]
12. Valverde M, Gorráez MT. Síndrome de sobreposición: hepatitis autoinmunitaria-cirrosis biliar primaria. Patología [revista en Internet]* 2008[Acceso 4 de abril 2009; 46(2): 119. Disponible en : http://new.medigraphic.com/cgi-bin/resumenMain.cgi?IDARTICULO=19734
13. Miceli INP. Guía práctica de investigación en salud. Medicina (B. Aires). [revista en Internet]* .2009 Feb-Mar. [acceso diciembre 2009]*; 69(1): 209-210. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802009000100020
14. Infante M. Hepatitis autoinmune: Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto". Med clin(cub): 2000;49(1):49-56. [ Links ]
15. Longhi MS, Ma Y, Mieli-Vergani G. Etiopathogenesis of autoimmune hepatitis: Hepatology autoinmuniity; 2010; 7–14. [ Links ]
16. Sosa L.F. Validación de métodos serológicos que se emplean para el diagnóstico de enfermedades sistemicas definidas: Lupus eritematoso sitemico (LES).La Paz – Bolivia: Instituto de investigación SELADIS, Universidad mayor de San Andres; 2001. [ Links ]
17. Guerrero I, Montaño A, Gallegos JF, Weimersheimer M. Hepatitis autoinmune y colangitis esclerosante primaria ¿asociación dependiente o independiente?. Rev Gastroenterol Mex. 2007; 3: 72. [ Links ]
18. Donadson PT. Genetics in autoimmune hepatitis: Semin Liver Dis.2002;222:353–64. [ Links ]
19. Poma JP. Evaluación de 3 sustratos empleados en la prueba de inmunofluorescencia que mide anticuerpos antimitocondriales para el diagnóstico de cirrosis biliar primaria. La Paz – Bolivia: Instituto de investigación SELADIS, Universidad mayor de San Andrés; 2009. [ Links ]












