Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.19 n.2 La Paz dic. 2011
ARTÍCULO ORIGINAL
Actividad tripanocida y antioxidante in vitro de los extractos etanólicos de Caesalpinia pluviosa DC. y Astronium urundeuva (Allemâo) Engl.
Trypanocidal and antioxidant in vitro activities of ethanolic extracts from Caesalpinia pluviosa DC. and Astronium urundeuva (Allemâo) Engl.
Victoria Muñoz Ortiz 1, Patricia Mollinedo2, Patricia Garcia2
1 Universidad Mayor de San Andrés, Facultad de Medicina, Departamento de Patología. Av. Saavedra No 2246, La Paz, Bolivia.
2Universidad Mayor de San Andrés, Facultad de Ciencias Puras, Carrera de Química. La Paz, Bolivia.
Dirección para correspondencia: Victoria Muñoz Ortiz. Departamento de Patología, Facultad de Medicina, Universidad Mayor de San Andrés. Av. Saavedra No 2246, La Paz, Bolivia.
E mail: victoriamuo@hotmail.com
Recibido para publicación en: 16/12/10
Aceptado en 30/09/11
RESUMEN
Caesalpinia pluviosa DC y Astronium urundeuva (Allemâo) Engl. , son plantas medicinales de uso tradicional en Bolivia. Para determinar la actividad tripanocida y antioxidante in vitro de los extractos etanólicos de estas especies vegetales, se realizó la medición de la inhibición del desarrollo in vitro de tripomastigotes de Trypanosoma cruzi, clon CL Brener. Los métodos antioxidantes fueron 1,1-difenil-2-picril-hidrazil (DPPH) y 2,2-azino-bis (3- etilbenzo-tiazolina-6-sulfónico ácido) diamonio sal (ABTS). El extracto etanólico de la corteza de Caesalpinia pluviosa DC tuvo la mayor actividad tripanocida (CI50 = 55 µg/ml +7,07) y antioxidante (CI50 = 0,166mg/ml por el método ABTS y CI50 = 1,30 por el método DPPH). En conclusión, este estudio revela que los extractos de Caesalpinia pluviosa DC y Astronium urundeuva (Allemâo) Engl., tienen un efecto tripanocida y antioxidante in vitro, justificando el uso tradicional de la planta y constituyéndose en excelentes candidatos para completar estudios biológicos in vivo y químicos. Esta asociación de actividad antioxidante-tripanocida, es una nueva perspectiva para el tratamiento de la enfermedad de Chagas.
Palabras Clave: Actividad tripanocida; Antioxidante; in vitro; plantas medicinales; Bolivia.
ABSTRACT
Caesalpinea pluviosa DC and Astronium urundeuva (Allemâo) Engl., are used in Bolivia, as medicinal plants. In order to determine the in vitro trypanocidal and antioxidant activity of ethanolic extract from Caesalpinia pluviosa DC (Steam Bark) and Astronium urundeuva.(Allemâo) Engl. The inhibitory effect on the growth of tripomastigotes (Trypanosoma cuzi, clone CL Brener), was evaluated. The antioxidant capacity was evaluated by 1,1-diphenyl-2-pycril-hydrazil (DPPH) and 2, 2-azino-bis(3-_ethylbenzo-tiazolin-6-sulfonic acid) diamonium salt (ABTS) methods. Ethanolic extract of Caesalpinia pluviosa DC showed the greatest trypanocidal activity (CI50 = 55 µg/ml +7.07) and antioxidant capacity (CI50 = 0,166 mg/ml by the ABTS method and50 IU = 1.30 by the DPPH method). According to our results the polar extracts of Caesalpinia pluviosa DC and Astronium urundeuva (Allemâo) Engl., are excellent candidates to complete in vivo biological and chemical studies. In addition, the combination of antioxidant-trypanocidal activities is a new perspective for the treatment of Chagas disease.
Key Words: Trypanocidal activity; Antioxidant; In vitro, Medicinal plants; Bolivia
INTRODUCCIÓN
Pese a los adelantos tecnológicos de los últimos años, la enfermedad de Chagas esta presente en el continente americano, desde hace mucho más de 100 años1.
Doce millones de personas están afectadas en el mundo. Bolivia, presenta la tasa más alta de infección de América Latina en esta zoonosis, el 50% del territorio es endémico, el 20% de la población estaría infectada, el 48% de los donadores de sangre presentan una serología positiva2. Prácticamente, en países como Uruguay, Chile y Brasil se interrumpió la propagación vector-humano3. En Bolivia persiste la presencia vectorial incluso en zonas populares urbanas4.
Las limitaciones en el tratamiento son evidentes, las drogas sintéticas como el Nifurtimox y el Benzanidazol, tienen mayor efectividad en la fase aguda de la enfermedad y lamentablemente su eficacia es limitada en la fase crónica, así mismo presenta importantes efectos no deseados5.
Por otra parte, los radicales libres y especies reactivas de oxigeno (EROs) son ampliamente conocidos por inducir patogénesis celular y de tejido, dando lugar a una variedad de enfermedades humanas como el cáncer, procesos inflamatorios, enfermedades cardiovasculares, neurodegenerativas y procesos de envejecimiento6.
Las sustancias antioxidantes pueden bloquear la acción nociva de los radicales libres, destoxificando el organismo. La búsqueda de antioxidantes a partir de extractos de plantas se ha intensificado en los últimos años.
Se ha determinado que la actividad antioxidante de las plantas se debe principalmente a compuestos fenólicos como los flavonoides, ácidos fenólicos, taninos y diterpenos fenólicos7.
Caesalpinia pluviosa DC., árbol tropical y subtropical, de aproximadamente 8 m de alto, pertenece a la familia Leguminosae, conocido en el oriente boliviano con el nombre común de Momoqui, la corteza, se utiliza principalmente en los procesos diarreicos y en dolores de la parta baja de la espalda, de los riñones y como diurético8.
Varios estudios confirman que diferentes extractos de hojas, frutos, raíces y corteza de especies vegetales pertenecientes al género Caesalpinia tienen una variedad de propiedades medicinales como la antiinflamatoria, antitumoral, antipirética, analgésica, inmunomoduladora, filaricida, antibacteriana, antimicótica, antiparasitaria y antiviral9,10,11,12,13,14,15,16.
La actividad antioxidante fue la más reportada en diferentes especies del género Caesalpinia tales como C. pyramidalis C. bonducella, C. digyna, C. crista, C. benthamiana, C. sappan y C. pulcherrima17,18,19,20. Las actividades biológica reportadas para la especie Caesalpinia pluviosa son la antimalárica y citotóxica21,22.
Astronium urundeuva (Allemâo) Engl. (Anacardiaceae), árbol de 5 m de alto, se encuentra en los departamentos de Beni, Santa Cruz y Tarija, conocido con el nombre común de Cuchi, su corteza se utiliza principalmente, para las fracturas, traumatismos, cortaduras heridas, procesos inflamatorios, acelera la cicatrización, para tratar úlceras en el estómago en los procesos hemorrágicos en las mujeres con menstruaciones abundantes8. También se reporta la actividad antioxidante, inmunomoduladora, citotóxica y para el tratamiento las úlceras. 22,23,24,25.
El uso de la medicina tradicional ampliamente distribuido, en particular, la utilización de las plantas medicinales, constituye una fuente de tripanocidas y antioxidantes naturales que deberían servir como cabeza de serie para el desarrollo de nuevas drogas. Después de una búsqueda bibliográfica importante en diferentes bases de datos constatamos que existe ausencia de estudios de actividad tripanocida para ambas especies estudiadas.
El propósito de este estudio es el de determinar la actividad dual, tripanocida y antioxidante de Caesalpinia pluviosa y Astronium urundeuva.
MATERIAL Y MÉTODOS
Plantas. Las hojas y corteza de Caesalpinia pluviosa y Astronium urundeuva se recolectaron en la Provincia Ballivian, departamento del Beni, en la comunidad de San Josecito. Las muestras de herbario para su identificación por especialistas, fueron depositadas en el Herbario Nacional de Bolivia en La Paz. Los números de vouchers fueron VM6 y VM9 respectivamente.
Preparación de los extractos. La hojas y corteza de la planta fueron secadas y molidas y maceradas con etanol-agua (70-30%) por 48 horas a 25 °C, evitando la radiación de la luz del día. La solución acuosa etanólica obtenida, fue evaporada al vacío y el residuo fue evaluado 21.Ratones y parásitos. Se utilizaron los ratones Swiss de 6-8 semanas de vida, infectados con el clon CL Brener de Trypanosoma cruzi26. La cepa del parásito, fue obtenida del Instituto de Investigaciones en Ciencias de la Salud. Departamento de Medicina Tropical, Asunción Paraguay, se la mantuvo en los ratones por inoculación intraperitoneal cada 14 días.
Ensayo biológico, contra las formas tripomastigotes. Los extractos de plantas a evaluar se disolvieron en dimetilsulfoxido (DMSO) y se prepararon diferentes concentraciones (500, 250, 100, 50 y 10 µg/ml) con el medio de cultivo LIT (Liver Infusion Triptosa), estas concentraciones fueron mezcladas con igual volumen de sangre parasitada. La densidad del parásito calculada fue de 2x105/0.1ml para cada alveolo, se incluyeron alvéolos controles positivos para el DMSO y controles negativos con violeta de genciana. Después de incubar a 4°C por 24 horas, se cuantificó la suspensión microscópicamente, utilizando una cámara de Neubauer. 5 µl de sangre diluida 1:5 en solución tampón de lisis (0,75% NH4Cl, 0,2% Tris pH 7.2)27. Se determinó la CI50 (concentración inhibitoria del 50% del desarrollo de los tripomastigotes) por el método gráfico28.
Pruebas antioxidantes in vitro. Método 1,1-difenil-2-picril-hidrazilo (DPPH). 2,7 mg de extracto etanólico crudo de las plantas fueron disueltos en 30µL de DMSO (GFS CHEMICLAS®) diluidos en 970µl de H2O destilada convirtiéndose en la solución madre (C1).
Los extractos se prepararon a seis concentraciones (2,7; 0,27; 0,135; 0,07; 0,04 y 0,027mg/ml) con metanol p.a. La solución DPPH (Sigma Chemicals D-9132) fue preparada a la concentración de 0.004% (Peso/volumen) también en metanol p.a. (0,0038g DPPH para 95ml de metanol).
La medición de la actividad antioxidante se realizó adicionando 1ml de solución DPPH a 0,01ml de las soluciones de los extractos a evaluar.
Después de 30 min. de la reacción, se determinó la absorbancia a 517nm. en el espectrofotómetro ultra violeta visible (Type Helios Alpha Nº UVA 080334). Se usó como blanco metanol p.a. como control positivo quercetina (Sigma Q-0125, 25g Lot. 90 K) y como control negativo DPPH puro.
Las pruebas para cada extracto a evaluar se realizaron por triplicado. Se obtuvieron los valores de CI50 (Concentración inhibitoria del 50%) a través de gráficas tomando en cuenta el porcentaje de inhibición y la concentración29.
Método 2,2-azino-bis(3- etilbenzo-tiazolina-6-sulfonico acido) diamonio sal (ABTS). El radical ABTS+ se formó tras la reacción de ABTS (7mM) con persulfato potásico (2,45mM, concentración final) incubados a temperatura ambiente y en oscuridad durante 16 hs. Este radical se diluyó con etanol hasta obtener un valor de absorbancia de 0,700 ± 0,100 a 754nm (longitud de máxima absorción). Las muestras filtradas se diluyeron con etanol hasta que se obtuvo un 20-80% de inhibición comparadas con la absorbancia del blanco tras añadir 20μL de la muestra.
A 980μl de dilución del radical ABTS+ así generado se determina la absorvancia a 754nm a 30ºC, se añade 20μL de la muestra y se mide nuevamente la absorvancia pasado 1 minuto. La absorbancia fue medida después de 4 minutos. El antioxidante sintético Trolox de referencia a concentración de 0-15μM (concentración final) en etanol se ensayó en las mismas condiciones y los resultados son expresados en TEAC (actividad antioxidante equivalente a Trolox) 30.
RESULTADOS
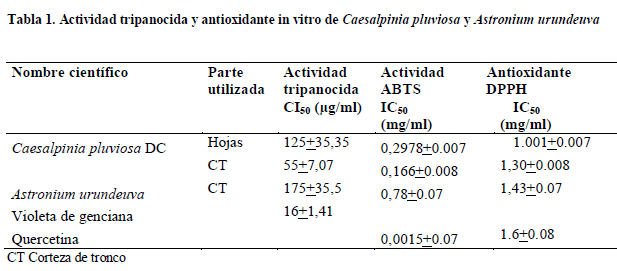
Las concentraciones inhibitorias del 50% del desarrollo de los tripomastigotes de T. cruzi, de los extractos etanólicos de las 2 plantas medicinales estudiadas, se expresan en la Tabla 1. El extracto etanólico de la corteza de Caesalpinia pluviosa tuvo la mayor actividad tripanocida (CI50 = 55 µg/ml + 7,07) y antioxidante (CI50 = 0,166 mg/ml por el método ABTS y CI50 = 1,30 mg/ml) por el método DPPH, seguido del extracto de hojas, ambos resultados no son comparables al violeta de genciana, quimioprofilactico sanguíneo, control positivo y a la quercetina.
DISCUSIÓN
Se detectó una actividad tripanocida, sobre los tripomastigotes de T. cruzi de la corteza (CI50 = 55+7,07 µg/ml), las hojas de C. pluviosa (CI50= 125+35,35 µg/ml) y la corteza de A. urundeuva (175+35,5 µg/ml). La actividad tripanocida-antioxidante de ambas especies es reportada por primera vez en este estudio.
Observamos que hay una diferencia entre las CI50 de las hojas y la corteza de C. pluviosa, que es atribuida a la composición química diferente en los distintos órganos de la planta.
La actividad antioxidante está relacionada a flavonoides y compuestos fenólicos en general, sin embargo, la estructura y la capacidad de resonancia en el núcleo fenólico son mucho más importantes para la actividad antioxidante, que el número de hidroxilos sustituyentes del anillo aromático. Este tipo de estructuras son las que se pueden apreciar en los metabolitos secundarios presentes en especies de los géneros Caesalpinea y Astronium como los fenolicos protosappanin A, protosappanin B, brazilein, bergenin, los diterpenoides cassane, betamina 1 y 231,32. En el caso especifico de la corteza de tronco de C. pluviosa la presencia de bisflavonoides se muestran en su actividad elevada de antioxidante por ABTS, no similar, pero, comparable al método DPPH, la diferencia de estos resultados se puede deber a la cinética de la reacción y el tamaño de las estructuras tanto del radical de mayor tamaño ABTS y los bisflavonoides comparados con la estructura del DPPH y de cinética más lenta. Por otro lado ambos extractos C. pluviosa y A. urundeuva, tienen un IC50 cercano al valor de la Quercetina, tratándose de fitocomplejos y no de una molécula pura, estos muestran una muy buena actividad antioxidante.
La enfermedad de Chagas está caracterizada por una inflamación crónica. El desequilibrio entre las defensas prooxidantes y antioxidantes es conocido como stress oxidativo y está asociado con frecuencia con procesos inflamatorios. Este estress oxidativo incrementa en forma paralela a la progresión de la enfermedad de Chagas33. Habría, una correlación entre la carga parasitaria y la intensidad de los procesos inflamatorios y severidad de la enfermedad 34.
Las estructuras antioxidantes de los extractos de las plantas podrían impedir el progresivo stress oxidativo asociado con la enfermedad y atenuar las consecuencias del proceso oxidativo relacionadas a la tripanosomiasis.35 Los resultados nos estarían sugiriendo que la actividad antioxidante podría jugar un rol importante en la actividad antiinflamatoria de la enfermedad de Chagas. A su vez podrían estar presentes metabolitos con actividad tripanocida, que podrían actuar en forma sinérgica.
En conclusión, este estudio revela que los extractos de Caesalpinia pluviosa y Astronium urundeuva tienen un efecto tripanocida y antioxidante in vitro, justificando el uso tradicional de la planta, constituyéndose en excelentes candidatos para completar estudios biológicos in vivo y químicos. Esta asociación de actividad antioxidante-tripanocida, es una nueva perspectiva para el tratamiento de la enfermedad de Chagas.
AGRADECIMIENTOS
Este trabajo fue financiado por la UMSA (Universidad Mayor de San Andrés) /DIPGIS/IDH-2008
REFERENCIAS
1. Aufderheide AC, Salo W, Madden M, Streitz J, Buikstra J, Guhl F, Arriaza B, Renier C, Wittmers LE Jr, Fornaciari G, Allison M. A 9,000-year record of Chagas' disease. Proc Natl Acad Sci USA. 2004;101(7):2034-2039. [ Links ]
2. Cassab JA, Noireau F, Guillén G. 1ra ed. La Paz, Bolivia: Ediciones Gráficas EG;1999. [ Links ]
3. Dias JC, Silveira AC, Schofield CJ. The impact of Chagas disease control in Latin America: a review. Mem Inst Oswaldo Cruz. 2002;97(5):603-612. [ Links ]
4. Medrano-Mercado N, Ugarte-Fernandez R, Butrón V, Uber-Busek S, Guerra HL, Araújo-Jorge TC, Correa-Oliveira R. Urban transmission of Chagas disease in Cochabamba, Bolivia. Mem Inst Oswaldo Cruz. 2008;103(5):423-430. [ Links ]
5. Urbina AJ. Specific chemotherapy of Chagas disease: Relevance, current limitations and new approaches. Acta Trop. 2010; 115 (1-2):55-68. [ Links ]
6. Mandal S, Hazra B, Sarkar R, Biswas S, Mandal N. Assessment of the Antioxidant and Reactive Oxygen Species Scavenging Activity of Methanolic Extract of Caesalpinia crista Leaf. Evid Based Complement Alternat Med. 2011; 2011: 1-11. [ Links ]
7. Rao KY, Geethangili M, Fang SH, Tzeng YM. Antioxidant and cytotoxic activities of naturally occurring phenolic and related compounds: A comparative study. Food Chem Toxicol. 2007;45 (9):1770–1776. [ Links ]
8. Bourdy G, De Walt SJ, Chavez De Michel LR, Roca A, Deharo E, Muñoz V, Balderrama L, Quenevo C, Gimenez A. Medicinal plants uses of the Tacana, an Amazonian Bolivian ethnic group. J Ethnopharmacol. 2000;70 (2): 87-109.
9. Shukla S, Mehta A, John J, Singh S, Mehta P, Vyas SP. Antioxidant activity and total phenolic content of ethanolic extract of Caesalpinia bonducella seeds. Food Chem Toxicol. 2009a;47(8):1848-1851. [ Links ]
10. Gupta M, Mazumder UK, Kumar RS, Sivakumar T, Vamsi ML. Antitumor activity and antioxidant status of Caesalpinia bonducella against Ehrlich ascites carcinoma in Swiss albino mice. J Pharmacol Sci. 2009;94(2):177-184. [ Links ]
11. Gaur RL, Sahoo MK, Dixit S, Fatma N, Rastogi S, Kulshreshtha DK, Chatterjee RK, Murthy PK. Antifilarial activity of Caesalpinia bonducella against experimental filarial infections. Indian J Med Res. 2008;128(1):65-70. [ Links ]
12. Dickson RA, Houghton PJ, Hylands PJ. Antibacterial and antioxidant cassane diterpenoids from Caesalpinia benthamiana. Phytochemistry. 2007;68(10):1436-1441. [ Links ]
13. de Lima MR, de Souza Luna J, dos Santos AF, de Andrade MC, Sant'Ana AE, Genet JP, Marquez B, Neuville L, Moreau N. Anti-bacterial activity of some Brazilian medicinal plants. J Ethnopharmacol. 2006;105(1-2):137-47. [ Links ]
14. Cruz MC, Santos PO, Barbosa AM Jr, de Mélo DL, Alviano CS, Antoniolli AR, Alviano DS, Trindade RC. Antifungal activity of Brazilian medicinal plants involved in popular treatment of mycoses. J Ethnopharmacol. 2007;111(2):409-12. [ Links ]
15. Calzada F, Yépez-Mulia L, Aguilar A. In vitro susceptibility of Entamoeba histolytica and Giardia lamblia to plants used in Mexican traditional medicine for the treatment of gastrointestinal disorders. J Ethnopharmacol. 2006;108(3):367-70. [ Links ]
16. Chiang LC, Chiang W, Liu MC, Lin CC, In vitro antiviral activities of Caesalpinia pulcherrima and its related flavonoids. J Antimicrob Chemother 2003;52 (2):194–198. [ Links ]
17. Silva CH, Sobrinho TJ, Castro VT, Lima Dda C, Amorim EL. Antioxidant Capacity and Phenolic Content of Caesalpinia pyramidalis Tul. and Sapium glandulosum (L.) Morong from Northeastern Brazil. Molecules. 2011; 16(6):4728-4739. [ Links ]
18. Singh U, Kunwar A, Srinivasan R, Nanjan MJ, Priyadarsini KI. Differential free radical scavenging activity and radioprotection of Caesalpinia digyna extracts and its active constituent. J Radiat Res (Tokyo). 2009;50(5):425-33. [ Links ]
19. Lee MJ, Lee HS, Kim H, Yi HS, Park SD, Moon HI, Park WH. Antioxidant properties of benzylchroman derivatives from Caesalpinia sappan L. against oxidative stress evaluated in vitro. J Enzyme Inhib Med Chem. 2010;25(5):608-614. [ Links ]
20. CChew YL, Chan EW, Tan PL, Lim YY, Stanslas J, Goh JK. Assessment of phytochemical content, polyphenolic composition, antioxidant and antibacterial activities of Leguminosae medicinal plants in Peninsular Malaysia. BMC Complement Altern Med. 2011;10;11:12. [ Links ]
21. Muñoz V, Bourdy G, Deharo E, Callapa J, Quenevo C, Sauvain M. Actividad antipalúdica in vitro e in vivo de plantas usadas por el grupo étnico boliviano Tacana. Cuadernos. 2002; 47:7-26. [ Links ]
22. Muñoz V, Rojas I, Bourdy G, Deharo E, Quenevo C, Frade C, Sauvain M. 2004. Actividad citotóxica de plantas medicinales usadas por el grupo étnico boliviano Tacana. Cuadernos. 2004; 49:133-145.
23. Desmarchelier C, Lisboa Romão R, Coussio J, Ciccia G. Antioxidant and free radical scavenging activities in extracts from medicinal trees used in the Caatinga region in northeastern Brazil. J Ethnopharmacol. 1999;67 (1):69–77. [ Links ]
24. Deharo E, Baelmans R, Gimenez A, C. Quenevo C, G. Bourdy G. In vitro immunomodulatory activity of plants used by the Tacana ethnic group in Bolivia Phytomedicine. 2004;11 (6):516–522.
25. Menezes AMS, Rao VSN, Fonteles MC. Antiulcerogenic activity of Astronium urundeuva. Fitoterapia 1986; 57:253–256. [ Links ]
26. Zingales B, Pereira MES, Almeida KA, Umezawa ES, Nehme NS, Oliveira RP, Macedo A, Souto RP. Biological parameters and molecular markers of clone CL Brener - The Reference Organism of the Trypanosoma cruzi Genome Project. Mem Inst Oswaldo Cruz . 1997; 92(6): 811-814. [ Links ]
27. Sülsen PV, Cazorla IS, Frank MF, Redko CF, Anesini AC, Coussio DJ, Malchiodi LE, Martino SV, Muschietti VL. Trypanocidal and leishmanicidal activities of flavonoids from Argentine medicinal plants. Am J Trop Med Hyg. 2007;77(4):654–659. [ Links ]
28. Silva CF, Batista MM, Mota RA, de Souza EM, Stephens CE, Som P, Boykin DW, Soeiro M de N. .Activity of reversed diamidines against Trypanosoma cruzi in vitro. Biochem pharmacol. 2007; 73 (12):1939– 1946. [ Links ]
29. Brand-Williams W, Cuvelier ME, Berset C. Use of a Free Radical Method to Evaluate Antioxidant Activity. Lebensm.-Wiss. u.-Technol. 1995;28(1):25-30. [ Links ]
30. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applyng an improved ABTS radical cation decolorization assay. Free Radic. Biol. Med. 1999; 26, 9/10, 1231-1237. [ Links ]
31. Hu J, Yan X, Wang W, Wu H, Hua L, Du L. Antioxidant activity in vitro of three constituents from Caesalpinia sappan L. Tsinghua Science and Technology. 2008; 13(4): 474-479. [ Links ]
32. Srinivasan R, Chandrasekar MJN, Nanjan MJ, Suresh B, Antioxidant activity of Caesalpinia digyna root. J Ethnopharmacol. 2007;113 (2):284–291 [ Links ]
33. Oliveira TB, Pedrosa RC, Wilhelm Filho D. Oxidative stress in chronic cardiopathy associated with Chagas disease. Int J Cardiol. 2007;116(3):357-63. [ Links ]
34. Péres-Fuentes R, Guegan JF, Barnabé C, López-Colombo A, Salgado-Rosas H, Torres-Rasgado E, Briones B, Romero-Díaz M, Ramos-Jiménez J, Sánchez-Guillén M del C. Severity of chronic Chagas disease is associated with cytokine/antioxidant imbalance in chronically infected individuals. Int J Parasitol. 2003;33 (3):293–299. [ Links ]
35. Maçao LB, Wilhelm Filho D, Pedrosa RC, Pereira A, Backes P, Torres MA, Fröde TS. Antioxidant therapy attenuates oxidative stress in chronic cardiopathy associated with Chagas' disease. Int J Cardiol. 2007;123(1):43–49. [ Links ]












