Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.17 n.2 La Paz 2009
TRABAJOS DE INVESTIGACIÓN
Actividad antiparasitaria de plantas medicinales de la Amazonía Peruana
Antiparasitic activity of medicin al plants from Peruvian Amazon
Johann Satalaya R1, Joahan Rojas U 1, Braulio Ríos 1, Maritza Grandez 1, Elsa Rengifo 2, Grace Ruiz 3, David Gutierrez 3, Alberto Gimenez 3, Ninoska Flores 3
1Facultad de Farmacia y Bioquímica, Universidad Nacional de la Amazonia Peruana, Sargento Lores 385.Iquitos, Perú. Telf: 51 65 232186.
2Instituto de Investigaciones de la Amazonía Peruana, Av. José A. Quiñones km. 2.5 - Apartado Postal 784. Loreto, Perú. Telf: +51+65+265515
3Instituto de Investigaciones Fármaco Bioquímicas, Universidad Mayor de San Andrés. Av. Saavedra N° 2224, 2º Piso, Miraflores. La Paz, Bolivia. Telf: 591 2 2229021
Dirección para correspondencia: Ninoska Flores. Instituto de Investigaciones Fármaco Bioquímicas, Universidad Mayor de San Andrés. Av. Saavedra 2224, 2º Piso, Miraflores, La Paz-Bolivia.
Telf: 591 2 2229021 int 106
E mail: ninofq@hotmail.com
Recibido para publicación en 31/07/09
Aceptado en 28/12/09
RESUMEN
Las enfermedades parasitarias, como la leishmaniasis, la malaria y la Enfermedad de Chagas, son algunos de los principales problemas de salud pública a nivel mundial, principalmente en las regiones amazónicas. Las plantas medicinales constituyen una alternativa, en la necesidad de buscar nuevos tratamientos para estas enfermedades. En el presente trabajo llevamos adelante el estudio de ocho plantas medicinales de la amazonía peruana, de las cuales se han preparado extractos diclorometánicos, etanólicos y acuosos, obteniéndose 40 extractos. De cada extracto se ha evaluado la actividad antiparasitaria in vitro contra formas promastigotes de diferentes cepas de Leishmania, epimastigotes de Tripanosoma cruzi y trofozoitos de Plasmodium falciparum. Los resultados obtenidos muestran que el extracto de Unonopsis spectabilis es el más activo, con una CI50 de 65.3, 54.2 y 24.5 mg/ml frente a L. amazonensis, L. brazilensis y L. donovani respectivamente; y una CI50 de 10mg/ml frente a P. falciparum, sin embargo resultó inactivo frente a T. cruzi.
Palabras Clave: extractos, plantas de la amazónica peruana, leishmanicida, tripanocida, antiplasmódica
ABSTRACT
Parasitic diseases, including Leishmaniasis, Malaria and Chagas, are serious problems of public health worldwide, mainly in the Amazonian regions, and medicinal plants are an alternative in the treatment and control of these diseases.
This work aims to evaluate eight medicinal plants from the Peruvian Amazon, which have been prepared into dichloromethane, ethanol and aqueous extracts, obtaining forty extract samples. The antiparasitic activity of each one of these samples was then evaluated in vitro promastigotes forms of different strains of Leishmania, epimastigotes of T. cruzi and Plasmodium falciparum trophozoites; the results showed that the extract from Unonopsis spectabilis was the most active against L. amazonensis, L. brazilensis and L. donovani with IC50 of 65.3, 54.2 and 24.5mg / ml respectively, with P. falciparum presenting IC50 of 10mg/ml and, however, proving to be inactive against T. cruzi.
Key Words: extracts, plants of peruvian amazonic, leishmanicidal, trypanocidal and antiplasmodial activity
INTRODUCCIÓN
Una de las preocupaciones de la humanidad en todos los tiempos, ha sido mantener el buen estado de su salud. Las sociedades amazónicas no han sido ajenas a esta preocupación. Desde su propia concepción de salud y enfermedad y la diversidad biológica de su entorno, cada uno de los pueblos indígenas amazónicos ha desarrollado conocimientos acerca de las propiedades curativas de las plantas. Heredera de este saber milenario, la población amazónica actual está, sin embargo, perdiendo estos conocimientos debido a los procesos de aculturación, la relación desventajosa entre el saber etnomédico y los sistemas oficiales de salud, la desaparición de los bosques, y la sobreexplotación de algunos de los recursos hasta el agotamiento1.
La amazonía peruana comparte con los ocho países amazónicos, no sólo la más grande cuenca del planeta, sino también la mayor diversidad biológica del mundo. Se considera 3,140 especies útiles, de las cuales 1,044 tienen uso medicinal. La flora y fauna amazónica peruana constituye una de las más grandes dispensas y reservas de recursos terapéuticos. El hombre amazónico, a través de toda su historia, ha logrado identificar importantes especies que presentan compuestos biológicamente activos que han contribuido a aliviar a curar diversas enfermedades, entre ellas la malaria2.
Según la Organización Mundial de la Salud (OMS), planta medicinal se define como el material derivado de una planta o una preparación con beneficios terapéuticos y otros beneficios sobre la salud del ser humano y que contiene materia prima o ingredientes procesados de una o más plantas. Hacia fines de la década de los 70, la OMS reconoce el rol de las plantas medicinales en la cura de diversas enfermedades que afectan al hombre3.
Las enfermedades infecciosas tropicales constituyen un problema, para un gran porcentaje de seres humanos que habitan en zonas tropicales de nuestro planeta. Se evidencia una urgente necesidad en la búsqueda de alternativas terapéuticas de nuevas moléculas seguras efectivas, económicas y fáciles de administrar.
Las poblaciones de nuestros países, y no solamente las amazónicas, se amparan cada vez más en el uso de la gran variedad de plantas con propiedades medicinales, complementando o solucionando, en gran medida, sus problemas de salud, pues el acceso a los medicamentos convencionales resulta difícil o imposible por su elevado costo4. Es por este motivo que en el Instituto de Investigaciones Fármaco Bioquímicas IIFB de la Facultad de Ciencias Farmacéuticas y Bioquímicas de la Universidad Mayor de San Andrés, se están realizando este tipo de estudios, para que existan respaldos científicos del uso tradicional de las plantas. Consideramos de importancia el estudio de las plantas medicinales utilizadas como antiparasitarias por los pobladores de la amazonía peruana. Los conocimientos empíricos étnicos son un primer paso para la evaluación de la actividad antiparasitarias in vitro, y el estudio químico para identificar de manera cualitativa los principales metabolitos secundarios de las especies vegetales, para posteriormente realizar estudios de actividad terapéutica5 y poder elaborar fitofármacos que puedan contribuir a resolver en parte, los problemas de salud de la población económicamente menos favorecida y más alejada de la modernidad con limitadas posibilidades de curarse.
Es en esta línea que se realizó el estudio de la actividad antiparasitaria de los extractos de ocho plantas de la amazonía peruana, iniciando con el proceso de la recolección, secado, y triturado de las plantas, posteriormente se prepararon diferentes extractos: maceración en diclorometano, etanol y extracción acuosa, los cuales posteriormente fueron evaluados por pruebas antiparasitarias in vitro.
MATERIAL Y MÉTODOS
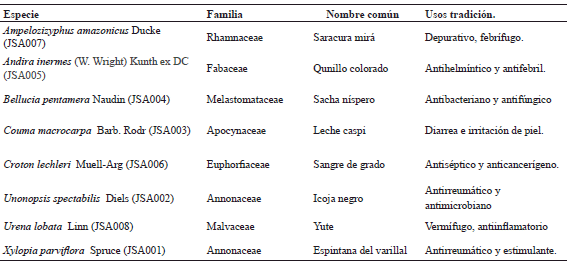
Colección del material vegetal. El material vegetal se recolectó en la Reserva de Allpahuayo Mishana (73° 26′; 0.66′′ W 04°00′′; 175′′ S), Km 31.5 de la carretera Iquitos–Nauta en el Distrito de San Juan, Provincia de Maynas del Departamento de Loreto, Iquitos, Perú; en mayo de 2008. Muestras de herbario fueron depositadas en el Herbario del Instituto de Investigaciones de la Amazonía Peruana (IIAP-Iquitos), y su identificación taxonómica se realizó mediante comparación con las muestras del Herbario de la Facultad de Ciencias Biológicas de la Universidad Nacional de la Amazonía Peruana. (Ver Tabla 1)
Tabla 1. Usos tradicionales de especies medicinales de la amazonía peruana
El material recolectado fue secado a la sombra, a temperatura ambiente, extendiendo en láminas grandes y removiéndolas diariamente, durante 7 días. El material seco fue pulverizado hasta obtener un polvo grueso (2 mm), para ser utilizado en la elaboración de los extractos.
Preparación de los extractos. El material vegetal seco y finamente pulverizado, de cada una de las especies, fue pesado (50 g) y posteriormente sometido a procesos de maceración con diclorometano (CH2Cl2), etanol (EtOH) y agua (H2O), en una proporción (1:10 p/v), durante 48 horas a temperatura ambiente. Posteriormente, los macerados fueron filtrados y los residuos obtenidos se concentraron a sequedad en rotaevaporador (Laborota 4000) acoplado a una bomba de vacío (Vacum Bland), a una temperatura de 40° C (90 rpm), obteniéndose de esta forma los extractos etanólicos, acuosos y diclorometánicos crudos libres de solventes orgánicos (ver Esquema 1).
Esquema 1. Esquema de extracción de plantas medicinales.
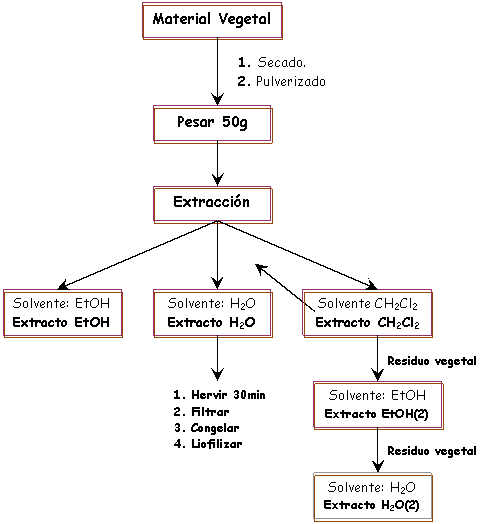
El residuo vegetal (marco) del extracto de CH2Cl2, fue procesado con etanol a temperatura ambiente por 48 h, posteriormente filtrados y concentrados a sequedad, obteniéndose los extractos etanólicos EtOH (2). El residuo vegetal obtenido del mismo fue nuevamente sometido a una cocción en agua durante 30 minutos y posteriormente filtrado, este extracto acuoso fue congelado a -80° C y posteriormente liofilizados, obteniéndose el extracto acuoso H2O (2).
Estudios de actividad biológica. Evaluación de la actividad Leishmanicida. Las formas de promastigotes de Leishmania: L. donovani (cepa PP75), L. brasilensis (cepa M 2903) y L. amazonensis (cepa PH8), fueron cultivadas a 26°C en medio Schneider suplementado al 5% con suero bovino fetal inactivo (56°C por 30 minutos). Los parásitos en fase de crecimiento logarítmico fueron distribuídos en una microplaca de 96 pozos a una concentración de 1x106 parásitos/ml y cada pozo fue tratado con diferentes concentraciones de los extractos o fracciones durante 72 horas. La actividad se evaluó mediante conteo óptico en microscopio, comparándose con el control positivo y negativo. Pentamidina fue utilizado como fármaco control. Se evaluaron concentraciones de los extractos de 100, 50 y 25 µg/ml; en caso de que los productos presentasen actividad, se disminuyeron las concentraciones hasta obtener la CI50; la prueba se realizó por triplicado. Los resultados de actividad leishmanicida son expresados en valores de CI50 (concentración de la droga que inhibe el 50% del desarrollo del parásito), obtenido mediante una típica curva dosis respuesta (log de la concentración de la droga vs % de inhibición)6.
Evaluación de la actividad Tripanocida. Las formas de epimastigotes de T. cruzi, cepa Tulahuen, fueron cultivadas a 26°C en medio Liver Infusión Tryptose (LIT), suplementado al 5% con suero bovino fetal inactivado (56°C por 30 minutos). Los parásitos en fase de crecimiento logarítmico se distribuyeron en placa de 96 pozos a una concentración de 1x106 parásitos/ml. Cada pozo fue tratado con diferentes concentraciones de los extractos: 100, 50 y 25 µg/ml, durante 72 horas. El vehículo utilizado para la disolución de los extractos fue DMSO, en una concentración no superior al 1%, la prueba se realizó por triplicado. Los datos se obtuvieron por conteo óptico con la utilización de un microscopio invertido y comparándose con pozos control. La CI50 se calcula utilizando el programa Cricket Graph. Anfotericina B fue utilizada como fármaco de referencia6.
![]()
El cálculo de la Concentración Inhibitoria del 50% en la maduración de los esquizontes (CI50), se realiza por un método gráfico, programa Críquet Graph 1.3, considerándose como activos aquellos que presentaron CI50 menor a 10 µg/ml.
RESULTADOS
En la presente investigación, se han estudiado ocho plantas medicinales de la amazonía peruana, las cuales se listan en la Tabla 1, en la que se presentan los nombres científicos, nombres comunes y el uso tradicional de las mismas.
De cada una de las especies vegetales se prepararon extractos orgánicos y acuosos (como se describe en la metodología), obteniéndose un total de 40 extractos: 8 extractos diclorometánicos (CH2Cl2), 16 extractos etanólicos (EtOH y EtOH (2)) y 16 extractos acuosos (H2O y H2O (2)). En la Tabla 2 se presentan los porcentajes de rendimientos obtenidos.
Tabla 2. Rendimiento de extracción de especies medicinales de la amazonía peruana.
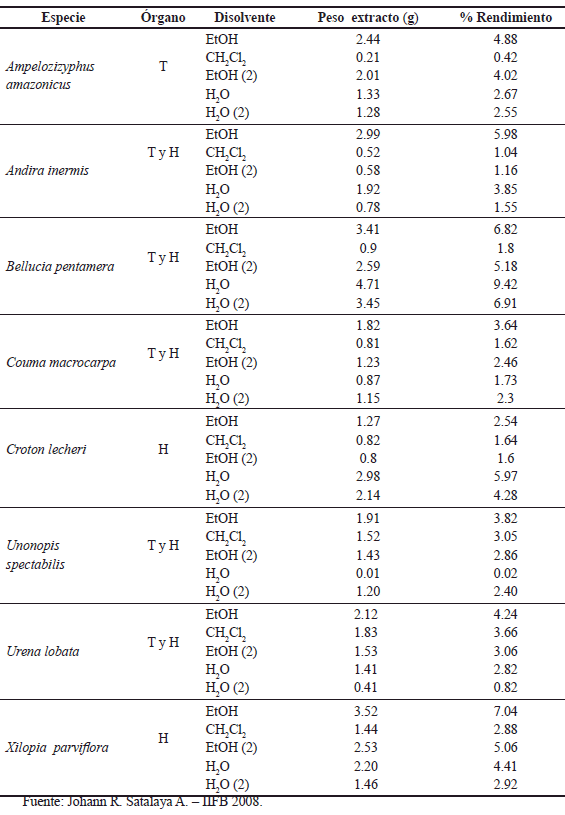
Según los resultados, se puede observar que se han obtenido mayores porcentajes de rendimiento en los extractos EtOH, siendo el extracto de X. parviflora la que tiene el mayor peso con 3.52 g, seguidos de los extractos acuosos, a excepción de la especie C. lecheri en la que el extracto acuoso es el que tiene mayor cantidad 2.98 g que el extracto etanólico 1.27 g.
De los extractos H2O y H2O (2), la de B. pentamera presenta los mayores porcentajes de rendimiento 9.42% y 6.91% respectivamente, en comparación con los otros extractos acuosos obtenidos.
En cuanto al rendimiento de los extractos diclorometánicos (CH2Cl2), las de U. lobata y U. spectabilis presentaron porcentajes de rendimiento de 3.66 y 3.05% respectivamente, siendo los más altos porcentajes respecto a los otros.
De todos los extractos obtenidos de cada especie de planta, 40 extractos (ver Tabla 2), se ha evaluado la actividad antiparasitaria in vitro contra formas promastigotes de diferentes cepas de Leishmania, epimastigotes de T. cruzi y trofozoitos de P. falciparum.
Los resultados de la actividad leishmanicida y tripanocida in vitro de los cuarenta extractos se presentan en la Tabla 3.
Tabla 3. Actividad leishmanicida y tripanocida in vitro

En la Tabla 3, se observa que de todas las especies evaluadas la única que presentó actividad leishmanicida in vitro contra las tres cepas de Leishmania fue el extracto de CH2Cl2 de U. spectabilis, con una CI50 de 65.3, 54.2 y 24.5 mg/ml frente a L. amazonensis, L. brazilensis y L. donovani respectivamente. Mientras que en el extracto EtOH, presentó actividad frente a L. brazilensis con CI50 64.3 mg/ml y L. donovani con CI50 = 25.5 mg/ml; en ambos tipos de extractos la actividad es dos veces más frente a L. donovani; ninguno de los extractos de U. spectabilis presentó actividad frente a T. cruzi.
Otra especie de planta que presentó buena actividad y selectividad es el extracto etanólico (EtOH), de X. parviflora con una CI50 31.2 mg/ml frente L. donovani, mientras que en el extracto diclorométanico, es selectivo frente a L. brazilensis con una CI50 61.7 mg/ml; por otra parte el extracto EtOH (2) presentó buena actividad frente a epimastigotes de T.cruzi con una CI50 56.3 mg/ml.
El extracto de U. lobata presentó actividad selectiva frente a L. donovani con una CI50 de 41.9 y 63.9 mg/ml para el extracto EtOH y EtOH (2) respectivamente.
El extracto etanólico de B. pentamera presentó una CI50 de 58.3 mg/ml frente a epimastigotes de T. cruzi, mientras que el extracto EtOH (2) presentó baja actividad frente a promastigote de L. donovani CI50 = 71.7 mg/ml.
Evaluación de la actividad antiplasmódica in vitro. Los resultados obtenidos de la evaluación de la actividad antiplasmódica in vitro frente a P. falciparum, FCR-3 Cloroquina-resistente, se muestran en la Tabla 4.
Tabla 4. Actividad antiplasmódica in vitrofrente a trofozoitos de P. falciparum.

De todos los extractos evaluados la única especie que presentó actividad antiplasmódica in vitro frente a Plasmodium falciparum, fue el extracto diclorometánico de Unonopsis spectablis con un CI50 10 μg/ml, con un porcentaje de inhibición del 50%; todos los otros extractos presentaron una CI50 mayor a 10 μg/ml.
DISCUSIÓN
Los resultados obtenidos en el presente trabajo, nos han mostrado que de los 40 extractos preparados de las ocho plantas, el más activo es el extracto de diclorometano de Unonopsis spectabilis, frente a las diferentes cepas de Leishmania y a P. falciparum. Estudios previos de U. spectabilis han reportado el aislamiento de alcaloides 7,7′-bisdehidroaporfina9, pero sin ningún tipo de actividad biológica; del extracto de éter de petróleo de la corteza de U. buchtienii, han reportado la presencia de esteroles y alcaloides, siendo el alcaloide más activo la liriodenina frente a Leishmania major y L. donovani10; estos datos nos proporcionan una idea del tipo de compuestos que pueden ser responsables de la actividad biológica.
En conclusión, en este trabajo hemos presentado el estudio de la actividad leishmanicida, tripanocida y antiplasmódica de los extractos de ocho especies vegetales medicinales de la amazonía peruana. Los resultados nos muestran que el extracto de U. spectabilis es la planta mas efectiva con actividad leishmanicida y antiplasmódica. Estudios posteriores estarán encaminados en el fraccionamiento bioguiado, al objeto de aislar los compuestos responsables de la actividad antiparasitaria.
AGRADECIMIENTOS
Al IIIFB y a la Facultad de Ciencias Farmacéuticas y Bioquímicas, de la UMSA; al Proyecto PCI-Iberoamérica (A/010794/07, AECI); a la Red RIBIOFAR; y al proyecto X.5 Búsqueda, Obtención y Evaluación de Nuevos Agentes Antiparasitarios del CYTED (Subprogram X).
REFERENCIAS
1. Brack A. Plantas nativas utilizadas en el Perú en relación con la Salud humana. En: Salud y Población Indígena de la Amazonía. Quito: Impretec.1993; 2 : 61-175. [ Links ]
2. Mejia K, Rengifo E. Plantas medicinales de uso popular en la Amazonía peruana. 2da ed. Lima: Instituto de Investigación de la Amazonía Peruana, Gobierno Regional de Loreto, Agencia Española de Cooperación Internacional; 2000. pp 286. [ Links ]
3. World Health Organization. Traditional medicine - growing needs and potential. Bull World Health Organ. 66 (2): 266-267, 1988. [ Links ]
4. Gupta MP. 270 Plantas Medicinales Iberoamericanas. Santa Fé de Bogota, Colombia: Presencia; 1995: 413-20. [ Links ]
5. Tagboto S, Townson S. Antiparasitic properties of medicinal plants and other naturally ocurring products. Adv Parasitol. 2001; 50: 199-295. [ Links ]
6. Deharo E, Ruiz G, Vargas F, Sagua H, Ortega E, Rojas A, Jiménez A. Técnicas de laboratorio para la selección de sustancias antichagas y leishmanicidas. CYTED. La Paz, Bolivia: Prisa Ltda; 2004. [ Links ]
7. Trager W, Jensen JB. Human malaria parasites in continuous culture. Science. 1976; 193: 673-675. [ Links ]
8. Lambros C. Vanderberg JP. Synchronization of Plasmodium falciparum erythrocytic stages in culture. J Parasitol. 1979; 65(3): 418-420 [ Links ]
9. Laprévote O, Roblot F, Hocquemiller R, Cavé A. Alkaloids of the Annonaceae 87. Azafluorenones from Unonopsis spectabilis. J Nat Prod. 1988; 51 (3): 555-561. [ Links ]
10. Waechter AI, Cavé A, Hocquemiller R, Bories C, Muñoz V, Fournet A. Antiprotozoal activity of aporphine alkaloids isolated from Unonopsis buchtienii (Annonaceae). Phytother Res. 1999; 13 (2): 175 – 177. [ Links ]












