Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.16 n.1 La Paz dic. 2008
Método colorimétrico - XTT: como evaluación de alto rendimiento de sustancias con actividad leishmanicida.
Colorimetric method - XTT : as a tool for high performance evaluation of substances with leishmanicidal activity
Efrain Salamanca Capusiri 1, Grace Ruiz Pinell 1, Juan Carlos Ticona Huallpara 1, Alberto Giménez Turba 1
1Unidad Parasitología, Instituto de Investigaciones Fármaco Bioquímicas, Facultad de Ciencias Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés. La Paz, Bolivia.
Dirección para correspondencia: Alberto Giménez Turba Ph.D. Instituto de Investigaciones Fármaco Bioquímicas, Facultad de Ciencias Farmacéuticas y Bioquímicas, Universidad Mayor de San Andrés. Av. Saavedra # 2224, Miraflores. La Paz, Bolivia.
E mail: agimenez@megalink.com
RESUMEN
Las leishmaniasis es un grupo de enfermedades de gran impacto epidemiológico donde su tratamiento está asociados a múltiples efectos secundarios, es así que es necesaria la búsqueda de nuevas terapias, sin embargo los ensayos clásicos de elección primaria, como el método óptico, para detectar nuevos posibles compuestos leishmanicidas son cualitativos y a su vez toma tiempo medir la actividad antiparasitaria de un elevado número de drogas. En este estudio se puso a punto el método colorimétrico XTT, sobre promastigotes de Leishmania, el mismo que tiene base en la reducción de la sal de sodio 2,3-bis(2-metoxi-4-nitro-5-sulfofenil)-2-h-tetrazolium-5-carboxanilide (XTT) por las deshidrogenasas mitocondriales hasta cristales de formazan, reacción acelerada por la adición de un acoplador de electrones como es el Fenasin Metosulfato (PMS). Se determinó así la longitud de onda de lectura (450nm), linealidad, población de trabajo (1.5-3x106 promastigotes/mL), tiempos de incubación (2-4 horas), y correlación (R2) entre el conteo en cámara de Neubauer y la medida de Absorbancia. Se valoró a través de este método colorimétrico la actividad leishmanicida de una especie vegetal ampliamente conocida frente a está enfermedad (Galipea longiflora) y una droga control (Anfotericina B), teniendo de está forma un método sencillo, rápido confiable y cuantitativo para la evaluación de un número elevado de posibles sustancias con propiedades antiparasitarias.
Palabras Clave: XTT, MTT, MTS, PES, PMS, actividad leishmnaicida, CI50, Método colorimétrico, Galipea longiflora, Anfotericina-B.
ASBTRACT
Leishmaniasis is a group of diseases of great epidemiological impact, considering the fact that its existing treatments are associated with multiple side effects, and therefore the search for new therapies is important. However, the classical optical screening method for measuring leishmanicidal activity is only qualitative and time consuming, making it difficult to evaluate a large number of substances. Due to these reasons, the XTT method for promastigotes of Leishmania was standarized, based on the mitochondrial enzymatic reduction of the sodium salt of 2, 3-bis (2-methoxy-4-nitro-5-sulfophenyl)-2-H-tetrazolium-5-carboxanilide (XTT) up to formazan crystals, and this reduction is accelerated by the addition of electron couplers such as Fenasin Methosulphate (PMS). During the present work there was the chance to determine the linear behavior of absorbance at 450nm, the parasite populations (1.5-3x106promastigotes/mL), the time of incubation with the electron couplers (2-4 hours) and correlation (R2) between the count of parasites on a Newbauer chamber and the levels of absorbance detected during the experiment. This colorimetric method with XTT, was validated to determine the leishmanicidal activity of the medicinal plant extracts (Galipea longiflora) and compared with a reference drug (Anfotericine B), having now an easy, reliable, fast and quantitative method to evaluate a large number of possible antiparasitic substances.
Key Words: XTT, MTT, MTS, PES, PMS, colotimetric method, leishmanicidal activity, IC50. Galipea longiflora, Anfotericina-B.
INTRODUCCIÓN
Las leishmaniasis constituyen un grave problema de salud pública a nivel mundial, que afecta a 88 países, 67 en el viejo mundo y 21 en América. Presenta una prevalencia de 12 a 14 millones de enfermos y una incidencia de unos dos millones de casos nuevos anuales.1-3 En Bolivia, aproximadamente 800.000 individuos se encuentra en alto riesgo de enfermar con leishmaniasis, estos individuos están repartidos en 7 de los 9 departamentos, la tasa de incidencia más alta se encuentra en los departamentos de La Paz, Pando y Beni4,5.
El tratamiento de las leishmaniasis incluye antimoniales pentavalentes (SbV), estibogluconato de sodio (Pentostan®), antimoniato de N-metilglucamina, Anfotericina B, pentamidina6 y recientemente se introdujo la miltefosina7,8, donde la actividad de estos compuestos varia de acuerdo a la especie de Leishmania involucrada. Su uso está limitado también por los efectos adversos (toxicidad cardiaca y renal, pancreatitis subclínica etc.) que muchos de estos compuestos presentan, a los que lamentablemente se suma el elevado costo de ciertas formulaciones9.
Debido a que aún persisten dificultades en el tratamiento de la leishmaniasis surge la necesidad de encontrar nuevos productos de acción antiparasitaria, dichas dificultades radican no sólo en los efectos secundarios, sino en el deseo de encontrar productos menos tóxicos, de bajo costo y fácil administración como alternativa terapéutica para esta parasitosis, esto justifica la implementación de métodos rápidos, sencillos y cuantitativos, para determinar la actividad antiparasitaria in vitro de posibles productos leishmanicidas10,12.
Las técnicas antiparasitarias de incorporación de timidina (H3) dentro del DNA son muy confiables, sin embargo el uso de isotopos radioactivos implica riesgo de eliminación de desechos. Los métodos colorimétricos basados en la reducción de la sal 3-(4,5-dimetiltiasol-2-yl)-2,5-difeniltetrazolium bromide (MTT) por las deshidrogenasas mitocondriales de las células viables a cristales de formazan, indican de forma directa el número de células vivas presentes en los cultivos. Estos métodos son ampliamente utilizados, sin embargo el producto final de está sal (formazan) es insoluble en agua, por lo que se utiliza solventes orgánicos para solubilizarlo. La utilización de analogos de MTT como son el XTT sodio (2,3-bis(2-metoxi-4-nitro-5-sulfofenil)-2-h-tetrazolium-5-carboxanilide.) y recientemente el MTS estan siendo empleados para ensayos de este tipo, donde a diferencia del primero la forma reducida de estos agentes (formazan) es soluble en agua, lo que permite realizar el ensayo en un solo paso, una ventaja adicional es el tiempo más corto de incubación el cual es resultado de la adición de un agente acoplador de electrones como es el Fenasin Metosulfato (PMS) y/o el Fenasin Etosulfato (PES) el cual acelera la reducción del sustrato11.
En el presente trabajo se puso a punto el método colorimétrico XTT sobre promastigotes de Leishmania, determinando la actividad antiparasitaria de un producto natural ampliamente conocido13-15 por su actividad leishmanicida (alcaloides totales de corteza de Galipea longiflora-CAT) y una droga control (Anfotericina B). Este método fue comparado con el método óptico sobre promastigotes de diferentes especies Leishmania del cepario del Instituto de Investigaciones Fármaco Bioquímicas (I.I.F.B).
MATERIAL Y MÉTODOS
Cepas utilizadas para los ensayos. Se utilizaron todas las cepas listadas en el cepario del I.I.F.B (Tabla N. 1).

Puesta a punto del método colorimétrico XTT. Preparación de soluciones (XTT-PES) (XTT-PMS). Se utilizó, una solución de XTT 1mg/mL disuelto en buffer fosfato salino (PBS) pH 7.0 previamente descrito16,11 el cual fue dividido en dos tubos e incubados durante 10 minutos a 37oC, al primer tubo se añadió PMS (Sigma-Aldrich) 0.06mg/mL suspendido en PBS pH 7.0, al segundo tubo se añadió PES (Sigma-Aldrich) 0.06mg/mL preparado de igual forma que el anterior.
Selección de longitud de onda. Se realizó un barrido espectrofotométrico (espectofotómetro de doble haz Cintra 5) entre 400-550nm de longitud de onda con la finalidad de encontrar el máximo pico de absorbancia17,18, se prepararon 8 tubos de ensayo con promastigotes de L. amazonensis a una concentración de 1x106 promastigotes/mL, los promastigotes fueron tomados de cultivo in vitro en medio Schneider pH 6.8, 26oC temperatura de incubación y 10% suero bovino fetal (SBF), estos fueron incubados en presencia de XTT-PES (4 tubos) y XTT-PMS (4 tubos) por 5 horas a las condiciones de cultivo antes descritas. Las lecturas en el espectrofotómetro se realizaron en celdas de cuarzo de 10mm, cada hora.
Estudio de linealidad, tiempo óptimo de incubación y población parasitaria de trabajo. A partir de un cultivo in vitro de promastigotes en fase de crecimiento logarítmico de L.amazonensis a una concentración de 1.2x107 promastigotes/mL se realizaron diluciones seriadas 1/2 abarcando concentraciones entre 1.2x107 hasta 9.4x104 promastigotes/mL, los cuales fueron distribuidos en placas de cultivo de 96 pozos (Nunc) por duplicado a tres repeticiones, a cada pozo se añadió 50µL de la solución XTT-PMS a las concentraciones previamente descritas, los tiempos de incubación fueron de 2,3,4,5,6 y 7 horas. Las placas fueron leídas en un lector ELISA (Model 2100 series-Plate Reader) a 450nm. A partir de los datos, se obtuvieron curvas de absorbancia en función a las concentraciones de parásitos, para los diferentes tiempos de incubación19,17.
Determinación del coeficiente de correlación lineal (R2) entre curvas de crecimiento obtenidos por conteo en cámara de Neubauer y método colorimétrico (XTT-PMS). Para conocer el R2 entre el método por conteo de parásitos en cámara de Neubauer y la medición de absorbancias como producto de la reducción de XTT-PMS18,11, se realizó una curva de crecimiento, partiendo de un cultivo in vitro de promastigotes de L. amazonensis en fase de crecimiento logarítmico, mismo que se ajustó a una concentración de 1x106 parásitos/mL, estas fueron sembradas en cajas de cultivo celular (Nunc) y se tomaron muestras diarias por cuadriplicado durante 5 días, 2 fueron fijadas con glutaraldehído al 5% para realizar el conteo de parásitos diariamente en cámara de Neubauer, y otras 2 muestras fueron alicuotadas en una placas de 96 pozos y procesadas con 50µL de la mezcla XTT-PMS, incubándose durante 4 horas, los valores de absorbancia fueron medidos en un lector ELISA.
Preparación de droga de referencia y alcaloides totales de Galipea longiflora (CAT). Se empleo Anfotericina B como droga de referencia (Fungisone-Bristol,Mayers, Squibb), donde a partir de una solución madre se realizaron diluciones seriadas en concentraciones de 6.2 hasta 0.1µg/mL, preparado previo a su uso. Además se preparó una solución madre de CAT a 10mg/mL utilizando DMSO (GC-Sigma–Aldrich) como solvente, a partir de está solución se realizaron diluciones seriadas desde 100 hasta 3.1mg/mL de CAT, las concentraciones de DMSO fueron ≤ al 1%.
Preparación de la placa de 96 pozos. Se tomó 20µL de un cultivo in vitro de promastigotes (solución madre) y se depositó en 180mL de glutaraldehido (5%) para fijar los parásitos y poderlos contar en cámara de Neubauer. Se ajustó la población a 1x106parásitos/mL con medio Schneider (pH=6.8) al 10% de SBF, para luego distribuirlos en placas de 96 pozos (Nunc) en un volumen de 100mL.16
A continuación se procedió a añadir las distintas concentraciones de CAT en volumen similar al de los parásitos, se diseñó un blanco para cada concentración de CAT (100mL medio Schneider más 100mL de la concentración de CAT correspondiente).
Se realizó además un control de parásitos más DMSO al 1% (concentración no tóxica para los parásitos), para evaluar la viabilidad y un control de parásitos con Anfotericina B. Las placas se incubaron durante 72 horas a 26°C.
Obtención de la IC50 por el método óptico. Al término de la incubación se realizó la lectura a través del microscopio de fase invertida (Zeizz-Axiovert 25). La actividad leishmanicida se midió por: porcentaje de lisis, mortalidad, disminución de la motilidad de los parásitos, cambios morfológicos evidentes y lisis de los parásitos, obteniendo así un porcentaje de actividad. El valor de la IC50 es calculado por una curva de actividad: porcentaje de inhibición frente al logaritmo de las diferentes concentraciones de la droga.16
Obtención de la IC50 por el método colorimétrico XTT. El análisis de datos fue realizado en Microsoft Excel programa 2000, el cual ejecutó las siguientes operaciones, previamente descrito por Cornelly et.al11.
A: Cálculo del valor promedio de las absorbancias de las tres réplicas de la muestra y sus controles.
B: Sustracción del valor de absorbancia de los blancos, tanto al control positivo como a las diferentes concentraciones de CAT frente a los promastigotes.
C: Conversión de las diferentes absorbancias a porcentaje de viabilidad de los parásitos, donde el 100% representa la absorbancia del control sin extracto.
D: La conversión del porcentaje de viabilidad a su correspondiente valor de IC50 que se realizó por función de tendencia lineal que ajusta la recta calculada por el método de los mínimos cuadrados a los valores de las matrices Y= porcentaje de inhibición y X = concentración de la droga (CAT), devolviendo los valores de Y=50% de inhibición a su respectivo valor de X.
RESULTADOS
Selección de longitud de onda - Barrido espectral de 400nm-550nm. Del barrido espectral se pudo apreciar en la Figura 1 que a medida que aumenta el tiempo de incubación aumenta la absorbancia (hasta aproximadamente 1) para la mezclas XTT-PMS mostrando una estabilidad hasta 5 horas de incubación, sin embargo para la mezcla XTT-PES si bien aumenta la absorbancia (hasta 0.38) para las 4 horas, se observó que ésta disminuye a las 5 horas de incubación mostrando cierta inestabilidad con esta mezcla a medida que trascurre el tiempo.
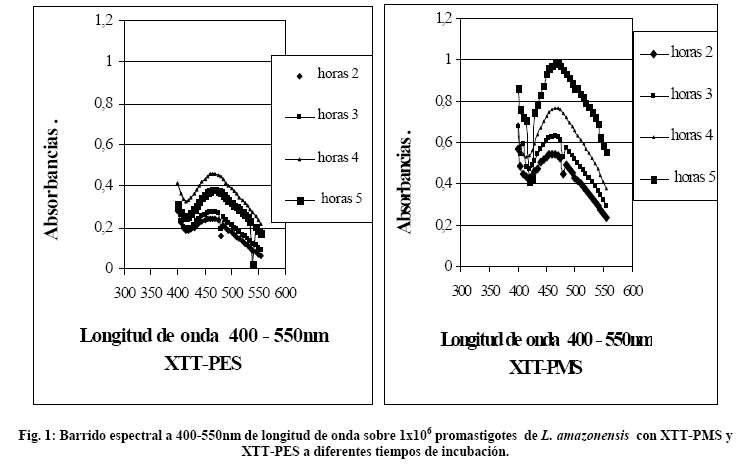
Así también se pudo observar máximos picos de absorbancia alrededor de los 450nm de longitud de onda, por lo que se utilizó esta longitud para las posteriores lecturas.
Estudio de linealidad, tiempo óptimo de incubación y población parasitaria de trabajo. Como se pudo observar en la Figura 2, existe una respuesta lineal de la absorbancia al incremento del número de parásitos, siendo la poblaciones de 1.5 y 3x106 promastigotes/mL las que presentan coeficientes de correlación lineal (R2) más cercanos a la unidad (datos no mostrados), por lo que existirá una elevada probabilidad estadística de cumplirse está regresión17. A su vez se pudo observar que las medidas de absorbancia tienden a descender a partir de las 4 horas de incubación. Por los resultados obtenidos sugerimos tiempos de incubación entre 2-4 horas y población de trabajo entre 1.5 y 3x106 promastigotes/mL.

Determinación de R2 entre curvas de crecimiento obtenidos por conteo en cámara de Neubauer y método colorimétrico XTT-PMS. Bajo las condiciones de trabajo anteriormente mencionadas se pudo observar en la Figura 3, que existe una buena correlación (R2= 0,951) entre el método por conteo en cámara de Neubauer y la medición de absorbancias como producto de la reducción de XTT-PMS frente a células vivas, en relación a otras encontradas (bibliografía =0.965)11.

Actividad antiparasitaria de CAT in vitro sobre promastigotes de Leishmania mediante el método colorimétrico XTT. Las IC50 sobre promastigotes se determinaron a través del método colorimétrico (XTT-PMS) y el conteo óptico, mostrándonos a través de un análisis de T student que no existen diferencias significativas entre ambas metodologías (p<0.05) para todas las cepas, excepto una (L.chagasi) donde asumimos pueda existir un error de tipo experimental.
Por otro lado los valores de IC50 de Anfotericina B sobre L.chagasi obtenidos por este método colorimétrico son comparables a los valores obtenidos por otros métodos colorimétricos (MTT) frente a la misma cepa20.
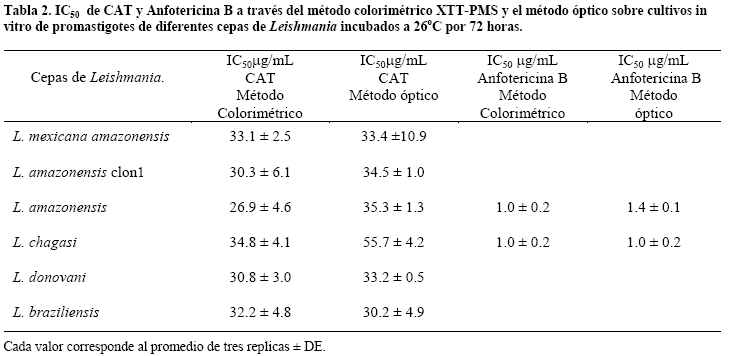
Se pudo evidenciar (Tabla 2) que existe una actividad leishmanicida de CAT frente a todas las cepas de Leishmania ensayadas, reportadas por Fournet et. al y Giménez et. al13,15 a través de métodos ópticos, sin embargo cabe recalcar que el presente trabajo confirma está actividad antiparasitaria a través de métodos cuantitativos.
DISCUSIÓN
Los ensayos colorimétricos a diferencia de otro tipo de ensayos de viabilidad celular como las técnicas antiparasitarias de incorporación de timidina (H3) dentro del DNA, no requiere de reactivos y/o equipos sofisticados, ademas el uso de isotopos radioactivos implica riesgo de eliminación de desechos.
En los ensayos de selección de longitud de onda mediante un barrido espectral se observó valores de absorbancia distintos para una misma concentración parasitaria (1x106 promastigotes /mL) al utilizar las soluciónes de XTT-PMS y XTT-PES, tomando en cuenta que la formación de color (sales de formazan) por la reducción del XTT, es directamente proporcional a la concentración de células vivas, asumimos que la combinación XTT y el aceptor de electrones PMS es la solución más adecuada para los ensayos colorimétricos.
Es conocido que las poblaciones de trabajo para la evaluación de productos con posible actividad leishmanicida in vitro se encuentran alrededor de 1x106 promastigotes /mL15,16, se pudo observar en el presente trabajo que las poblaciones ideales para la evaluación de productos mediante el método colorimétrico XTT son de 1.5 y 3x106 promastigotes/mL, debido a que por debajo de estas poblaciones la medida de absorbancia es mínima, no pudiendo así distinguir diferencias poblacionales.
En los estudios de actividad antiparasitaria de CAT in vitro sobre promastigotes de Leishmania mediante el método colorimétrico XTT y el método óptico, no se observan diferencias significativas (p<0.05) demostrando en este aspecto que ambas técnicas son similares, contando de esta forma con una técnica colorimétrica rápida, menos laboriosa y cuantitativa, brindando así apoyo a estudios encaminados a utilizar este método como herramienta de investigación, que responda a la gran demanda de resultados, debido a la cantidad de productos leishmanicidas en estudio. Con la aplicación de este método se podría cubrir está demanda y continuar con el trabajo establecido, teniendo como pilar fundamental el contar con más métodos que validen nuestro trabajo.
Como conclusión de este trabajo, se pude rescatar que se puso a punto el método colorimétrico XTT bajo las condiciones de trabajo del laboratorio en base a experiencias anteriores y se adaptaron estos de acuerdo al material existente en el laboratorio, es así que se determinó los parámetros de trabajo, como son, el uso de un acoplador de electrones que acelera la reducción del substrato (PMS), longitud de onda de lectura (450nm), linealidad, tiempos de incubación (2-4 horas), población ideales de trabajo (1.5 y 3x106 promastigotes/mL), bajo esas condiciones se pudo evidenciar mediante un ensayo de cinética de crecimiento que existe correlación fuerte entre el método de conteo de parásitos en cámara de Neubauer y la medición de absorbancias como producto de la reducción de XTT frente a promastigotes (R2=0,9765) en relación a otras encontradas11 (R2=0.965).
Se verificó la actividad leishmanicida de un compuesto natural, utilizando el método colorimétrico XTT frente a todas las cepas de Leishmania mantenidas en el cepario del I.I.F.B con rangos de IC50 que van desde 26.9 hasta 34.8mg/mL, como también se determinó el IC50 de Anfotericina B como droga control, con un IC50 de 1±0.1mg/mL, siendo estos comparables a los valores obtenidos por otros métodos colorimétricos (MTT)20.
AGRADECIMIENTOS
Este estudio fue parcialmente financiado por el proyecto Evanta UMSA-IDH-2007 a quien expresamos un especial agradecimiento. Asimismo a la agencia AECI, por los proyectos PCI con la Universidad de La Laguna, al IRD Francia por beca de Maestría (SCE), a la Fundación AvH/Stiftung y la OEA, por la donación de equipos. Finalmente al CIPTA y la comunidad de Santa Rosa de Maravilla, por la colecta de la especie medicinal.
REFERENCIAS
1. Alvar Ezquerra J. Las leishmaniasis: de la biología al control. Instituto de salud Carlos III (España) Centro colaborador de la OMS para Leishmaniasis. 2a ed. Junta de Castilla y León. Zamora; 2002.p. 19-29. [ Links ]
2. Murray HW, Berman J, Davies C, Saravia N. Advances in leishmaniasis. Lancet. 2005; 366: 1561-1577. [ Links ]
3. Atias A. Parasitología Médica. 3a ed. Santiago de Chile: Mediterráneo; 1999.p. 247-245. [ Links ]
4. Batista Moliner R. coordinador. Situación de Salud Bolivia 2004-Documentos de divulgación científica Enero-2006. Ministerio de Salud y Deportes; 2006.p. 69-71.
5. Mollinedo S. coordinador. Leishmaniasis. Guía Operativa para el Control en Bolivia. 1 ed. La Paz: Programa Nacional de Control de las Leishmaniasis; 2007. [ Links ]
6. Mollinedo S. coordinador. Manual práctico de tratamiento de las leishmaniasis. 1 ed. La Paz: Unidad de Parasitología y Entomología. INLASA; 2002. [ Links ]
7. Soto J, Rea J, Valderrama M, Toledo J, Soto P, Valda L, Berman J. Efficacy of Miltefosine for bolivian cutaneous leishmaniasis. Am J Trop Med Hyg. 2008; 78: 210–211. [ Links ]
8. Soto J, Soto P. Miltefosina oral para el tratamiento de la leishmaniasis. Biomédica. 2006; 26: 207-17. [ Links ]
9. Osorio E, Montoya G, Arango G. Alkaloidal natural products with antiprotozoal activity. Vitae; 2006; 13(1): 61-84. [ Links ]
10. Sereno D, Lemestre J. Use of an enzymatic micromethod to quantify amastigote stage of Leishmania amazonensis in vitro. Parasitol Res. 1997; 83: 401-403. [ Links ]
11. Cornelly W, Espinosa O, Montenegro H, Cubila L, Capson T, Ortega-Barria E, Romero L. Hydrosoluble formazan XTT : Its application to natural products drug discovery for Leishmania. J Microbiol Meth. 2003; 55: 813-816. [ Links ]
12. Niks M, Otto M. Towards an optimized MTT assay. J Immunol Methods. 1990; 130: 149-151. [ Links ]
13. Fournet A, Hocquemiller R, Roblot F, Cavé A, Richomme P, Bruneton J. Les chimanines, nouvelles quinoleines substituees en 2, isolees de une plante Bolivienne antiparasitaire : Galipea longiflora. J Nat Prod. 1993; 56: 1547-1552. [ Links ]
14. Bourdy G, Giménez A, Quenevo C. Tacana: Ecuanasha aquí, ecuanasha id´rene cuana, me schanapaque (Tacana: Conozcan nuestros árboles, nuestras hierbas).UMSA: IIFB-IIQ-IBBA; FONAMA-EIA; IRD. Plural. La Paz, Bolivia; 1999.p. 411-416. [ Links ]
15. Giménez A, Avila J, Ruiz G, Paz M, Udaeta E, Ticona J, Salamanca E, Paredes C, Rodríguez N, Quints K, Feraudy C, Gutierrez I, Chuqui R, Quenevo C, Dalence M, Bascope M. Estudios químicos, biológicos y farmacológicos de Galipea longiflora, Krause. Rev Bol Quim. 2005; 22: 94-107. [ Links ]
16. Giménez A, Gupta M Deharo E. Manual de Técnicas de laboratorio para la evaluación de sustancias tripanocidas y leishmanicidas; 2005.p. 89-90. [ Links ]
17. Ganguly S, Bandyopadhyay S, Sarkar A, Chatterjee M. Development of a semi-automated colorimetric assay for screening anti-leismanial agents. J Microbiol Methods. 2006; 66: 79-86. [ Links ]
18. Marcel A, Rojas L, Rodrígrez S, López Y, Ramos I. Aplicación de un método alternativo al conteo de cámara de Neubauer para determinar la concentración de Trichomonas vaginalis. Med Trop. 2001; 53: 180-188.
19. Montalvo M, Sifontes S, Montano I, Espino M. Necesidad del uso de cromógenos para cuantificar promastigotes de Leishmania en placas de 96 pozos. Med Trop. 2000; 52: 95-100. [ Links ]
20. Braga F, Bouzada M, Fabri R, Matos M, Moreira F, Scio E, Coimbra E. Antileishmanial and antifungal activity of plants used in traditional medicine in Brazil. J Ethnopharmacol. 2006; 111: 396-402. [ Links ]












