Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista SCientifica
versión impresa ISSN 1813-0054
SCIENTIFICA v.15 n.2 La Paz 2017
CASO CLÍNICO
Mielitis Transversa Aguda secundaria a reactivación aguda de Chagas en paciente VIH
Acute transverse myelitis associated acute reactivation of Chagas disease on a HIV patient
Mauricio Dorn Angulo, 1 Lola Camila Tellería Garnica.2
1 Médico Internista, Docente Universidad Católica Boliviana San Pablo
2 Médico Cirujano, investigador de enfermedades infecciosas, Jo-hns Hopkins Bloomberg School of Public Health.
Correspondencia a: Mauricio Dorn Angulo
E-Mail: dorn.mauricio@gmail. com +591 76040401 +591 76031446
Recibido: 10 de julio de 2017 Aceptado: 06 de octubre de 2017 Publicado: 11 de noviembre de 20
scientiflca.umsa.bo
Fuentes de Financiamiento Autofinanciado
Conflicto de Intereses Los autores declaran no tener conflictos de interés en la realización de este manuscrito.
Resumen
La mielitis transversa aguda es una enfermedad medular inflamatoria caracterizada por disfunción aguda motora, sensitiva y autonómica comprometiendo predominantemente miembros inferiores, de etiología variada.
Se describe el caso de un paciente masculino de 40 años de edad inmunodeprimido por el Virus de Inmunodeficiencia Humana, que presenta parálisis ascendente de miembros inferiores con pérdida de sensibilidad a nivel dorsal y compromiso de esfínteres más fiebre refractaria.
Presentó serología negativa para virus de Hepatitis A y C, Myco-plasma pneumoniae, Sífilis, Chlamydia y Criptosporidium y serología positiva para Chagas, recuento de linfocitos TCD4 < 200 cel/mL y mononucleares aproximadamente 2 por campo, sin presencia de otras células. Líquido cefalorraquídeo: xanto-crómico con hipoglucorraquia e hiperproteinorraquia. Tinción Gram, micológico, baciloscopías y cultivo negativos. Presenta 3 exámenes de micrométodo en sangre venosa con observación directa de Tripanosoma cruzi en todas las ocasiones. El paciente evolucionó estacionariamente durante 18 días de internación, luego sufrió muerte súbita.
Palabras clave: Mielitis Transversa, Enfermedad de Chagas, VIH
Abstract
Acute transverse myelitis is an inflammatory medullar disease characterized by acute motor, sensory and autonomic dysfunction involving predominantly lower limbs alterations of varied etiology. A case of a 40 year old male patient is presented, immunosup-pressed by Human Immunodeficiency Virus, he suflered an acute ascending paralysis in lower limbs with loss of sensa-tion at dorsal level and sphincters involvement plus refractory fevers pikes.
The patient presented negative serology for hepatitis A and C virus, Mycoplasma pneumoniae, Syphilis, Chlamydia and Cryptosporidium parvum. Serology tests for Chagas was positive. Lymphocytes TCD4 cell count was <200 cel/mL and about 2 mononuclear cells per field, without presence of other cells. Cerebrospinal fluid: xanthochromic with hypoglycorrha-chia and hyperproteinorachia, Gram staining, mycology, direct examination of sputum smears for acid-fast bacilli and culture were negative. Three features micromethods in venous blood patient's presented Trypanosome cruzi.
The patient's condition was stable during his 18 days of hospi-talization and then he died suddenly.
Keywords: Transverse Myelitis, Chagas Disease, HIV
INTRODUCCIÓN
El Virus de la Inmunodeficiencia Humana (VIH) es una infección considerada pandemia mundial progresiva, la cual se trasmite por vía sexual, transfusiones sanguíneas, transmisión materno-infantil y por uso de material punzo cortante contaminado.
La célula diana de este virus es el linfocito TCD4+, que dará lugar a síntesis de nuevas copias virales y posterior destrucción celular, de manera que disminuirá su concentración a medida que la carga viral incremente.
Este evento es el que desencadena un fallo en la respuesta inmunológica del huésped, permitiendo a gérmenes oportunistas proliferar y generar patologías en un organismo inmunodeprimido. Los entes patógenos más importantes son: Citomegalovirus, Pneumocystis jirovecii, Toxoplasma gondii, Cryptosporidium parvum, diversas ITS, tuberculosis y otras.
Esta enfermedad alcanza un estadio sintomático conocido como el Síndrome de Inmunodeficiencia Adquirida (SIDA). La terapéutica que se realiza en Bolivia es terapia antirretroviral (TARV); se inicia con Efavirenz 600 mg, Lamivudina 300 mg y Tenofavir 300 mg de dosificación diaria y profilaxis antibiótica si corresponde. No se cuenta con un tratamiento definitivo, ni vacuna profiláctica.1
El 40 % de las complicaciones afectan al sistema nervioso y de estas entre el 10 % al 20 % ya se encuentran presentes al momento de diagnosticar la infección por el VIH. Aun así en autopsias realizadas, la prevalencia de anormalidades en el sistema nervioso mantiene una prevalencia de 80 %.2-4 Hay condiciones asociadas directamente al VIH como ser: demencia, miopatía vacuolar y neuropatías periféricas; causas infecciosas, autoinmunes, neoplásicas (leucoencefa-lopatía progresiva multifocal, linfomas, meningoencefalitis, etc.), y secundarias al inicio del TARV, estas últimas llamadas en conjunto: síndrome inflamatorio de reconstitución inmunológica,5 este está presente en el 0.7 % de los pacientes que inician TARV6 con mayor riesgo en aquellos con recuentos de CD4+ < 50 células/mL al inicio.7 En las neuropatías asociadas al VIH la terapia es predominantemente de soporte y en todos los casos se demostraron mejorías clínicas y radiológicas en pacientes una vez iniciado el TARV. 8~n
La naturaleza poco frecuente del caso a describirse y la reciente asociación entre las patologías que lo predisponen y desencadenan, hacen de este un caso de notable relevancia para su estudio.
CASO CLÍNICO
Paciente masculino de 40 años de edad, procedente de Santa Cruz de la Sierra - Bolivia (región endémica de Enfermedad de Chagas) con residencia por más de 10 años en vivienda infestada por triatomas, refirió no haber recibido tratamiento ni medicación para enfermedades crónicas, ni haber sufrido patologías previas.
Fue diagnosticado VIH positivo, hace 2 años, a través de prueba de ELISA y Western Blot, realizados y registrados en el programa nacional de VIH, con recuento de linfocitos linfocitos T CD4+ de 179 células/mL, linfocitos T CD8+ de 694 células/mL (razón CD4/CD8 0,29) y carga viral de 83 653 copias ARN viral/mL en su último control el cual fue nueve meses antes del cuadro expuesto en este artículo, sin haber recogido su medicación en ninguna oportunidad y abandonando el seguimiento por parte del programa nacional de VIH.
Ingresó al Servicio de Emergencias presentando un cuadro clínico de dos días de evolución, de instauración insidiosa, caracterizado por alzas térmicas no cuantificadas, sin predominio de horarios y con pérdida de fuerza ascendente en miembros inferiores que evolucionó a una parálisis completa simétrica y bilateral en 48 horas, con movimientos voluntarios e involuntarios hasta la región torácica y una pérdida completa de la sensibilidad hasta nivel dorsal 5. El paciente no refirió sensaciones dolorosas en ningún momento.
A su ingreso presentó presión arterial de 80/60 mmHg, frecuencia cardiaca de 85 latidos por minuto, frecuencia respiratoria 22 respiraciones por minuto y temperatura axilar de 38°C. Al examen físico se encontraba consciente, orientado en tiempo, espacio y persona, mini mental test 29/30, sin alteraciones de los pares craneales y con lenguaje conservado. No presentó signos meníngeos.
A nivel cervical e inguinal se encontraron múltiples adenopatías, tres de estas mayores a 1 cm de diámetro en región cervical derecha, las cuales a la observación ecográfica fueron reportadas como hipertrofia ganglionar difusa. No se realizó el examen histopatológico.
No se encontraron alteraciones al examen físico cardiológico y debido a la dificultad en la movilidad del paciente no se pudo valorar la zona torácica posterior, se evidenció presencia de estertores húmedos en base pulmonar izquierda y nivel sensitivo presente hasta dorsal 5. Distención abdominal leve, timpanismo, ruidos hidroaéreos aumentados, sin visce-romegalias palpables. Presencia de globo vesical con pérdida del contenido por rebasamiento.
Al examen de extremidades superiores se evidenció motricidad, sensibilidad, tono y trofismo conservados con funcionalidad adecuada, mientras que en miembros inferiores no había alteraciones del tono y trofismo, con perdida de funciones motoras y sensitivas e incremento de los reflejos rotulianos, aquilianos y cutaneoplantares también edema con fóvea que ascendía hasta rodillas, sin alteraciones de coloración, temperatura y con llenado capilar normal. No presentó lesiones cutáneas.
En las pruebas laboratoriales realizadas al ingreso se evidenció hemoglobina de 10,3mg/dL, leucocitos totales 3,800/mm3 con predominio linfocitario, eosinofília de 10% y trombocitopenia de 16.000/mm3. Se solicitó resonancia magnética, electromiografía y búsqueda de bandas oligoclonales, pruebas que no se realizaron por razones económicas.
Para la distensión abdominal se colocó sonda nasogástrica a caída libre. Se inició terapia antibiótica con Ceftriaxona 1g Intravenoso cada 12 horas, hidratación según necesidad, Simeticona 80 mg Vía Oral cada 8 horas, Omeprazol 40 mg IV cada 24 horas, Enoxaparina 40 mg SC cada 24 horas, Metamizol según necesidad. Se inició TARV con Tenofovir 300 mg, Lamivudina 300 mg, Efavirens 600 mg, en terapia combinada por vía oral cada 24 horas.
Al cuarto día de internación desapareció el edema en miembros inferiores con abolición de reflejos tendinosos y disminución del tono muscular.
Se realizó una tomografía computarizada con contraste de encéfalo y columna dorsal que no mostraron alteraciones óseas ni parenquimatosas.
Al sexto, séptimo y noveno día de internación se realizó un micro-método seriado en sangre venosa que dieron positivo a la observación directa para Trypanosoma cruzi (Figura 1), se realizó también un micro-método de líquido cefalorraquídeo que fue negativo.
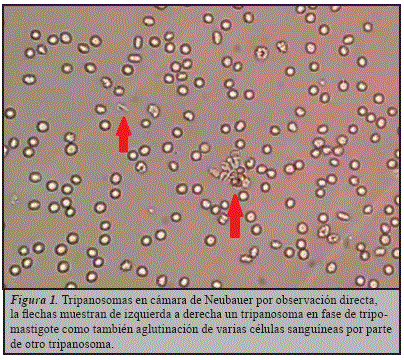
Al octavo día de internación se retiró la sonda nasogástrica, por disminución de la distención abdominal.
Un hemograma de control al noveno día evidenció aumento de las plaquetas a 250 000/mm3 y un cambio de la fórmula leucocitaria a predominio de polimorfonucleares.
Al décimo día se realizó punción lumbar donde se obtuvo líquido cefalorraquídeo translúcido con hipoglucorraquia de 18 mg/dL hiperprotei-norraquia 130 mg/dl, mononucleares aproximadamente 2 por campo, sin presencia de otras células, tinción de gram, micológico, BAAR y cultivo negativos.
Se realizó un examen coproparasitológico seriado resultando negativo. Los exámenes serológicos para virus de la hepatitis A (VHA), virus de la hepatitis C (VHC), Mycoplasma pneumoniae, VDRL, Chlamydia y Cryptosporidium parvum resultaron negativos. La hemoaglutinación indirecta y ELISA IgG para Chagas fueron positivos. En cultivo de agar sangre para Tripanozoma Cruzi, los parásitos fueron observables al microscopio luego de 16 días de cultivo.
El día once de internación el paciente presentó parálisis facial central izquierda, restitución del tono y reflejos osteotendinosos y reaparición de edemas en miembros inferiores
Control sanguíneo el dia 16 mostró leucocitos totales de 2 900 por mL, hemoglobina de 6,8 mg/dL, proteínas totales de 4,9 gr/L y albúmina de 1,6gr/L
Durante toda su internación presentó picos febriles diarios, por encima de los 38°C.
El decimoctavo día de internación el paciente presentó paro cardiorrespi-ratorio súbito que no respondió a RCP avanzado. No se realizó autopsia a solicitud de la familia.
Se consideró principalmente la posibilidad de un Síndrome de Guillain-Barré debido al resultado obtenido en estudios de líquido cefalorraquídeo. Sin embargo, en los hallazgos clínicos; la evolución brusca, la alteración sensorial con ausencia de dolor, presencia de cuadro febril persistente, presencia de reflejos osteotendinosos y la alteración del control de esfínteres nos llevó a descartar esta posibilidad ya que el cuadro clínico es predominantemente compatible con mielopatía a pesar de la ausencia depleocitosis.12
Epidemiológicamente se conoce que la mielopatía que se presenta con mayor frecuencia en pacientes con VIH es la mielopatía vacuolar en un 15-30 % de los casos.13,14 Otras causas de mielopatías no vacuo lares (especialmente mielopatías asociadas a lesiones intramedulares) incluyen toxoplasmosis,15 tuberculomas,16 citomegalovirus17 y virus de varicela-zoster.18,19 Actualmente no hay datos estadísticos locales respecto a estas patologías. También el curso de las mielitis asociadas al VIH generalmente aparece en estadios tempranos de la enfermedad a diferencia de la poliradiculopatía progresiva que aparece en los estadios tardíos.20,21
En una revisión sistemática de casos clínicos realizada por R. Vyas en el año 1996 acerca de mielopatías agudas infecciosas asociadas a VIH se observó como principales manifestaciones clínicas la paraplejia en miembros inferiores, presencia de nivel sensitivo, signo de Babinsky positivo, dolor dorsal agudo al inicio del cuadro, alteraciones de los reflejos tendinosos del área comprometida, alzas térmicas variables e incontinencia urinaria y fecal, siendo sus principales resultados paraclínicos la hipoglucorraquia, aumento inespecífico de niveles proteicos en LCR, pleocitosis en el 63 % de los casos revisados y alteraciones espinales y cerebrales visibles en Resonancia Magnética y Tomografía Computarizada, siendo la primera más sensible.22
DISCUSIÓN
El caso presentado tropezó con limitaciones económicas que limitaron, dificultaron y retrasaron el diagnóstico y tratamiento específico de la patología presentada. Se pone así en evidencia un problema actual en el sistema de manejo y tratamiento de pacientes con escasos recursos económicos, independientemente del tipo de patología que sufran; lo que obstaculiza la realización de procedimientos diagnósticos necesarios para llegar a un diagnóstico preciso y mucho más en caso de patologías poco frecuentes como en el expuesto.
El diagnóstico de ingreso en el Servicio de Emergencias fue Síndrome de Guillain-Barré y debido a la falta de comunicación del paciente sobre el diagnóstico positivo previo de VIH, se retrasó el enfoque clínico adecuado por parte del equipo médico tratante, postergando el tratamiento específico correspondiente.
El diagnóstico presuntivo en un paciente que presenta mielitis asociada al VIH es inicialmente la mielopatía vacuolar. 1,23 En esta entidad clínica la alteración predominante es la vacuolización de las bandas de mielina, con ausencia de desmielinización e inflamación, lo cual sugiere que es poco probable que la mielitis vacuolar responda a un daño viral directo, por lo tanto una mielitis asociada al VIH es una entidad que debe ser considerada distinta a la mielitis vacuolar. A pesar de la ausencia de evidencia anatomopatológica, hallazgos clínicos específicos como el nivel sensitivo y la rápida progresión de la mielopatía, sugieren otras causas no asociadas a la mielopatía vacuolar.
La ausencia de alteraciones imagenológicas en el parénquima cerebral es de gran relevancia clínica para este caso en particular, dado que el paciente a través de un micro método seriado y cultivo fue diagnosticado como una reactivación aguda de enfermedad de Chagas por la observación directa del parásito en todas estas pruebas.24
Esta entidad patológica es poco descrita, a diferencia de la infección cha-gásica aguda. En la reactivación aguda de la enfermedad de Chagas en pacientes inmunosuprimidos se .pueden encontrar focos de encefalitis necrotizante con elevado contenido de amastigotes que forman masas en el parénquima cerebral, conocidas como chagomas.25
En el estudio de líquido cefalorraquídeo no se observa presencia de parásitos, motivo por el que queda en cuestionamiento el que esta entidad haya o no estado involucrada en las alteraciones que presentó el paciente. Se desconoce qué papel pudieron haber desarrollado dentro del estado inflamatorio y trombogénico del paciente la presencia de parásitos vivos en el torrente sanguíneo sistémico.
A pesar de la limitada información, la reactivación aguda del chagas no aparenta ser una condición absoluta, sino que es un espectro de diferentes estadios clínicos que no guardarían relación directa con los estudios laboratoriales.
Ante la sospecha clínica, el acceso al diagnóstico de la enfermedad de Chagas es disponible proporcionalmente a la cobertura de los programas de Control y Prevención Nacionales. Sin embargo, el conocimiento por parte del personal de salud acerca de las co-infecciones y el acceso a pruebas complementarias para identificar patologías asociadas es muy bajo o nulo, obligándonos a la búsqueda y diseño de algoritmos diagnósticos que sean realizables en ambientes en donde el acceso a pruebas diagnósticas no es el ideal.
Así mismo, la capacitación del personal que trabaja en zonas rurales en relación a las diferentes formas de presentación y co-infecciones es indispensable muy necesaria. A este panorama se suma una creciente pre-valencia de VIH en Sudamérica y el Caribe que alcanza un promedio de 3,1 casos por 10 mil habitantes según datos oficiales del 2010..26 Además se suman múltiples condiciones y enfermedades tropicales propias de estas regiones, de las cuales desconocemos sus complicaciones e interacciones con el VIH.
Finalmente notamos ausencia en la literatura actual acerca de cambios en la presentación de enfermedades inflamatorias poco frecuentes en pacientes inmunocomprometidos, donde la presencia o ausencia de inmu-noglobulinas, células de la serie blanca y respuesta inmune en general es por concepto fisiopatológico diferente al individuo inmunocompetente. Pero el algoritmo diagnóstico de estas entidades se basa en dichas respuestas.
Para futuros estudios se recomienda la investigación de los procesos pro-inflamatorios que puedan estar asociados a una paresitemia activa por T. Cruzi en pacientes inmunodeprimidos.
En conclusión el reciente aumento en la prevalencia del VIH-SIDA en su comorbilidad con enfermedades propias de nuestra población, como la enfermedad de Chagas, nos muestra un amplio espectro de entidades de las cuales como personal de salud desconocemos.
Agradecimientos
Agradecimientos a la asociación benéfica PRISMA, al Dr. Gerson Gal-dos Cardenas quien asesoro la redacción del manuscrito y al personal de salud del Hospital San Juan de Dios por el apoyo del para el bienestar del paciente y por el interés científico.
REFERENCIAS BIBLIOGRÁFICAS
1 Ministerio de Salud y Deportes. Dirección General de Servicios de Salud. Programa Nacional ITS/VIH/SIDA. Guía de tratamiento antirretroviral en adultos./Ministerio de Salud y Deportes;Victor Alejandro Bernal López. Coaut. La Paz : Soipa Ltda., Soipa Ltda., 2009. ISBN: 978-99905-969-5-3 [Ver. digital] [ Links ]
2Gendelman HE, Lipton SA, Epstein L. The Neurology of AIDS. NY: Chapman & Hall; 1998. [NCBI] [ Links ]
3 Price RW, Perry SW. HIV, AIDS, and the Brain. NY: Raven Press: 1994. [ Links ]
4 Said G, Saimont AG, Lacroix C. Neurological complications of HIV and AIDS. Philadel-phia: WB Saunders Co pp 34-35; 1998. [ Links ]
5 Venkataramana A, Pardo CA, McArthur JC, Kerr DA, Irani DN, Grifnn JW. Immune reconstitution inflammatory syndrome in the CNS of HIV-infected patients. Neurology. 2006; 67(3): 383-388. [PubMed] [ Links ]
6McCombe JA, Auer RN, Maingat FG, Houston S, Gill MJ, Power C. Neurologic immune reconstitution inflammatory syndrome in HIV/AIDS: outcome and epidemiology. Neurology. 2009;72(9):835-41. [PubMed] [ Links ]
7 Müller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a syste-maticreviewandmeta-analysis. LancetInfectDis. 2010;10(4):251-61.[PubMed] [ Links ]
8Bizaare M, Dawood H, Moodley A. Vacuolar myelopathy: a case report of functional, clini-cal, and radiological improvement after highly active antiretroviral therapy. Int J Infect Dis. 2008;12(4):442-4. [PMC] [ Links ]
9DiRocco A. HIV-associated myelopathy. Current Treatment Options in Infectious Diseases. 2003; 5: 457-465. [ Links ]
10 Fernandez-Fernandez FJ, de la Fuente-Aguado J, Ocampo-Hermida A. Remission of HIV-associated myelopathy after highly active antiretroviral therapy. J PostgradMed. 2004;50(3): 195-6.[PubMed] [ Links ]
11 Tagliati M, Di Rocco A, Danisi F, Simpson DM. The role of somatosensory evoked po-tentials in the diagnosis of AIDS-associated myelopathy. Neurology. 2000;54(7):1477-1482. [PubMed] [ Links ]
12 Sellner et al. Diagnostic workup of patients with acute transverse myelitis: spectrum of clinical presentation, neuroimaging and laboratory fmdings. SpinalCord . 2009; 47(4): 312-317. [ Links ]
13 Garcia M., Causse M., Mielopatías y síndromes de neuropatías periféricas en la infección por el VIH, Guía práctica. Sociedad Andaluza de enfermedades infecciosas 2003; 2 : P 255-260. [ Links ]
14 Petito CK, Navia BA, Cho ES, Jordan BD, George DC, Price RW. Vacuolar myelopathy pathologically resembling subacute combined degeneration in patients with the acquired im-munodeficiency syndrome. NEnglandJournal of Med. 1985;312:874-9.[NEJM] [ Links ]
15 Chretien F, Flament-Saillour M, Paraire F, et al. Intramedullary localization of a primary cerebral lymphoma in AIDS. Arch AnatCytolPathol. 1994; 42:297-303. [ Links ]
16Melhem ER, Wang H. Intramedullary spinal cord tuberculoma in a patient with AIDS. Am JNeuroradiol. 1992; 13:986-8. [PubMed] [ Links ]
17 Moulignier A, Mikol J, Gonzalez-Canali G, et al. AIDS-associated cytomegalovirus infection mimicking central nervous system tumors: a diagnostic challenge. ClinInfectDis. 1996; 22:626-31.[PubMed] [ Links ]
18 Manian FA, Kindred M, Fulling KH. Chronic varicella-zoster virus myelitis without cuta-neous eruption in a patient with AIDS: report of a fatal case. ClinInfectDis. 1995; 21:986-8. [PubMed] [ Links ]
19GildenDH, BeinlichBR, Rubinstien EM, etal. Varicella-zoster virus myelitis: an expanding spectrum. Neurology. 1994; 44:1818-23.[PubMed] [ Links ]
20Bradley WG, Daroff RB, Fenichel GM, Neurological Manifestation of Human Inmunodefi-ciency Virus Infection in Adults. Neurology in ClinicalPractice. 2004;2: 1581-1602. [ Links ]
21 Verma S. MicsaE,Estanislao L, Simpson D. Neuromuscular complications in HIV. CurrNeu-rolNeurosci Rep. 2004; 4 (1): 62.7 [PubMed] [ Links ]
22 R Vyas, J R Ebright, Toxoplasmosis of the spinal cord in a patient with AIDS: case report and review, Department of Internal Medicine, Wayne State University, Detroit Medical Cen-ter, Michigan, USA.Clinical Infectious Diseases. 1996; 23(5): 1061-5. [ Links ]
23 Sussan Q. Wilburn, BSN, Mph, GerryEijkemans, MD, La prevención de pinchazos con agujas en el personal de salud, int j occupenvironhealth. 2004;10: 451^456 [ Links ]
24 Sartori, A. M. C.; Ibrahim, K. Y.; Nunes Westphalen, E. V.; Braz, L. M. A.; Oliveira, O. C.; Gakiya, É; Lopes, M. H.; Shikanai-Yasuda, M. A. Manifestations of Chagas disease (American trypanosomiasis) in patients with HIV/AIDS. Annals of Tropical Medicine & Parasito-logy. 2007; 101:31-50 [ Links ]
25 Rodrigues S, Sanz M, Aponte L, Enfermedad de Chagas: "Chagoma" cerebral con afectación del cuerpo calloso en un paciente con SIDA. Revista Colombiana de Radiología. 2009; 20(4): 2973-2977. [ Links ]
26Teva I., Bermúdez M., Ramiro M., Buela-Casal G., Situación epidemiológica actual del VIH/SIDA en Latinoamérica en la primera década del siglo XXI. Análisis de las diferencias entre países, Rev. méd. Chile 2012; 140 (1)[Scielo] [ Links ]












