Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista SCientifica
versión impresa ISSN 1813-0054
SCIENTIFICA v.15 n.1 La Paz 2017
ARTÍCULO DE REVISIÓN
Deficiencia de Glucosa-6-Fosfato Deshidrogenasa: Revisión de la literatura
Glucose-6-phosphate dehydrogenase deficiency: Review of the literature
Walter Oqueli Vasquez-Bonilla1a, Detsey Faviola Calix-Pineda2, José David Chavarria-Mejia2 Luis Fernando Sandoval Yánez2, Carlos Eduardo Raudales-Martínez3.
1 Médico general de guardia en clínica periférica de emergencia Clíper Hato, Hospital Escuela Universitario, Tegucigalpa Honduras
2 Doctor en Medicina y Cirugía. Egresado de la Facultad de Ciencias Médicas, Universidad Nacional Autónoma de Honduras, Tegucigalpa Honduras.
3 Médico residente del posgrado de ginecología y obstetricia del Hospital Escuela Universitario. Universidad Nacional Autónoma de Honduras.
aConsejo Asesor de la Federación Latinoamericana de Sociedades Científicas de Estudiantes de Medicina (FELSOCEM).
Correspondencia a: Walter Oqueli Vasquez Bonilla E-Mail: walter_bonylla@hotmail.com 504-33794268
Recibido: 28 de enero de 2017 Aceptado: 15 de mayo de 2017 Publicado: 30 de junio de 2017
scientiflca.umsa.bo
Resumen
La deficiencia de glucosa-6-fosfato-deshidrogenasa, también llamada deficiencia de G6FD es una enfermedad genética hematológica que predispone a hemólisis y su forma de herencia se encuentra ligada al cromosoma X, ya que el gen G6FD se encuentra localizado en Xq28, lo que lo coloca dentro de la última banda del brazo largo del cromosoma X. Se estima que afecta a más de 500 millones de personas en todo el mundo, con mayor prevalencia en África, Asia, el Mediterráneo y Medio Oriente, aunque debido a las constantes corrientes migratorias en la actualidad se encuentra en todo el mundo y es en la mayoría de los casos un padecimiento asintomático que, cuando es manejado cuidadosamente, poco limita la calidad y expectativa de vida del paciente. En este trabajo se realizó la búsqueda y revisión bibliográfica en bases de datos electrónicas. Los artículos seleccionados para información actualizada fueron publicados entre 2010 y 2016.
Palabras clave: Deficiencia de Glucosa-6-Fosfato Deshidrogenasa, G6FD, Hemólisis
Abstract
The glucose 6 phosphate dehydrogenase, also call G6PD deficiency is a genetic hematologic disease predisposing to hemolysis. The inheritance form is linked to the chromosome X, because the G6PD gene is located at Xq28, which place it in the last band of the long arm of the X chromosome. Is estimated that aífects more than 500 million people in all the world, with higher prevalence in Africa, Mediterranean and the Middle East, but due to the today's constant migration flow it is found throughout the world. The most of the cases is an asymptomatic condition. When it is carefully managed, poorly restrict patient's life quality and expectation. We carried out a search and review literature in electronic databases. Articles selected for this information were published between 2010 and 2016.
Keywords: Deficiency of Glucose-6-Phosphate Dehydrogenase, G6PD, Hemolysis
INTRODUCCIÓN
La Glucosa-6-Fosfato Deshidrogenasa se localiza en el citoplasma de las células procariotas, protozoarios, animales y plantas, es la enzima que cataliza la primera reacción de la vía de las hexosas monofosfato, la cual es responsable de la producción de Nicotinamida-Adenina-Dinucleótido-Fosfato (NADPH) un producto requerido para activar la glutatión reductasa y así mantener los niveles de glutatión reducido (GSH) dentro de la célula1. La deficiencia de G6FD es el defecto enzimático más frecuente, siendo descrito en 1956 cuando algunos pacientes que recibieron tratamiento con primaquina desarrollaron anemia hemolítica y se determinó en 195 8 que su base hereditaria se encontraba ligada al cromosoma X2.
Este problema afecta alrededor de 500 millones de personas en el mundo3. Es la enzimopatia más frecuente a nivel mundial y es por esto que podemos considerarla como un problema de salud pública, especialmente en regiones con alta incidencia de malaria4.
CARACTERÍSTICAS BIOQUÍMICAS
La G6FD es la primera enzima que cataliza la vía de las pentosa-fosfato, una vía metabólica que tiene dos fases y se encarga de la producción de una variedad de moléculas fundamentales; en la vía oxidativa la G6FD cataliza la conversión de glucosa-6-fosfato a 6-fosfogluconolactona produciendo una molécula de Nicotinamida-Adenina-Dinucleótido-Fosfato( NADPH) y cuando el 6-fosfogluconato se convierte en ribulosa-5-fosfato por la 6-fosfogluconato deshidrogenasa se produce una segunda molécula de NADPH, en el eritrocito esta es la única vía en producirlo en respuesta al estrés oxidativo, dentro de las vías antioxidantes podemos mencionar: los ciclos del glutatión donde el NADPH se encarga de regenerar el glutatión el cuál es esencial para la reducción de peróxido de hidrógeno y los radicales libre, otras vías son la de la tiorredoxina y de la glutarredoxina, entonces por cada molécula de glucosa se generan dos de NADPH, una ribosa-5-fosfato y CO25.
ESTRUCTURA DE LA G6PD
La primera estructura de la G6FD se obtuvo a partir de la enzima de Leuconostoc mesenteroides, la forma activa presenta equilibrio influenciado por el nivel de pH y la fuerza iónica, lo que significa que a mayor pH (pH >8) y fuerza iónica elevada el equilibrio se inclina hacia el dímero, mientras que a menor pH (pH < 6) y fuerza iónica, el equilibrio se inclina a favor del tetrámero. La descripción del monómero de la G6FD es una proteína de 485 aminoácidos, que aloja dos dominios: el de unión a la coenzima en el extremo N-terminal, que presenta el clásico plegamiento de unión del dinucleótido P-a-P y, el dominio p+a en el extremo C-terminal6.
GENÉTICA
El gen que codifica la enzima G6FD se localiza en la región terminal del brazo largo del cromosoma X (Xq28), tiene 20 kb de longitud y está constituido por 13 exones y 12 intrones, la secuencia codificadora comienza en el exón 2 ya que el exón 1 no es codificante, el largo total de la secuencia codificante es de 2269 nucleótidos. Por lo tanto, la deficiencia de G6FD es causada por el defecto genético ligado a este cromosoma, producido por mutaciones del gen G6FD provocando cambios de la secuencia de los aminoácidos y resultando en un amplio rango de fenotipos según el grado de afectación, se han descrito más de 400 mutaciones diferentes, la gran mayoría corresponden a sustituciones de una sola base y se encuentran dispersas en todo el gen7.
En cuanto al sexo los varones pueden ser hemicigotos lo que indica que pueden ser normales o presentar deficiencia, las mujeres pueden ser heterocigotas (mosaisismo) las cuales presentarían comportamiento similar al varón hemicigoto o pueden ser homocigotas8.
VARIANTES ASOCIADAS A LA DEFICIENCIA DE G6FD
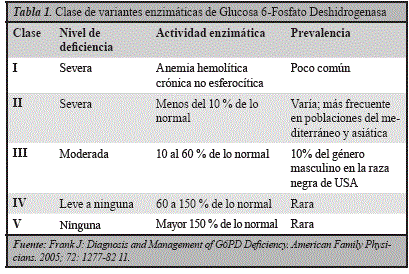
Las variantes de la deficiencia fueron agrupadas en 5 clases basados en las manifestaciones clínicas y la actividad enzimática (Tablas 1 y 2) la mayoría ocurren en forma esporádica y algunas producen hemólisis crónica o hemólisis congénita no esferocítica que es de tipo extravascular a diferencia de la hemolítica aguda que es intravascular9, 11.
Algunas variantes de la G6FD en especial clase II y III, se encuentran muy elevadas en algunas regiones del mundo más en zonas endémicas de malaria y asociadas a hemólisis inducida por estrés oxidativo, a diferencia de las variantes clase I asociada a hemólisis crónica10.
Existen más de 400 variantes de la deficiencia de G6FD en todo el mundo, en África subsahariana, tres presentan frecuencias alélicas superiores a 0,1 %: G6FDB, G6FDA y G6FDA, la G6FDB es el tipo silvestre y más común en África y el mundo entero y corresponde a la clase IV; G6FDA corresponde también a la clase IV la del alelo A- corresponde a la clase EL, esta última es la única que consiste en dos mutaciones simultáneas. La primera se debe a la sustitución de un nucleótido A por G en posición 376 que lleva al cambio de asparagina por aspartato, la segunda es variable y consiste en la sustitución de G por A en el nucleótido 202 que lleva al cambio de una valina por una metionina12.
INCIDENCIA Y DISTRIBUCIÓN GEOGRÁFICA
La deficiencia de G6PD es uno de los trastornos hereditarios más distribuidos a nivel mundial en los seres humanos, con frecuencias más altas en población Afroamericana, judíos, mediterráneo, italianos y franceses del sur13.
La frecuencia masculina de la deficiencia de G6FD es variable, en Europa es de 1 a 35 %, en África de 0 a 28 %, en Asia de 1 a 19 %, en la población negra de los Estados Unidos de 7 a 17 %, en Colombia, Chile, México y Perú es prácticamente de 0 %, en las Islas del Caribe de 0 a 13 %, en Brasil de 1,7 a 10 % y en Venezuela 2 a 12 % 13,14.
La G6PD tiene una incidencia anual estimada de alrededor de 1/100.000 nacimientos15. La distribución geográfica de la deficiencia de G6FD también es paralela a la de la malaria, por lo tanto, la prevalencia se ve en África, Asia, países del Mediterráneo y América Latina, un reciente meta análisis mostró una prevalencia mundial de la deficiencia de G6FD 4,5 % e indicó una incidencia de 1,8 % en Pakistán16.
La prevalencia estimada en el Líbano es de 1 a 3,1 %, estos comparten una sola mutación, lo que indica una baja tasa de nuevas mutaciones en esta región del Mediterráneo. Sin embargo, presentan mayor riesgo de desarrollar favismo relacionado con la ingesta de habas, lactancia materna prolongada mayor de 1 año de vida y la introducción temprana de alimentos sólidos antes de los 6 meses17.
DIAGNÓSTICO
El cuadro se considerará altamente sospechoso en un paciente del sexo masculino, sin antecedentes clínicos con hemogramas previos normales y que bruscamente presenta una crisis hemolítica aguda concomitantemente presentará un desencadenante o estrés oxidativo reciente como cuadros infecciosos, ingesta de drogas oxidantes (antipalúdicos, sulfamidas, etc). Realizaremos el diagnóstico usando dos herramientas: la prueba de Brewer la cual detecta mujeres heterocigotas y es válida para confirmar o descartar varones y mujeres homocigotas y la segunda es la medición de la actividad enzimática la cual dependerá de la variante enzimática, por ejemplo: en clase II: < 10 % y en clase III de 10 a 60 %, en las mujeres heterocigotas esta actividad está disminuida18.
El paciente experimenta una crisis hemolítica aguda horas después de exponerse a un estrés oxidante, en casos graves, puede aparecer hemoglobinuria y colapso vascular periférico, sin embargo, esta crisis hemolítica aguda cesa espontáneamente ya que la población de hematíes que se destruyen son los más viejos.
Laboratorialmente encontramos descenso brusco del hematocrito con elevación plasmática de la hemoglobina y la bilirrubina no conjugada, juntos con descenso de la haptoglobulina, también podemos hacer el diagnóstico por medio de espectrofotometría cuantitativa o comúnmente por un test de mancha fluorescente que detecta la generación de NADPH, el test es positivo para deficiencia de G6FD si la mancha de sangre no fluoresce bajo la luz UV, otras usadas son las pruebas basadas en reacción de polimerasa para detectar mutaciones específicas y son usadas en screenings poblacionales, estudios familiares o en diagnóstico prenatal, test de auto hemólisis, test de los cuerpos de Heinz, estudio de movilidad electroforética19.
La actividad enzimática se lleva a cabo a 37° C en un espectrofotómetro de acuerdo con el método de Burties, este método se basa en el hecho de que el NADPH que se forma como resultado de la reducción de NADP + tendrá una absorbancia de 340 nm, la actividad de G6FD se informa en U / g Hb20.
MANIFESTACIONES CLÍNICAS
Clínicamente la mayoría de los individuos con deficiencia de G6FD son asintomáticos la mayor parte del tiempo. Sin embargo, la importancia para la salud pública proviene de los números de afectados y el riesgo de desarrollar los síntomas clínicos al exponerse a factores productores de estrés oxidativo contra los cuales no puede defenderse.
La gravedad de estos síntomas dependerá del: grado de deficiencia enzimática, la naturaleza, la dosis del agente oxidante, el tiempo de exposición, factores preexistentes como la edad, valores de hemoglobina y una infección concomitante, el síntoma clínico más grave es la ictericia neonatal y que puede conducir a kernicterus y daño neurológico permanente o muerte21.
Se han descrito diferentes síndromes clínicos asociados a la deficiencia de esta enzima que incluyen: Anemia hemolítica inducida por medicamentos, hemólisis inducida por infección, favismo, ictericia neonatal, anemia hemolítica crónica no esferocítica21.
La anemia hemolítica inducida por medicamentos: Se produce por la aplicación de medicamentos antipalúdicos en afroamericanos específicamente la primaquina (30 mg/día); provocando hemólisis acompañada de hemoglobinuria, la cual ocurría de 2 a 3 días de haber iniciado el tratamiento y empeoraba durante la primera semana; gran número de medicamentos se han identificado como desencadenantes de hemólisis en pacientes con deficiencia de G6FD, algunos como el cloranfenicol, el ácido ascórbico administrado en dosis muy altas por encima de 80 g. intravenosa, la tiosulfona y el sulfametoxasol, cuando se administran medicamentos hemolíticos a pacientes con deficiencia de G6FD, estos se presentan de 24 a 72 horas con hemólisis intravascular e ictericia, también observamos los cuerpos de Heinz que desaparecerán porque el bazo elimina los eritrocitos infectados, la hemoglobina comienza a mejorar de los 8 a 10 días22.
Hemólisis inducida por infección: Es la causa más frecuente de hemólisis en los pacientes con deficiencia de G6FD, la gravedad y las consecuencias clínicas están influenciadas por numerosos factores que incluyen la administración simultánea de drogas oxidantes, la concentración de hemoglobina, la función hepática, la edad, etc. El mecanismo por el cual la infección induce hemólisis no se conoce con exactitud, dentro de las infecciones más relevantes encontramos: las hepatitis infecciosas incluyendo hepatitis A, neumonía, fiebre tifoidea, se debe hacer notar que las infecciones virales de las vías aéreas y del tracto gastrointestinal provocan hemólisis más severas que las infecciones bacterianas. También existe hemólisis fulminante causada por rickettsia que provoca fiebre moteada de las montañas rocosas22,23.
Favismo: Es lahemólisis aguda producida por el consumo de habaso el polen de estas como factor desencadenante en individuos genéticamente predispuestos, los compuestos vicina e isouramilo parecen ser los responsables22. 23, 24.
Anemia hemolítica crónica no esferocítica: Se presenta con hemólisis extravascular con un pequeño componente intravascular, tiene una gran variabilidad de manifestaciones dentro de estas los pacientes pueden presentar esplenomegalia y cálculos biliares como en las anemias hemolíticas crónicas de otra etiología. Estos pacientes también pueden presentar otras anomalías genéticas como: anemia diseritropoyética congénita, esferocitosis hereditaria, deficiencia de piruvato cinasa o deficiencia de 6-fodfogluconolactonasa22,23.
Ictericia neonatal: Ocurre en algunos casos sin que exista incompatibilidad inmunológica, se presenta al cuarto día la severidad es variable y las complicaciones como kernicterus no son frecuentes. Como factores de riesgo encontramos: la raza, condiciones hemolíticas, condiciones genéticas, lactancia materna, prematuridad, la incompatibilidad sanguínea ABO o Rh, las infecciones, cefalohematoma, la asfixia, el déficit de glucosa-6-fosfato deshidrogenasa, y las variantes genéticas que afectan a la actividad de la glucuroniltransferasa22,25.
TRATAMIENTO
La mayoría de los individuos con deficiencia de G6FD no necesitan tratamiento, la mejor medida terapéutica es aprender a evitar los agentes que pueden causar estrés oxidativo, la esplenectomía en la hemólisis crónica no está indicada26.
Si se tratara de ictericia neonatal, en la mayoría de los casos la fototerapia es efectiva, esto depende del nivel de bilirrubinas, cuando estas son elevadas (arriba de 300 umol/L) se aplicarán transfusiones y así prevenir el daño neurológico, en casos en que exista falla renal se indica hemodiálisis10.
Todos los pacientes deben ser ingresados para un control estrecho, valorar uso de transfusiones si existiera inestabilidad hemodinámica, tratar con antibióticos apropiados las infecciones, hidratación, brindar suplementos de ácido fólico 5 mg/día mientras dure la crisis y controles laboratoriales8.
PAPEL DE LA DEFICIENCIA DE GLUCOSA-6-FOSFATO DESHIDROGENASA EN EL TRATAMIENTO DE LA MALARIA
La malaria es un problema de salud pública a nivel mundial que cada año ocasiona de 250 a 500 millones de enfermos y un millón de muertes, de éstas 90 % ocurre en menores de 5 años de edad, la mayoría en África (89 %) donde también se concentra 59 % de los casos clínicos y 74 % de los casos por P. falciparum, recordemos que el tratamiento en casos de malaria no complicada la opción principal es la cloroquina. Sin embargo, los pacientes con infectados por P. vivax y P. ovale ameritan otro medicamento conocido como primaquina, el cual elimina los parásitos latentes en hígado, este se debe administrar a dosis de 0,25 mg/kg/día ya que causa hemólisis en pacientes con deficiencia de G6PD27.
Sin embargo, las personas afectadas por la deficiencia de G6FD pueden llegar a presentar cuadros clínicos de hemólisis más severos, es importante considerar esto en el tratamiento de la malaria, respecto al aumento de la dosis, número de días, casos de resistencia y casos de recidiva28,29.
La elevada frecuencia de la deficiencia de G6FD surge como consecuencia de que sus variantes confieren cierta protección o resistencia contra la malaria causada por Plasmodium falciparum y Plasmodium vivax, esto es importante ya que varios países endémicos para malaria se encuentran en fase previa de eliminación por lo cual es necesario considerar la deficiencia de G6FD.
Eesto no sucede en Honduras donde a pesar de los efectos negativos de administrar antimaláricos a individuos con deficiencia de G6FD todavía se siguen usando y no se ha determinado la prevalencia de esta condición, esto sería de mucha importancia ya que Honduras es considerado el país centroamericano con mayor cantidad de casos reportados de malaria por R falciparum30.
CONCLUSIONES
En nuestro país Honduras, son pocos los estudios sobre el déficit de G6FD, por lo cual decidimos realizar una revisión de una serie de artículos con el fin de dar a conocer a los lectores que es un tema de gran interés que muchas veces pasa desapercibido en nuestra consulta médica cada día, haciendo conciencia que este trastorno genético provoca baja o nula actividad enzimática, desencadenando una anemia hemolítica aguda ligada al cromosoma X, provocando un problema básico de salud pública.
REFERENCIAS BIBLIOGRÁFICAS
1 del Luján AI, Milani ÁC, Pérez SM, Lanza O, Detarsio G. Deficiencia de glucosa-6-fosfato deshidrogenasa eritrocitaria en Rosario. Acta bioquím. clín. latinoam. [Internet]. 2012 [citado 13 Sept. 2016]; 46(3): 359-363. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572012000300003 [ Links ]
2 Cammarata SF, Sánchez H, Cammarata SG, Cabral AN, Moreno O, Bastardo RM, Gil G. Deficiencia de glucosa-6-fosfato deshidrogenasa en un paciente con síndrome de Down. Avances en Biomedicina. [Internet]. 2012 [citado 31 mar. 2016] vol. 1(2): 92-96. Disponible en: http://erevistas.saber.ula.ve/index.php/biomedicina/article/view/4091/3900 [ Links ]
3 Brito M, Tchonhi CL, Santos B, Veiga L. Glucose-6-phosphate dehydrogenase deficiency in children from 0 to 14 years hospitalized at the Pediatric Hospital David Bernardino, Luanda, Angola. JPharmacogenomics Pharmacoproteomics. [Internet]. 2014 [citado 28 feb. 2017] 5:2. Disponible en: https://www.omicsonline.org/open-access/glucosephosphate-dehydrogenase-deficiency-in-hildren-at-the-pediatric-hospital-in-angola-2153-0645-5-125.pdf [ Links ]
4 Eandi ES, García Rosolen N, Urtasun C, Sciuccati G, Díaz L, Savietto V, et al. Deficiencia de glucosa-6-fosfato deshidrogenasa: Serie de casos clínicos. Arch. argent. pediatr. [Internet]. 2011 [citado 31 Mar. 2016]. Vol. 109(4): 354-361. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-00752011000400012#ref [ Links ]
5 Gómez MS, López VG, García I, Hernández G, Méndez ST, Marcial J, et al. Deficiencia de gluc osa-6-fosfato deshidrogenasa: De lo clínico a lo bioquímico. Acta bioquím. clín. latinoam. [Internet]. 2014 [citado 15 mayo. 2017]; 48(4):409-420. Disponible en: http://www.scielo.org.ar/pdf/abcl/v48n4/v48n4a03.pdf [ Links ]
6 Bastidas G, Vizzi E, Pérez H, Glucosa 6 fosfato deshidrogenasa: características bioquímicas y moleculares. Prevalencia de la deficiencia. Archivos de Medicina. [Internet]. 2015 [citado 13 set. 2016].Vol. 15(1): 138-150.Disponible en: http://revistasum.umanizales.edu.co/ojs/index.php/archivosmedicina/article/view/667/927
7 Suldrup AF, Césari N, Streitenberger ER, Naretto A. Deficiencia de gluc os a-6-fosfato deshidrogenasa en recién nacidos en Argentina. Acta bioquím. clín. latinoam. [Internet]. 2014 [citado 13 sept. 2016]. Vol. 48(2): 169-182. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572014000200002 [ Links ]
8 Bello P, Mohamed D L. Déficit de glucosa-6-fosfato deshidrogenasa: revisión a propósito de un caso. Rev. Pediatr Aten Primaria. [Internet]. 2015 [citado 13 sept. 2016]. Vol.17( 68 ): 361-368. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1 139-76322015000500014 [ Links ]
9 Verdugo P, Calvanese M, Rodríguez D, Cárcamo C. Deficiencia de glucosa 6 fosfato deshidrogenasa en niños: caso clínico. Rev. Chil. Pediatr. [internet]. 2014 [citado 13 de sept. 2016]. Vol.85(1): 74-79. Disponible en: http://www.scielo.cl/scielo.php?pid=S03741062014000100010&script=sci_abstract [ Links ]
10 García N, Romo E, Luque F, Torres M, Arámbula E. Panorama de la deficiencia de Glucosa-6-Fosfato Deshidrogenasa en México. [internet]. 2014 [citado 12 de sept. 2016]. Vol. 1(2): 32-40. Disponible en: http://www.reibci.org/publicados/2014/julio/2200119.pdf [ Links ]
11 Frank J: Diagnosis and Management of G6PD Deficiency. American Family Physicians. 2005; 72: 1277-82 11. [ Links ]
12 Carter N, PambaA, Duparc S, Waitumbi JN. Frequency of glucose-6-phosphate dehydrogenase deficiency in malaria patients from six African countries enrolled in two randomized anti-malarial clinical trials. Malaria Journal. [internet]. 2011 [citado 28 feb. 2016]. 10:241. Disponible en: https://malariajournal.biomedcentral.com/articles/10.1186/1475-2875-10-241 [ Links ]
13 Herrero P, Noguera A, Sabate V, et al. Estas ictérico, ¿Qué has comido? Semergen. [Internet] 2010 [citado 28 feb. 2017]. 36(8): 477-479 Disponible en:
www.elsevier.es/es-revista-semergen-medicina-amilia-40-pdf-S1 138359310001413-S300
14 Francis RO, Jhang JS, Pham HP, Hod EA, Zimring JC, Spitalnik SL. Glucose-6-Phosphate Dehydrogenase-Deficiency in Transfusion Medicine: The Unknown Risks. Vox sanguinis. [Internet] 2013 [citado 28 feb. 2017]. Vol. 105(4):271-282. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/23815264 [ Links ]
15 Froissart R, Piraud M, Boudjemline A, Vianey C, Petit F,et al. Glucose-6-phosphatase deficiency. Orphanet Journal of Rare Diseases, BioMed Central. [Internet] 2011 [citado 28 de feb. 2017] 6(1):27. disponible en: http://ojrd.biomedcentral.com/articles/10.1186/1750-1172-6-27 [ Links ]
16 Bushra M. Areview of G6PD deficiency in Pakistani perspective. [Internet] 2013 [citado 3 abr. 2016]. Vol. 63(4) Disponible en: http://jpma.org.pk/PdfDownload/4122.pdf [ Links ]
17 Inati A, Abbas HA, Boumitri C, Tecle N, Prevalence of glucose-6-phosphate dehydrogenase deficiency among neonates at a tertiary care centre in Lebanon. [Internet] 2012 [citado 28 de feb. 2017]. 19: 103-104. Disponible en: http://journals.sagepub.com/doi/pdf/10.1258/jms.2012.011138 [ Links ]
18 Chiappe G, Anemias hemolíticas. Revisión de algoritmos diagnósticos de anemias hemolíticas no autoinmunes en nuestro país. [Internet] 2015 [citado 28 de feb. 2017]. VoL. 19: 20-24 Disponible en: http://www.sah.org.ar/revista/numeros/05diagnostico-vol%2019-extra. [ Links ]
19 Toledo NC. Pruebas bioquímicas para el estudio del Déficit de Glucosa -6P- Deshidrogenasa. [Internet] 2012 [citado 28 de feb. 2017]. [ Links ]
20 Kumar P, Kumar P, Chandra P, Age-dependent detection of erythrocytes glucose-6-phosphate dehydrogenase and its correlation with oxidative stress. [Internet] 2016 [Citado 16 feb. 2016] Vol. 122(2): 61-66: Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/26711700. [ Links ]
21 Howes, RE, Battle K, Satyagraha A, et al. G6PD deficiency: global distribution, genetic variants and primaquine therapy. [Internet] 2013 [citado 4 de abr. 2016] 81:133-201. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/23384623 [ Links ]
22 Q.F.B. Lozano SA. Deficiencia de glucosa-6-fosfato deshidrogenasa. [Internet] 2013 [Citado 28 feb. 2016] Disponible en: http://lister.com.mx/articulos_lister/Articulos_generales/15_DeficienciaGlucosa6.pdf [ Links ]
23 Müller A. Anemias hemolíticas por deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD). [Internet] [citado 28 de feb. 2017] Disponible en: http://www.anm.org.ve/anm/pdf/ultimacorreccionAnemiashemoliticaspordeficienciadeglucosaReparado.pdf [ Links ]
24 López C, Sanchis B, Sanz de Miguel P. Favismo: a propósito de un caso. Revista atalaya médica. [Internet] 2014 [citado 28 de feb. 2017] 5:38-42. Disponible en:
http://atalayamedica. comteruel.org/index.php/revista/article/view/61/61
25 Durán M, García JA, Sánchez A. Efectividad de la fototerapia en la hiperbilirrubinemia neonatal. Enferm. Univ. [Internet]. 2015 [citado 13 sept. 2016]. Vol. 12(1): 41-45. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1665-70632015000100007 [ Links ]
26 Gonzales H. Anemias hemolíticas en la infancia. Ped. Integ. [Internet]. 2012 [citado 28 feb. 2017]. XVI(5):378.386. Disponible en:
https://www.pediatriaintegral.es/wp-content/uploads/2012/xvi05/03/Anemiashemoliticas.pdf
27 Reyes AF. La malaria en México. progresos y desafíos hacia su eliminación. Bol Med Hosp InfantMex [Internet]. 2011 [citado 6 de abr. 2016]. 68(2): 159-168. Disponible en: http://www. scielo.org.mx/pdf/bmim/v68n2/v68n2a13.pdf [ Links ]
28 Abubakar, A, Opata, MO, Zubair AI, Maigari, AK, et al. Incidence of glucose-6-phosphate dehydrogenase deficiency in anaemic patients attending General Hospital Kafanchan, Kaduna State, Nigeria. Journal of Public Health and Epidemiology. [Internet]. 2015 [citado 6 de abr. 2016]. Vol. 7(2):41-45. Disponible en: http://www.academicjournals.org/journal/JPHE/article-full-text-pdf/A54E96850262 [ Links ]
29 Bastias G, Rojas H, Colman L, et al. Glucosa 6 fosfato deshidrogenasa en indígenas piaroas en zona endémica de malaria. Rev. Duazary. [Internet]. 2017 [citado 28 de feb. 2017]. Vol 14(1). Disponible en: http://revistas.unimagdalena.edu.co/index.php/duazary/article/view/1743 [ Links ]
30 Zúñiga MA, Fontecha GA. Impacto de la deficiencia de glucosa-6-fosfato deshidrogenasa en individuos de zonas endémicas de malaria. Portal de la Ciencia. [Internet] 2015 [citado 12 de sep 2016]. 8:45-58, Disponible en: http://www.lamjol.info/index.php/PC/article/view/2158 [ Links ]