Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Revista SCientifica
versión impresa ISSN 1813-0054
SCIENTIFICA v.15 n.1 La Paz 2017
ARTÍCULO ORIGINAL
Variante de la tinción de Nitrato de Plata Amoniacal para destacar placas densas (Fibronexus) del Miofibroblasto
Variant of the Ammoniacal Silver Nitrate Staining to emphasize dense plaques (Fibronexus) of Myofibroblast
Elbert Oberto Reyes Graterol1,a, Leonardo Yhan Paolo Dugarte Quintero2,a,b, Erick Daniel Covilla Hernández3,a,b, Corina Elena Díaz Sanabria2,a,b
1 Médico Especialista en Neurocirugía del Instituto Autónomo Hospital Universitario de los Andes (IAHU-LA). Profesor titular de la Cátedra de Histología de la Facultad de Medicina de la Universidad de Los Andes. Mérida. Venezuela.
2 Estudiante de 3er año de Medicina.
3 Estudiante de 2do año de Medicina.
aEscuela de Medicina. Universidad de Los Andes. Mérida, Venezuela bMiembro de la Asociación Científica Universitaria de Estudiantes de Medicina de la Universidad de Los Andes. (ACUEM ULA-Mérida).
Correspondencia a: Leonardo Yhan Paolo Dugarte Quintero
E-Mail: drleonardodugarte@gmail.com +582767967881, +584129718843
Recibido: 11 de marzo de 2017 Aceptado: 12 de mayo de 2017 Publicado: 30 de junio de 2017
scientiflca.umsa.bo
Fuentes de Financiamiento Autofinanciado
Conflicto de Intereses Los autores declaran no tener conflictos de interés en la realización de este manuscrito.
Resumen
Introducción: : El uso de tinciones con sales de plata fue desarrollado en el siglo XIX, al principio fueron usadas para teñir tejido nervioso y tuvo un papel preponderante en el postulado de la teoría celular como dogma biológico. Posteriormente, se desarrolló su uso en tejido conectivo, pero nunca fueron utilizadas en la identificación de miofibroblastos, células del tejido conectivo con funciones muy diversas y relacionadas con patologías como las fibrosis.
Objetivo: Determinar la utilidad de una variante de la técnica de nitrato de plata amoniacal en la tinción selectiva del fibronexus, estructura característica del miofibroblasto, en la cápsula renal de ratas cepa Wistar.
Materiales y Métodos: Se aplicó técnicas de inmunohistoquímica contra alfa-actina del músculo liso y microscopía electrónica para comprobar la presencia de miofibroblastos en la cápsula renal. Por último, se utilizó la variante de nitrato de plata amoniacal.
Resultados: Se determinó la presencia de placas argirófilas en los miofibroblastos de la cápsula renal que corresponden a las placas densas halladas en inmunohistoquímica y microscopía electrónica.
Conclusiones: La variante de nitrato de plata amoniacal es útil para marcar selectivamente placas densas de ubicación subplasmalemal conseguidas en la morfología miofibroblástica. Sin embargo, aún se requiere esclarecer su fundamento y el ensayo de la técnica en otros tejidos.
Palabras clave: Tinción de plata, Argentafín, Argirófilo, Miofibroblastos, Fibronexus
Abstract
Introduction: the use of silver stainings were developed in the XIX century, at the beginning were used to stain nervous tissues, and had a major role in the postulate of cellular theory as a biological dogma. After, It was used in connective tissue, but it have never been used in identification of myofibroblasts. Connective tissue cells with many functions and related with fibrosis.
Objective: To determine the usefulness of a variant of the ammoniacal silver nitrate technique in selective staining of the fibronexus, an ultrastructural characteristic of myofibroblasts, in the renal capsule of Wistar rats.
Materials and methods: Immunohistochemistry and electron microscopy were used to determine the presence of myofibroblasts in the renal capsule of Wistar rats. Finally, the variant of the ammoniacal silver nitrate technique.
Results: the argyrophil plaques were found in myofibroblasts of the renal capsule which correspond to those ones in immunohistochemistry and electron microcscopy.
Conclusions: the variant of the ammoniacal silver nitrate technique is useful in the selective staining of subplasmalemmal dense plaques in myofibroblastic morphology. However, it is still necessary to clarify its basis and the testing of the technique in other tissues.
Keywords: Silver Staining, Argentaífin, Argyrophil, Myofibroblasts, Fibronexus
INTRODUCCIÓN
Las tinciones con sales de plata usadas en tejido nervioso fueron desarrolladas a finales del siglo XIX por Camillo Golgi, su descubrimiento representó un importante giro en la neurociencia, un campo que para la fecha era prácticamente inexistente. Años más tarde, en el mismo siglo, Santiago Ramón y Cajal estudió preparados histológicos de estructuras nerviosas de aves en distintos estadios embrionarios, esto le permitió observar el trayecto de las fibras nerviosas sin sus envolturas mielínicas debido a que ésta impide el correcto depósito de la plata. Además, gracias a sus estudios se dio el paso final para el establecimiento de la teoría celular como dogma central en Biología.
Ambos autores aportaron información muy valiosa sobre la morfología microscópica normal del tejido nervioso y gracias a ello fueron galardonados con el Premio Nobel de Fisiología y Medicina en el año 1906, primera vez en la historia que fue compartido entre dos investigadores1.
A principios del siglo XX, ya esclarecidos los fundamentos de la citoarquitectura del sistema nervioso, varios investigadores procedieron a usar estas técnicas para determinar si la morfología se encontraba distorsionada en ciertas patologías como en la enfermedad de Alzheimer, Parkinson, la corea de Huntington y demás desórdenes neurodegenerativos del movimiento. Max Bielschowsky aportó conocimiento en el entendimiento de estas patologías gracias a la correlación que hizo entre síntomas clínicos y los hallazgos histopatológicos post-mortem obtenidos gracias al desarrollo de la técnica de nitrato de plata amoniacal ideada para la tinción de axones y demás fibras nerviosas2-5. El procedimiento toma como fundamento la fabricación de espejos, donde se usa un complejo de diamina de plata que precipita en la interface entre el vidrio y las soluciones de plata creando una superficie que refleja la luz6.
El uso de tinciones con soluciones de plata se vio muy atenuado a mediados del siglo XX debido a los múltiples problemas inherentes a las distintas técnicas. Entre ellos la falta de reproducibilidad de resultados consecuente a lo impredecible y el difícil control de la precipitación de la plata sobre los tejidos, debido a que se requiere de un personal muy entrenado con gran experiencia en el área, y finalmente porque surgieron infinidad de técnicas moleculares mucho más precisas en el marcaje de los elementos tisulares y celulares deseados como la inmunohistoquímica e inmunocitoquímica; no obstante, las tinciones con sales de plata aún no han perdido su vigencia y actualmente siguen siendo usadas7.
El uso de técnicas de impregnación argéntica sobre el tejido nervioso periférico fue desarrollado posteriormente8,9, en base a la técnica descrita por Bielschowsky. Su uso en tejido conectivo se centra principalmente en la identificación de fibras de la matriz extracelular y no de elementos celulares10.
El miofibroblasto es una célula cuyo hábitat natural es el tejido conectivo y su identificación por tinciones con sales de plata nunca ha sido descrita. Son células de morfología ahusada o estrellada caracterizados molecularmente por expresar la isoforma a de la actina del músculo liso (a-SMA) y cadenas pesadas de miosina formando miofilamentos de ubicación periférica. Ademas expresan a-actinina, vinculina y vimentina.
Ultraestructuralmente se caracterizan por presentar un retículo endoplasmático y un aparato de Golgi bien desarrollados y gránulos secretorios de colágeno; por este motivo se les consideró en un principio como una subpoblación de fibroblastos activos con características intermedias entre la fibra muscular lisa y el fibroblasto11-16. Los miofibroblastos son encontrados en todas las patologías que cursan con un depósito exagerado de elementos de la matríz extracelular, es decir, fibrosis.
La fibrosis en el tejido granular que se forma durante la cicatrización de heridas y en lesiones tumorales diversas. Sin embargo, existen varios tejidos naturalmente sometidos a tensiones mecánicas donde en condiciones fisiológicas es posible encontrar "nichos" celulares de miofibroblas-tos, entre ellos el ligamento periodontal, la lámina propia del testículo, el espacio suburotelial de la vejiga urinaria, en la cápsula y trabéculas del bazo y en la capa interna de la cápsula renal11,17-20.
La principal estructura que permite determinar la existencia de un fenotipo miofibroblástico es el fibronexus, complejo proteico evidenciado bajo el microscopio electrónico como una placa densa subplasmalemal. Constituido por: haces de miofilamentos con densidades focales en el medio intracelular, fibras de fibronectina en el medio extracelular que en algunos casos asemeja a una lámina basal y transmembranalmente, complejos de integrinas que anclan directamente las fibras de fibronectina a la membrana plasmática y, a través de proteínas adaptadoras, anclan igualmente los miofilamentos a la membrana plasmática16,21-23.
Por lo general el diagnóstico histopatológico de lesiones tumorales del tejido blando de naturaleza miofibroblástica, se basa en técnicas de inmu-nomarcaje de filamentos a actina que podría resultar económicamente inaccesibles para al paciente. Para determinar con certeza la presencia y grado de desarrollo del fenotipo de este tipo celular en cualquier lesión de la que se sospeche una naturaleza miofibroblástica, se debe aplicar la microscopía electrónica dando especial importancia a la identificación del fibronexus21. Sin embargo, es una técnica igualmente costosa y que requiere de procedimientos rigurosos que relentizan la obtención de resultados. Por estos motivos es necesario el desarrollo de una técnica histológica con un grado aceptable de especificidad que permita obtener resultados confiables de forma accesible.
En nuestro laboratorio el ensayo previo de la técnica de nitrato de plata amoniacal, descrita por Max Bielschowsky, aplicada sobre muestras de tejido conectivo permitió observar placas argirófilas de ubicación subplasmalemal en células ahusadas de morfología similar al miofibroblasto. Por su distribución sugieren una homología a las placas densas subplasmalemales (fibronexus) descritas en la caracterización miofibroblástica bajo el microscopio electrónico, motivo por lo cual procedimos a adaptar esta técnica en muestras de cápsula renal de rata cepa Wistar con el objetivo de verificar la utilidad de la misma en la identificación de los fibronexus de los miofibroblastos residentes en este tejido.
MATERIALES Y MÉTODOS
Se utilizaron cinco ratas hembras de longevidad temprana de la cepa Wistar, con pesos comprendidos entre 200 - 250 gr, provenientes de los bioterios de la Universidad de los Andes (ULA), Mérida, Venezuela; con acceso a comida/agua Ad libitum, respetando ciclos de 12 horas luz/oscuridad y temperatura ambiental (23-27 °C), a partir del día 25 de febrero del año 2015 realizándose así un estudio descriptivo y prospectivo.
Se sacrificaron los cinco especímenes según normas de bioética para manipulación de animales de experimentación24, anestesiándolos con éter por inhalación en campana de vidrio. Posteriormente, se sujetaron todas sus extremidades a un soporte, se realizó una incisión medial en la piel del tórax y dos incisiones perpendiculares hacia la línea axilar anterior izquierda y derecha respectivamente exponiendo así la parrilla costal y el abdomen.
Para microscopía óptica
Se localizó el corazón y se realizó un corte en la orejuela derecha para permitir el drenaje de la sangre, seguidamente se canuló el ventrículo izquierdo y mediante la utilización de una bomba peristáltica se administró solución fisiológica (NaCl 0,9 %) durante 4 minutos hasta extraer por completo la sangre del animal. Seguidamente se realizó la perfusión con formol tamponado al 10 % durante 10 minutos. Se extrajo los riñones de cuatro de los especímenes post-fijándose por inmersión en la misma solución fijadora durante 72 horas.
Se obtuvo como muestra segmentos de la cápsula renal del polo superior de cada riñón, luego estos fueron deshidratados, aclarados en xilol, incluidos en parafina y cortados en secciones de 2 micrómetros para posteriormente ser teñidos con inmunohistoquímica e impregnados con la variante de nitrato de plata amoniacal. Se procedió, a realizar una tinción de control y luego la tinción de las muestras definitivas para cada técnica mencionada.
Sobre estas muestras se agregó el medio de montaje (Martex®) finalizando con la colocación del cubre objeto. El almacenamiento de los preparados se hace en porta láminas debidamente cerrados para evitar exposición a la luz.
Para el análisis morfométrico realizamos tomas de microfotografías con cámara digital modelo Microscope USB Digital Camera Moticam 2000, marca Motic® , utilizando portaobjeto graduado con escala métrica. Las medidas fueron realizadas a lo largo del eje celular mayor, tomando en cuenta sólo aquellas células en las que más del 90% del soma fuera visible.
Nitrato de plata amoniacal: Las láminas con las muestras se desparafi-nan con xilol y se procesan con alcoholes de concentración decrecientes hasta terminar en agua destilada. Se calienta una solución de nitrato de plata al 20 % por 15 minutos [solución (A)] y se sumergen por completo en esta solución, se mantiene en ella por 15 minutos a 37 °C. Transcurrido los 15 minutos, se colocan las láminas en agua destilada por 5 minutos.
De una solución de hidróxido de amonio al 15,9 % [solución (B)], se toman la cantidad de 6mL y se adicionan a la solución A, luego se añaden otros 3mL (gota a gota) de solución B, sin las láminas adentro. De estas mezclas se obtienen una tercera solución [solución (C)]. Las láminas permanecen 15 minutos en la solución C a 37 °C. Durante la añadidura de las gotas se puede observar la turbidez-turbiedad progresiva de la solución. Luego de los 15 minutos, se extrajeron las láminas y se sumergieron en una solución de hidróxido de amonio al 0,25 % por 3 minutos.
Se prepara una cuarta solución [solución (D)]. Las láminas se extraen de la solución de hidróxido de amonio al 0,25 % luego de los 3 minutos y a la solución C se le añade 15 gotas de la solución D, se sumerge en esta solución por 5 minutos y se prepara una quinta solución [solución (E)] en la que se colocan durante 5 minutos aproximadamente, al extraerlas las lavamos en 3 cambios de agua destilada y finalmente se deshidratan con alcoholes en concentraciones crecientes en 3 tiempos de 5 minutos cada uno y respectivo aclaramiento con xilol en 3 tiempos de 5 minutos cada uno.

Inmunohistoquímica: Se utilizó anticuerpo anti alfa-actina Smooth Muscle Actin (SMA) Concentrated and Prediluted Mouse Monoclonal Antibody. Se realiza la unión del anticuerpo primario a su epítopo específico etiquetándose el antígeno con un anticuerpo primario, se añade un anticuerpo secundario para unirse al anticuerpo primario y a continuación un marcador enzimático para enlazar el anticuerpo secundario evidenciado por una reacción colorimétrica.
Para microscopía electrónica
Se selecciona una rata de la cepa Wistar, despues de realizar la incisión abdominal, se extraen ambos riñones siendo colocados en inmersión en una mezcla 3:3 compuesta por una solución a proporciones iguales de glutaraldehido, formaldehido y tampón cacodilato. Luego se procedió a realizar cortes de 90 nanómetros teñidos con osmio, contrastadas con azul de toluidina e incluidos en resina.
RESULTADOS
Se procedió a la observación minuciosa y el análisis integrado de todos los preparados histológicos obtenidos. Se tomaron en consideración los miofibroblastos visualizados en cada campo de microscopía electrónica así como los estudios realizados con inmunohistoquímica y la variante de nitrato de plata amoniacal que proponemos.
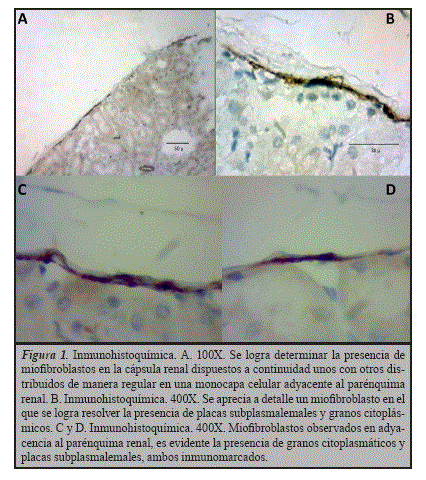
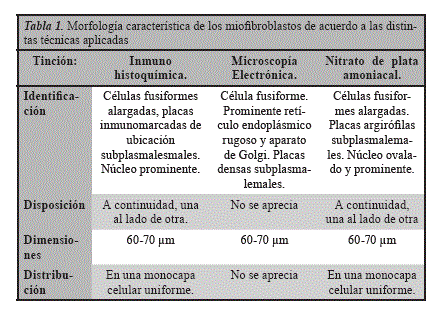
Al examinar la cápsula renal de ratas cepa Wistar bajo el microscopio óptico pudimos observar en el plano celular horizontal, que en la misma, los miofibroblastos están distribuidos formando una monocapa celular uniforme (Figura 1A) y dispuestos a continuidad unos con otros, dicho patrón es observado en adyacencia al parénquima renal y por toda la extensión de la cápsula analizada. En lo que respecta a la morfología, fueron seleccionados como referencia diez miofibroblastos que cumplieron con los criterios antes mencionados y se demostraron como células aplanadas con un tamaño promedio comprendido entre 60-70 um (Figura 1B), se observó un núcleo ovalado, prominente y eucromático.
La técnica de inmunomarcaje contra alfa actina permitió evidenciar en estas células cuerpos intracitoplasmáticos positivos para el marcador y placas subplasmalemales intensamente teñidas (Figuras 1C y D). Al emplear en los preparados la variante de la técnica de nitrato de plata amoniacal, se observó en los miofibroblastos la impregnación de placas argirófilas subplasmalemales bien definidas (Figuras 2A y B). Mediante la técnica de microscopía electrónica se destaca la presencia de placas densas de ubicación subplasmalemal (Figura 3) que corresponderían a la especialización transmembranal características de los miofibroblastos, el fibronexus.
DISCUSIÓN
Las técnicas de impregnación argéntica utilizan sales de plata para la identificación de elementos específicos del tejido que poseen moléculas con gran cantidad de grupos reductores25. El proceso generalmente consiste en sensibilizar al tejido para exponer o activar los sitios reductores. Posteriormente, se realiza la impregnación que aporta iones de plata.
Estos iones contenidos en solución son incoloros y requieren de un proceso final de reducción exógena para formar precipitados en forma de plata elemental o metálica justo en el sitio de reducción y por lo tanto en el sitio del grupo reductor7. Estos depósitos de plata metálica son los que producen la coloración observada al microscopio y dependiendo de la cantidad y tamaño de estos depósitos, presentarán un rango de color que va del marrón al gris-negro25,26.
La técnica de nitrato de plata amoniacal fue desarrollada por Max Bielschowsky originalmente para teñir fibras del tejido nervioso3-5. Posteriormente se ha desarrollado infinidad de modificaciones de esta técnica en un intento de estandarizar los resultados.
En nuestro laboratorio utilizamos una variante de esta técnica y la aplicamos sobre tejido conectivo de la cápsula renal de ratas cepa wistar, en un proceso que asemeja la obtención de negativos fotográficos posterior al revelado del rollo o película fotográfica.
En primer lugar las láminas son sumergidas en una solución de Nitrato de Plata (AgNO3) la cual aporta iones de plata simples (Ag+) que van a sensibilizar al tejido exponiendo o activando los sitios reductores. Estos iones reaccionan con los grupos reductores presentes en el tejido y forman pequeños focos submicroscópicos de plata metálica o puntos de nucleación para subsecuentes depósitos de plata.
Estos pequeños depósitos de plata metálica invisibles al microscopio son equivalentes a la "imagen latente" que se forma en una película fotográfica justo al momento en que se toma la fotografía25,26 Cuando la luz incide sobre una emulsión con cristales de bromuro de plata (AgBr) y sulfuro de plata (Ag2S) presentes en la película fotográfica, genera la activación del AgBr, es decir, la disociación en forma iónica de plata (Ag+) y bromo (Br-). Este último libera un electrón, quedando en su forma elemental (Br) para luego asociarse formando bromo molecular (Br2), el electrón liberado por el bromo es captado por el sulfuro de plata y queda cargado negativamente lo que atrae y acumula los iones de plata formando así la "imagen latente" que es invisible porque requiere un proceso de revelado que reduzca esos iones de plata a su forma metálica27.
A continuación, se agrega hidróxido de amonio a la solución y se forman iones complejos de diamina de plata [Ag (NH3)2]+ una serie de reacciones como las siguientes8:

En (a) observamos cómo el nitrato de plata reacciona con el hidróxido de amonio y forma óxido de plata que precipita y nitrato de amonio, éste último se disocia en iones amonio y nitrato (c), la forma en que realmente se encuentran disueltos en solución.
En (b) observamos cómo el óxido de plata formado en la reacción previa reacciona con el hidróxido de amonio formando un complejo diamina de plata-hidroxilo que igualmente se disocia y pasa a completar el conjunto de iones que conforman la solución (c)8.
El ion diamina de plata es el componente principal del Reactivo de To-llens, el cual es utilizado en la detección de grupos reductores como los aldehídos. Debido a que la diamina de plata es un agente oxidante y al reaccionar con el grupo a detectar, se reduce a plata metálica.
La diamina de plata en solución reacciona con los grupos reductores expuestos o activados durante la sensibilización del tejido en un proceso que se llama impregnación, estos iones complejos de diamina de plata [Ag(NH3)2]+ son más susceptibles a ser reducidos que los propios iones simples de plata (Ag+), de modo que se genera una importante ampliación de los focos iniciales de plata metálica28. Sin embargo, como comprobamos en nuestro laboratorio, aun no es posible distinguir correctamente que estructuras celulares o tisulares son las poseedoras de los grupos reductores.
Posteriormente, a esta solución de nitrato de plata amoniacal agregamos varias gotas de una solución desarrolladora cuyo principal componente es el formaldehído, un agente reductor exógeno al tejido, que reduce los iones de plata contenidos en la solución y en los puntos de nucleación. Además, forma depósitos coloidales de plata metálica.
Los pequeños focos o puntos de nucleación juegan un papel importante en esta reacción ya que son ellos los que catalizan la formación de esos depósitos coloidales de plata hasta el punto en que se hacen visibles al microscopio óptico28.
Es posible hacer una analogía con el proceso de obtención de negativos fotográficos puesto que luego de obtener una "imagen latente" invisible en la película fotográfica procedemos a revelar esa imagen utilizando soluciones compuestas generalmente de derivados del benceno como la hidroquinona un importante agente reductor que donará electrones a los iones de plata acumulados alrededor de las moléculas de sulfuro de plata, reduciendo éstos a su forma metálica y revelando así la imagen latente del negativo fotográfico27.
En el paso final de la técnica, los tejidos son sumergidos en una solución que contiene tiosulfato de sodio. Este reactivo elimina todos los residuos de plata no reducida ya que ésta, lentamente y con el paso del tiempo, se irá reduciendo por acción de la luz, lo cual puede generar artificios indeseables en las láminas28.
Es importante no confundir las impregnaciones argénticas con las tinciones argentafines y argirófilas ya que el fundamento es distinto, las segundas no requieren que el tejido sea previamente sensibilizado.
Las tinciones argentafines se fundamentan en el hecho de que algunos grupos químicos ubicados en las distintas estructuras del tejido tienen la capacidad de reducir los iones de plata cuando ésta se encuentra en soluciones básicas. Esta reducción de los iones de plata resulta en el depósito de plata elemental metálica justo en el sitio de la reducción y por consiguiente en el sitio donde se ubica el grupo reductor25.
Las tinciones argirófilas se fundamentan en que ciertas estructuras del tejido absorben rápidamente iones de plata provenientes de las soluciones con sales de plata en que son sumergidas las láminas. El fundamento histoquímico aún no ha sido del todo esclarecido. Sin embargo, varios estudios indican que algunas proteínas ricas en histidina están implicadas en esta absorción y la reacción depende muy probablemente de las interacciones fisicoquímicas débiles entre estructuras tisulares y las soluciones de plata ácidas o básicas.
En las reacciones argirófilas, luego de que se han absorbido los iones de plata, se requiere de la conversión de éstos desde su forma iónica a su forma elemental metálica. Proceso que se realiza a través de agentes reductores exógenos25,29.
Al aplicar la técnica en preparados de cápsula renal observamos (Tabla 1) una organización citoarquitectónica a manera de dos capas: la más externa predominantemente constituida por fibras con fibroblastos ocasionales y la más interna predominantemente celular constituida por una monocapa uniforme de miofibroblastos nativos, correspondiente a lo referido en la literatura20.
Es habitual que los miofibroblastos posean forma ahusada o estrellada en el conectivo12-14, un hecho relevante en nuestros estudios es que los encontrados en la cápsula renal de ratas cepa Wistar poseen una morfología aplanada, disponiéndose predominantemente en continuidad (Figura 1). Al realizar las medidas de las células se encontró que las mismas poseen una longitud aproximada de 60-70 um (Figuras 2-3).
Al emplear la variante de la técnica de nitrato de plata amoniacal en las muestras. Observamos la impregnación de placas argirófilas subplasma-lemales (Figura 2) que pudiesen correlacionarse con las placas densas observadas en dichas células mediante la microscopía electrónica de transmisión (Figura 3) y las placas inmunomarcadas con técnicas de in-munohistoquímica (Figuras 1B, C y D). Estas placas se corresponderían con el fibronexus, como se mencionó anteriormente, es característica ultraestructural y tipifica a los miofibroblastos16; resultando así la variante de la técnica de nitrato de plata amoniacal en una impregnación selectiva de estas células.
Demostramos que la impregnación de estas placas argirófilas con la variante de la técnica de nitrato de plata amoniacal se observa, al compararla con otras técnicas de microscopía óptica, con una nitidez superior, un mayor grado de delimitación en sus bordes. Además, una importante disminución en el ruido de fondo. No está claro que componentes del fibronexus serían los impregnados con la variante de la técnica de nitrato de planta amoniacal.
Otra característica a resaltar, es el hecho de que son solo los miofibroblastos las células que presentan placas argirófilas subplasmalemales al aplicar la variante de la técnica de nitrato de plata amoniacal. Esta característica diferencial nos permitiría proponerla como herramienta para identificar estas células, y participar del diagnóstico en entidades patológicas donde estén involucrados.
Debido a lo restringido que puede llegar a ser el uso de la microscopía electrónica, en la actualidad es empleada la inmuhistoquímica como técnica de rutina para la identificación de los miofibroblastos. Sin embargo, como anteriormente fue mencionado, esta técnica reclama múltiples variables, y en ocasiones dificultades para su acceso. Proponemos la variante de nitrato de plata amoniacal como una opción por su facilidad de manejo, el cómodo acceso de sus componentes y por su relativa economía.
CONCLUSIONES
Determinamos que la variante desarrollada en nuestro laboratorio de la técnica de nitrato de plata amoniacal descrita por Max Bielschowsky tiene utilidad en la identificación de placas densas de ubicación subplas-malemal conseguidas en la morfología miofibroblástica. Sin embargo, se requiere aún de una profunda investigación para establecer a cabalidad el auténtico fundamento molecular por el cual se tiñen selectivamente estas estructuras. Además, se debe ensayar la técnica desarrollada en otros tejidos, especialmente en aquellos provenientes de procesos patológicos para lograr determinar su reproducibilidad y adaptación de ésta al área de histopatología.
Agradecimientos
Al Departamento de Ciencias Morfológicas, Unidad de Histología de la Facultad de Medicina de la Universidad de Los Andes, especialmente al técnico Edgar Laguna por su apoyo en el desarrollo de este trabajo y al Centro de Microscopia Electrónica "Dr. Ernesto Palacios Prü" de la Universidad de Los Andes, especialmente a la doctora Zulma Peña.
Evento Presentado
Expuesto en el XXX Congreso Científico Internacional 2015.
REFERENCIAS BIBLIOGRÁFICAS
1 De Carlos JA, Borrell J. A historical reflection of the contributions of Cajal and Golgi to the foundations of neuroscience. Brain Res Rev. 2007; 55 (1): 8-16. [ Links ]
2 Stahnisch FW. Max Bielschowsky (1869-1940). J Neurol. 2015; 262 (3): 792-794. [ Links ]
3 Bielschowsky M. Die Silberimprägnation der Axencylinder. Neurol Centralbl. 1902; 21 (13): 579-584. [ Links ]
4 Bielschowsky M. Die Silberimprägnation der Neurofibrülen. Neurol Centralbl. 1903; 22 (21): 997-1029. [ Links ]
5 Bielschowsky M. Die Silberimprägnation der Neurofibrülen. J Psych Neurol. 1904; 3 (4): 169-189. [ Links ]
6 Castellani RJ, Alexiev BA, Phillips D, Smith MA. Microscopic investigations in neurodege-nerative diseases. Modern research and educational topics in microscopy. 2007; 1: 171 -182. [ Links ]
7 Rivas P, Chavira C, Ortiz R. Adaptación de la Técnica de Impregnación Argéntica de Llom-bart para la Demostración de Fibras Nerviosas, en Cualquier Tejido en Cortes por Parafina. Int JMorphol. 2014; 32 (3):973-980. [ Links ]
8 Garven H, Gairns F. The silver diammine ion staining of peripheral nerve elements and the interpretation of the results: with a modification of the Bielschowsky-Gros method for frozen sections. Q J Exp Physiol Cogn Med Sci. 1952; 37 (3): 131-142. [ Links ]
9 Fitzgerald MJ. A General-Purpose Silver Technique for Peripheral Nerve Fibers in Frozen Sections. Stain Technol. 1963; 38 (6): 321-327. [ Links ]
10 Peniza AV, Suárez C. Métodos de impregnación metálica para el estudio de las fibras reticulares miocárdicas. Estudio comparativo. RFM. 2002; 25 (2): 224-230. [ Links ]
11 Bochaton ML, Gabbiani G, Hinz B. The myofibroblast in wound healing and fibrosis: answered and unanswered questions. F1000Research. 2016; 5: F1000 Faculty Rev-752. doi: 10.12688/f 1000research.8190.1. [ Links ]
12 Svystonyuk D, Ngu J, Mewhort H, Lipon B, Teng G, Guzzardi D, et al. Fibroblast growth factor-2 regulates human cardiac myofibroblast-mediated extracellular matrix remodeling. J Transl Med. 2015; 13(1): 1-11. [ Links ]
13 Chitturi R, Balasubramaniam M, Parameswar A, kesavan G, Haris M, Mohideen K. The role of myofibroblasts in wound healing, contraction and its clinical implications in cleft palate repair. J Int Oral Health. 2015; 7(3): 75-80. [ Links ]
14 Darby I, Laverdet B, Bonté F, Desmoulière A. Fibroblasts and myofibroblasts in wound healing. Clin Cosmet Investig Dermatol. 2014; 7: 301-311. [ Links ]
15 Tomasek J, Gabbiani G, Hinz B, Chaponnier C, Brown R. Myofibroblasts and mechano-regulation of connective tissue remodelling. Nature RevMol Cell Biol. 2002; 3 (5): 349-363. [ Links ]
16 Eyden B. The fibronexus in reactive and tumoral myofibroblasts: further characterisation by electron microscopy. Histol Histopathol. 2001; 16(1): 57-70. [ Links ]
17 Gabbiani G, Ryan GB, Majno G. Presence of modified fibroblasts in granulation tissue and their possible role in wound contraction. Experientia. 1971; 27 (5): 549-550. [ Links ]
18 Majno G, Gabbiani G, Hirschel BJ, Statkov PR. Contraction of granulation tissue in vitro: similarity to smooth muscle. Science. 1971; 173 (3996): 548-550. [ Links ]
19 Drake M, Fry C, Eyden B. Structural characterization of myofibroblasts in the bladder. B JU International. 2006; 97 (1): 29-32. [ Links ]
20 Ross M, Pawlina W. Histology: a text and atlas: with correlated cell and molecular biology. 6th ed. Philadelphia: Lippincott Williams & Wilkins, a Wolters Kluwer Business, 2011. [ Links ]
21 Eyden B. The myofibroblast: phenotypic characterization as a prerequisite to understanding its functions in translational medicine. J Cell Mol Med. 2008; 12 (1): 22-37. [ Links ]
22 Eyden B, Banerjee S, Ru Y, Liberski P. The ultrastructure of human tumours. Applications in diagnosis and research. Heidelberg New York Dordrecht London: Springer Science & Business Media; 2014. Pág. 177-183. [ Links ]
23EydenB, Banerjee S, ShenjereP, Fisher C. The myofibroblast and its tumours. JClinPathol. 2009; 62 (3): 236-249. [ Links ]
24 Cardozo C, Osorio A, Martínez C, Rodríguez E, Lolas F. El animal como sujeto de experimental, aspectos técnicos y éticos. Chile: CIEB, Universidad de Chile; 2007. [ Links ]
25 Grizzle W. Theory and Practice of Silver Staining in Histopathology. J Histotechnol. 1996; 19(3):183-195. [ Links ]
26 Uchihara T. Silver diagnosis in neuropathology: principles, practice and revised interpretation. Acta Neuropathol. 2007; 113 (5): 483-499. [ Links ]
27 Hugh J, Field G. A Textbook of Photographic Chemistry. London: Chapman & Hall; 1963. [ Links ]
28 Kumar G, Kiernan J. Education Guide. Special Stains and H & E. 2da ed. Carpinteria: Dako North America; 2010. [ Links ]
29 Peters A. Experiments on the Mechanism of Silver Staining. Part I: Impregnation. Quarterly J Microscopic Science. 1955; 96 (33): 84-102. [ Links ]