Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares em SciELO
Similares em SciELO
Bookmark
Revista Tecnológica
versão impressa ISSN 1729-7532
Rev. Tecnológica v.13 n.19 La Paz 2017
VINCULACIÓN TECNOLÓGICA
TRATAMIENTO INNOVADOR RÁPIDO Y CONTINUO DE SALMUERAS NATURALES EN CONDICIONES DE AGUA SÚPER CRÍTICA (SCW)
Erick C. Grudner Carranza*
(*), Químico Industrial, Consultor Productividad, Calidad e Innovación tecnológica. Editor Revista Tecnológica, Facultad de Tecnología - UMSA.
History of the article: Received 30/06/2017. Style review 05/07/2017. Accepted 20/07/2017
Resumen:
Sobre la propiedad de insolubilizar contenidos salinos disueltos que manifiesta el agua en condiciones de súper criticidad SCW, y en la perspectiva de proponer un proceso innovador rápido y continuo para el tratamiento de salmueras naturales.
Efectuado un ejercicio de simulación relacionado con salmueras en el límite de evaporación solar beneficiosa (salar de Uyuni), muestra que el balance másico es favorable y extiende la posibilidad de separar el carbonato de magnesio MgCO3 en un 99,83%, además de recuperar el 100 % de la cantidad de litio inicial en dos fracciones de Li2CO3, la primera después de la carbonatación - calentamiento a 100 °C y la segunda posterior al proceso 2-SCW.
Palabras Clave: Estado súper crítico del agua SCW, solubilidad de sales inorgánicas en condiciones SCW, carbonato de litio, aerosoles.
Abstract:
On the property of insolubilizar dissolved saline ionic contents that the water shows in conditions of super criticality (SCW), and in the perspective of proposing a rapid and continuous innovative process forthe treatment of natural brines.
A simulation exercise related to brines at the beneficial solar evaporation limit (Salar de Uyuni), shows that the mass balance is favorable and extends the possibility of separating the magnesium carbonate MgCO3 by 99.83%, in addition to recovering the 100 % of the initial lithium amount in two fractions of Li2CO3, the first after the carbonation-heating at 100 ° C and the second after the 2-SCW process.
Keywords: Super critical water SCW, solubility of inorganic salts under SCW conditions, lithium carbonate aerosol.
Resumo:
Sobre a propriedade de insolubilizar conteúdos salinos iónicos disueltos que manifestam a agua em condições de súper criticidad SCW, e na perspectiva de proponente um processo inovador rápido e contínuo para o tratamento de salmueras naturales.
Um exercício de simulação relacionado a salmoura no limite de evaporação solar benéfica (Salar de Uyuni) mostra que o balanço de massa é favorável e amplia a possibilidade de separar o carbonato de magnésio MgCO3 em 99,83%, além de recuperar o 100% da quantidade inicial de lítio em duas frações de Li2CO3, a primeira após o aquecimento da carbonação a 100 ° C e a segunda após o processo de 2 SCW.
Palavras-Chave: SCW de água super crítica, solubilidade de sais inorgânicos sob condições SCW, carbonato de lítio, aerossol.
INTRODUCCIÓN
El agua como disolvente
En química inorgánica el disolvente de mayor importancia es el agua, especialmente por su gran capacidad para disociar electrolitos (sustancias iónicas que producen iones hidratados en solución), conformando así, un campo de estudio denominado química de disoluciones acuosas, sustentado en tres propiedades importantes del agua [1]:
1) Permitividad elevada (constante dieléctrica)1
2) Comportamiento base de Lewis2,
3) Formación de enlaces puente de hidrógeno3.
En condiciones normales estas propiedades del agua conjuntamente con otras, definen un comportamiento habitual que cambia radicalmente, cuando una cantidad de agua se confina en un recinto donde se incrementan superlativamente la presión y temperatura. Manifestando un comportamiento diferente después de alcanzado el punto crítico. Denominado estado súper crítico [2].
El estado supercrítico
El punto triple4 más frecuente del agua 0 °C (273,16 K), y 610,6 Pa (4,58 mm Hg), se caracteriza por los tres estados de la materia: sólido (S), líquido (L) y vapor (V). A lo largo de la curva de equilibrio vapor-líquido (zona líquida) ambas fases coexisten.
Con el aumento de temperatura y presión, la fase líquida se vuelve menos densa y la fase vapor aumenta su densidad. Como resultado, las dos fases son menos distinguibles, incrementando aún más la temperatura y presión, se alcanza el punto crítico, representado por la temperatura y presión críticas: θc = 374,2 ºC (647,4 K), pc = 22,1 MPa (221 bar, 218,2 atm). A partir de este punto, sólo hay una fase F, denominada fase supercrítica [3]. Ver figura 1.
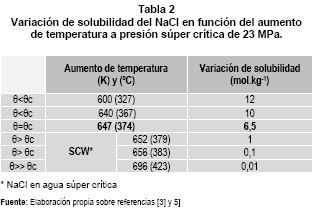
La variación5 en la densidad, permitividad relativa (constante dieléctrica) y el producto iónico del agua en la región súper crítica SCW, se consideran en la tabla 1.
Eliminación de compuestos inorgánicos en SCW
La solubilidad disminuida de compuestos inorgánicos en agua supercrítica SCW, produce la formación de una fase sólida dentro de la supercrítica. La solubilidad de cada sal depende de las condiciones del sistema SCW y puede controlarse ajustando especialmente la temperatura y la presión. [4], [5]. La fuerza impulsora para la formación de la fase sólida corresponde a la diferencia entre la concentración de equilibrio a ( θSCW y pSCW) y la concentración real de la sal. Cuanto mayor sea la diferencia entre ambas, aumenta la sobresaturación6 provocando una rápida precipitación y posterior nucleación - crecimiento de cristales.
Por ejemplo: la solubilidad para el NaCl entre 0 y 100 °C varía entre 6,10 a 6,80 mol.kgagua-1 [6], aumentando notablemente hasta los 367 °C, pero a partir del punto crítico e ingresando en la región súper crítica SCW, la solubilidad desciende, ver tabla 2. Aumentando aún más la temperatura, prácticamente en el menor tiempo, 85 a 99,85% del NaCl en solución precipita (fase sólida) que acompaña a la fase súper crítica SCW.
Para la separación de la fase sólida de SCW, se pueden utilizar: (separadores de gravedad, membranas, hidrociclones, etc.), prescindiendo de sistemas usuales de evaporación, De esta forma la fase súper crítica SCW y la sólida, pueden considerarse productos de valor del proceso SCW. [4]
Buscando aplicar este procedimiento tecnológico7 en el ámbito de nuestro país. En el presente artículo se describen aspectos importantes para un futuro y posible tratamiento SCW de las salmueras naturales procedentes del Salar de Uyuni8.
DESARROLLO
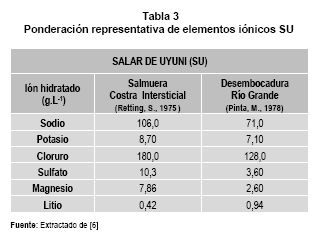
• El salar de Uyuni (SU): Proveniente de la desecación de grandes lagos pleistocénicos9, con una extensión de 9000 Km2 y a 3653 m.s.n.m. de altura, se caracteriza por ser un lago subterráneo contenido dentro de una costra de sal con facies geoquímicas dominantes (NaCl, Na2CO3, CaCO3). Reservorio de la meteorización10 física y química de los componentes de rocas volcánicas circundantes del lugar. En la tabla 3, se establece la ponderación representativa de elementos iónicos en la costra intersticial y la desembocadura del río Grande.
• Salmueras del SU y la química de disoluciones: Las salmuera del SU, están conformadas por dos sistemas mayoritarios: (cloruros-agua y sulfatos-agua) [7], que por el transcurso del tiempo, la evaporación natural y la interacción de sus constituyentes han alcanzado una etapa de saturación donde hay la máxima cantidad de solutos (sales disueltas) que el agua puede aceptar. Sin embargo este equilibrio transitorio puede ser afectado por distintos factores, destacando la evaporación gradual, que provoca la sobresaturación y posterior precipitación de los solutos formando sales simples y dobles (cloruros y sulfatos). Alcanzando un nuevo estado de equilibro que puede repetirse varias veces hasta conseguir la total eliminación de determinado (s) soluto (s), por evaporación total. [7]
Tratamiento industrial de salmueras naturales similares
De acuerdo con la capacidad de producción y la expectativa sobre los precios que tienen las sales derivadas de salmueras naturales en los mercados internacionales, se procede a evaporar la salmuera saturada, generalmente por exposición solar. Evaporación que origina la sobresaturación y precipitación de las sales que alcanzan la máxima solubilidad (cantidad de soluto correspondiente a una porción definida de agua) para una temperatura establecida.
El escalamiento en la capacidad de producción para este proceso natural discontinuo de evaporación solar, por lo general requiere de grandes áreas estanco, condiciones climáticas áridas con tasas de evaporación altas y tiempos prologados de seis a 12 meses, todos estos factores permiten conseguir significativas reducciones en el volumen del agua (sobresaturación y precipitación) que proporciona las sales comerciales objetivo. En el caso de los salares de Latinoamérica, la sal objetivo corresponde a insolubilizar el ión litio en forma de Li2CO3 carbonato de litio. La figura 2, esquematiza la reducción de volumen y la insolubilización de iones (precipitación de sales) [6].
¿Qué sucede, al reducir el volumen de la SU, desde V a menos de 0,0625V?:
Por experimentación con salmueras producidas en laboratorio y salmueras naturales (Grudner, E., 1989), además de otros importantes resultados obtenidos por otros investigadores (Crespo, P., Palma, H., 1986), (CIRESU, 1986), (Salas, A., 1988) [6]. Para el sistema natural del SU, debido a la concentración menor de litio, la zona crítica de evaporación está entre el 75 a 84 % (0,25V a 0,16V) del volumen inicial, zona donde se producen importantes pérdidas en la cantidad de litio, que disminuyen su capacidad para ser insolubilizado en combinación química de carbonato de litio desde la solución acuosa correspondiente. Si bien, al proseguir la evaporación hasta sequedad, se puede recuperar la fracción de litio equivalente para una evaporación solar al 75% en estado sólido, perdiendo el medio acuoso, se hace necesario restablecer determinados volúmenes de agua que deben ser incorporados como insumos, aumentando de esta manera los costos de producción.
Procesos en condiciones de agua crítica SCW
El proceso SCW para separar sales inorgánicas desde corrientes de agua, es una propuesta que se origina a raíz de la utilización de agua súper crítica para la oxidación de material orgánico inmerso en aguas residuales, donde la formación de sales fuertemente iónicas con solubilidades muy bajas en el medio acuoso supercrítico, ver tabla 2, hacen que las sales presentes en la alimentación, o formadas durante la reacción, precipiten dentro del reactor11 [8]. Sin embargo, este problema inherente a los sistemas SCWO12, se puede convertir en una alternativa innovadora para la separación de sales inorgánicas disueltas en corrientes de agua comúnmente denominadas salmueras13, o efectuar reacciones de hidrólisis muy rápidas con precipitación de sales con morfología y estructura cristalina nanométrica [3].
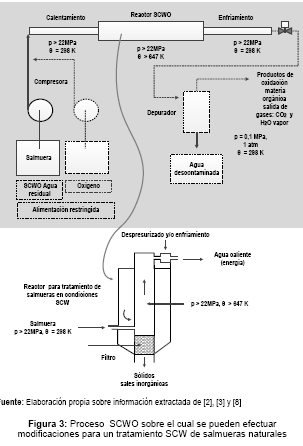
Proceso rápido y continuado que puede aplicarse sobre la salmuera natural, permitiendo obtener un aerosol14 (fase sólida y fase supercrítica) que por filtración, despresurización y/o enfriamiento proporciona: la fase sólida que nuevamente puede disolverse para una posterior utilización, vapor de agua (energía remanente) y agua líquida. En la figura 3, se muestra el esquema de un proceso SCWO sobre el cual se pueden efectuar modificaciones para un tratamiento SCW de salmueras [8].
Simulación proceso SCW
Bajo esta perspectiva, se ha considerado efectuar inicialmente un ejercicio teórico de simulación para el tratamiento SCW a partir de salmueras sometidas a evaporación solar parcial.
Cuando la evaporación solar de la salmuera natural SU alcanza el 75% del volumen inicial, las especies iónicas: sodio, potasio, magnesio, calcio, sulfatos, carbonatos tiene una disminución importante. En consecuencia, la solución residual presenta las condiciones adecuadas para ser carbonatada, permitiendo separar el carbonato de litio del carbonato de magnesio, siempre y cuando la cantidad de litio en la solución residual sea suficiente para sobrepasar la solubilidad de la sal en función de la temperatura, de igual manera pero sin el efecto de la temperatura para el carbonato de magnesio:

En consecuencia, si las cantidades de litio y magnesio en la solución residual están por debajo de estas restricciones, precipitar carbonato de litio principalmente no es posible, y es necesario proseguir evaporando la solución para insolubilizar el carbonato.
Aplicando el proceso SCW a una salmuera 75% evaporada, recuperando la fase sólida (sales inorgánicas) y redisolviendo en un volumen menor,15 las expresiones anteriores tienen la modificación siguiente:
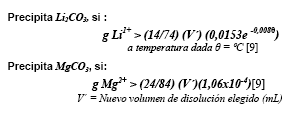
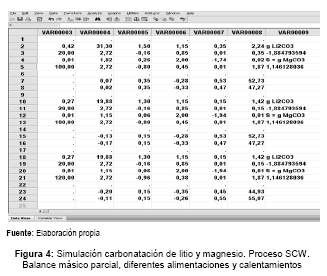
La figura 4 muestra los resultados del balance másico parcial (simulación) para la carbonatación del litio y magnesio. Determinado dos fracciones para la recuperación del Li2CO3. Una después de la carbonatación-calentamiento de la solución a 100°C y la otra a partir de esta solución en condiciones SCW.
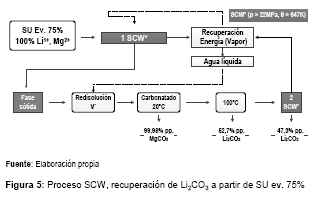
Según el esquema mostrado en la figura 5, para determinada cantidad de litio y magnesio proveniente de una SU evaporada al 75%. El primer proceso SCW proporciona la fase sólida de trabajo que es redisuelta en volumen V que permite la máxima solubilidad del carbonato de litio a 20 °C, a diferencia para el MgCO3 que precipita en un 99,98 %. Posteriormente la solución calentada a 100 °C disminuye la solubilidad del Li2CO3, precipitando la primera fracción en un 52,7%. Filtrada esta solución pasa a una segunda etapa SCW que proporciona la fase sólida o fracción segunda que recupera el restante 47,3%.
Aumentando la temperatura de calentamiento (120 °C), el porcentaje de recuperación después del proceso 2SCW es mayor, ver figura 4.
CONCLUSIONES
El tratamiento de salmueras naturales con el máximo de evaporación solar permitido, para no perder el medio acuoso necesario en la carbonatación del litio. Encuentra a través de la aplicación de procesos SCW (agua en condiciones súper críticas), la posibilidad de separar el carbonato de magnesio MgCO3 en un 99,83%, además de recuperar el 100 % de la cantidad de litio inicial en dos fracciones de Li2CO3, una después de la carbonatación- calentamiento a 100 °C y la segunda posterior al proceso 2-SCW.
Por todo lo expresado, la aplicación de procesos SCW para tratar salmueras naturales, en la perspectiva de un proceso innovador rápido y continuo, es favorable en su balance másico salino a la vez que permite recuperar agua desde las salmueras naturales. Un estudio experimental utilizando sistemas en condiciones extremas, permitiría conocer más sobre el balance másico y energético de estos procesos.
Notas
1 Se expresa también como número adimensional denominado constante dieléctrica. Para el agua corresponde a 80, significando, que la fuerza de atracción entre los iones es 80 veces menor en el agua que en el vacío, provocando así la fuerte disolución de compuestos iónicos.
2 Gilbert N. Lewis expuso una teoría sobre ácidos y bases donde no es necesaria la presencia de hidrógeno en el ácido. Por lo tanto las bases son donantes de uno o varios pares de electrones, a diferencia de los ácidos que se comportan como receptores de pares electrónicos.
3 Atracción entre un átomo de hidrógeno y otro electronegativo, formando un enlace covalente temporal, donde la densidad electrónica es mayor en el átomo electronegativo, originando un dipolo.
4 Las condiciones de equilibrio entre agua sólida (hielo) y líquido generan seis puntos triples a mínimas presiones y bajas temperaturas.
5 Otras propiedades que varían para el agua súper crítica SCW:
Baja tensión superficial y alta difusividad, penetra fácilmente en materiales sólidos poco porosos atacando estructuras insolubles desde donde se pueden extraer sustancias y compuestos solubles, llegando a difundirse mejor que los disolventes convencionales. Baja viscosidad que le proporciona propiedades de flujo muy favorables. Alta polaridad por lo que sólo puede disolver compuestos orgánicos. Los procesos transcurren en fase homogénea.
6 La sobresaturación puede producir formación de cristales muy pequeños. En consecuencia, la separación de estos cristales puede representar un desafío para el diseño del sistema de separación, aspecto que debe considerarse para la aplicación industrial de este principio y la evaluación de una posible cadena de alimentación. [2]
7 Factible para insolubilizar sales inorgánicas a partir de soluciones salinas industriales (descargas residuales) o de salmueras naturales.
8 Su pertenencia departamental corresponde a 92 % Potosí y 8 % a Oruro.
9 Pleistoceno, escala de tiempos geológicos que comprende desde hace dos millones de años hasta hace 10000 años.
10 Procesos conjuntos de desintegración y reorganización de la materia. La meteorización física o mecánica fragmenta las rocas sin cambiar su composición. La meteorización química, altera lentamente los minerales componentes de las rocas, disolviendo minerales en contacto con el agua, y produciendo reacciones químicas de oxidación, carbonatación e hidrólisis principalmente.
11 Sales que pueden acumularse rápidamente en las paredes del reactor o superficies de proceso y formar tapones, fallas e inactividad de los sistemas SCWO [8].
12 En un SCWO, por encima del punto crítico, cualquier sal disuelta en agua precipita rápidamente. Si esto sucede en el recipiente de un reactor, éste se recubre de sal y es necesario removerla para evitar la corrosión.
13 Es el caso de la tesis efectuada y patente obtenida por Ingo Leusbrock, 2011, sobre el estudio de la solubilidad de sales alcalinas y alcalinotérreas en condiciones de agua súper crítica (Removal of inorganic compounds via supercritical water: fundamentals and applications: Rijksuniversiteit Groningen), Holanda [3].
14 Dispersión coloidal (suspensión de partículas diminutas de un sólido / fase dispersada, en otra fase gaseosa /medio de dispersión).
15 Y simultáneamente la fase súper crítica en forma de energía (vapor) y agua líquida
Referencias bibliográficas:
[1] Baddeley, G., Schlessinger, G.G., Sharpe, A.G., et al, 1974, Química moderna, Ed. Alianza, ISBN 84 -206-2098-X, Madrid - España, pp: 208-210, [ Links ]
[2] Benjumea, T., JM., 02-Oxidación en agua crítica, pdf, Trabajos y proyectos fin de estudios de la E.T.S.I., http://bibing.us.es/proyectos/abreproy/70333/. Consulta: 21/06/2017, [ Links ]
[3] Leusbrock, I. 2011, Removal of inorganic compounds via supercritical water: fundamentals andapplications, ISBN (digital version): 978-90-367-4875-9, Capítulos 2, 4, 5, 7, Rijksuniversiteit Groningen, [ Links ]
[4] Zemansky, M., 1973, Calor y termodinámica, Ed. Aguilar, ISBN 84-03-201563-X, Madrid - España, pp: 31-38, [ Links ]
[5] Leusbrock, I., Metz, S., G. Rexwinkel, G., Versteeg, G. F., 2008, Quantitative approaches for the description of solubilities of inorganic compounds in near-critical and supercritical water, Journal of Supercritical Fluids 47 (2) 117127, [ Links ]
[6] Grudner, C. C. E., 2009, Proceso industrial alternativo para tratar la salmuera del salar de Uyuni por evaporación natural, intercambio iónico (catiónico) y solubilidad diferencial "evnaticasoldife", Presentación power point 25/09/2009, FacultadTécnica-IIAT, La Paz- Bolivia, [ Links ]
[7] Johnson, D.A., 1971, Aspectos termodinámicos de la química inorgánica, Capítulo 5 solubilidad de sales iónicas, Ed. Alhambra, colección Exedra, Madrid - España, pp: 114-136, [ Links ]
[8] Overview of SCWO Processing Technology - Turbosystems advantages of turbosystems engineering's SCWO technology www.turbosynthesis.com/summitresearch/sumscw1.htm. Consulta: 25/06/2017, [ Links ]
[9] Perry, H.R., Green,W. D., O'hara, M.J., 1997, Perry'schemicalengineers' handbook, Table 2-10 Physical properties of pure substances, Ed. Mac Graw Hill, ISBN 0-07-049841-5, USA. [ Links ]