Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
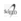 Similares em SciELO
Similares em SciELO
Bookmark
Revista Tecnológica
versão impressa ISSN 1729-7532
Rev. Tecnológica v.12 n.18 La Paz 2016
VINCULACIÓN TECNOLÓGICA
TECNOLOGÍAS EN DESARROLLO PARA LA REDUCCIÓN DEL DIÓXIDO DE CARBONO (CO2) AMBIENTAL
Erick C. Grudner Carranza*
History of the article: Received 15/08/2016. Style review 17/08/2016. Accepted 22/08/2016
Resumen
El conocimiento adquirido, después de un largo tiempo de experimentación muestra que: para conseguir el efecto deseado (reducción del CO2 ambiental), se ha elegido la reacción catalítica principalmente por su rapidez de conversión cuando se aplica en: procesos electroquímicos aprovechando fenómenos de superficie y catálisis heterogénea sobre electrodos normales y nano estructurados. Tanto como en procesos de catálisis heterogénea y homogénea utilizando montajes experimentales muy exigentes. Si bien, los resultados aún son diversos y sólo a escala laboratorio (tecnologías en desarrollo), reflejan las investigaciones experimentales de la fisicoquímica para resolver este problema.
PALABRAS CLAVES: Efecto invernadero del CO2 dióxido de carbono, factores de reacción, reacción catalítica, fisicoquímica experimental instrumental.
Abstract
The acquired knowledge, after a long time of experimentation shows that: to achieve the desired effect (reduction of environmental CO2), the catalytic reaction was chosen mainly because of its rapid conversion when applied in electrochemical processes taking advantage of surface phenomena and catalysis heterogeneous on normal and nanostructured electrodes. Heterogeneous and homogeneous catalysis processes using very demanding experimental assemblies. Although the results are still diverse and only on laboratory scale (developing technologies), they reflect the investigations of experimental physicochemical to solve this environmental problem.
KEYWORDS: Greenhouse effect of CO2 carbon dioxide, reaction factors, catalytic reaction, instrumental experimental physicochemical.
Resumo
O conhecimento adquirido, depois de um largo tempo de experimentação mostra que: para conseguir o efeito desejado (redução do CO2 ambiental), o ha elegido a reação catalàtica principalmente por seu rápido de conversão quando é aplicado em processos eletroquímicos aprovechando fenômenos de superfície e catálisis heterogénea sobre eletrodos normais e nano estruturados. Procesos de catálise heterogénea e homogênea utilizando montajes experimentais muy exigentes. Se bem, os resultados ainda são diversos e uma escala de laboratório (tecnologias em desenvolvimento), refletir as pesquisas da físico-química experimental e problema ambiental de CO2.
PALAVRAS–CHAVE: Efeito invernadero do CO2 dióxido de carbono, os fatores de reação, a reação catalítica, físico-química instrumental experimental.
INTRODUCCIÓN
El dióxido de carbono CO2 componente de la atmósfera, en los últimos años ha alcanzado mayor notoriedad por ser parte principal y que en conjunto con el: metano, óxido nitroso, ozono troposférico, CFC[1] y vapor de agua están aumentando el efecto invernadero natural (Greenhouse effect)[2] por presentar capacidad adicional para absorber un porcentaje alto de la energía irradiada por el planeta, calentando la atmósfera y devolviendo nuevamente parte de esta energía hacia la Tierra y el espacio exterior.
Conjunto de gases que absorben la radiación solar de onda corta (λ < 4μm – región ultravioleta del espectro visible) que ingresa a la Tierra y además tienen capacidad para absorber parte de la energía irradiada por la Tierra a longitudes más largas de (λ > 4μm – región infrarroja espectro visible). Predominando sobre los otros gases atmosféricos de invernadero, el CO2 y H2O vapor, por las bandas de absorción de radiación térmica que presentan, ambos compuestos absorben mejor la radiación solar y/o terrestre en determinadas longitudes de onda, ver figura 1, más aún, cubren casi todas las bandas de absorción infrarrojo de la atmósfera [1]. En consecuencia su efecto invernadero[3] atribuible es más notorio que el de los otros gases por las cantidades acumuladas en la atmósfera.
El Oxígeno O2 y Nitrógeno N2, gases que también son parte del aire no absorben la energía infrarroja luminosa proveniente del sol debido a que son moléculas con átomos de igual electronegatividad y no generan un dipolo eléctrico donde los electrones de enlace no se polarizan, como lo hacen en los gases de efecto invernadero (CO2, H2O, CH4, NOx), que absorben esa energía para vibrar, rotar[4] y ganar calor.
Respecto al vapor de agua atmosférico, al ser regulada su concentración por el intercambio entre la hidrosfera y la atmósfera (condensación, vaporización), su contribución al efecto invernadero real, no está definido totalmente, debido a que las cantidades de emisión antropogénica de vapor son pequeñas (1,4%) en comparación con las cantidades procedentes de la evaporación natural [1]. Por otra parte, el vapor de agua atmosférico, también absorbe la energía infrarroja del sol, pero al formarse las nubes, la disipación de energía infrarroja que llega desde el sol es reflejada hacia el espacio exterior.
Si bien elciclo del carbono, mantiene en la biota[5] mundial un equilibrio dinámico de absorción y devolución en forma de CO2 (fotosíntesis, respiración y descomposición) [4]. Actualmente no sucede lo mismo con los equilibrios de difusión y absorción del CO2 entre la atmósfera e hidrosfera, proceso que al solubilizar este gas, regula desde la hidrósfera la concentración del CO2 atmosférico, situación observada ya en 1957 cuando Roger Revelle y Hans Suess, proponiendo una explicación a través del efecto Reville (mecanismo de retardo en la difusión y absorción del CO2 antropogénico por las aguas oceánicas), identificaron que la difusión del CO2 en aguas superficiales es un proceso relativamente rápido, medido en días o meses, sin embargo el retardo se presenta cuando esas capas superficiales se mezclan con las capas interiores de agua restantes, que al contrario del proceso anterior, es lento y medido en años o siglos.[6] [5]
En consecuencia, la conclusión fue que los océanos ya no pueden absorber eficazmente la emisión acumulativa y vertiginosa del dióxido de carbono. Aún considerando que, la concentración del CO2 atmosférico[7] estuvo regulada por los océanos, que actuaban como reservorios de (Carbonatos).

Todo parece indicar que este equilibrio fisicoquímico ha sido alterado, comprometiendo el régimen de absorción del CO2 en aguas oceánicas y la posterior deposición sedimentaria. Provocando de esta forma, la acumulación temporal de CO2 en la atmósfera. [6]
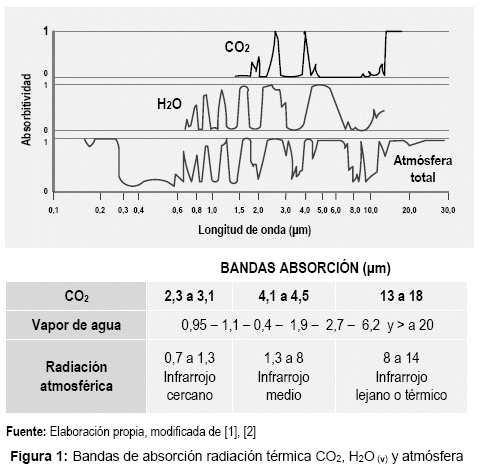
La figura 2, muestra el seguimiento global más preciso de la concentración de CO2 para el periodo 2002 a 2012, obtenido por el satélite de reconocimiento atmosférico ENVISAT a través de su analizador químico SCIAMACHY (Scanning Imaging Absorption SpectroMeter for Atmospheric Cartography - Espectrómetro[8] de Imagen de Escaneo de Absorción para Cartografía Atmosférica) y TANSO en GOSAT. [7] Los resultados establecen que el dióxido de carbono atmosférico continúa creciendo aun produciéndose las fluctuaciones anuales que son causadas por la absorción y liberación del gas por la biota (fotosíntesis, respiración y descomposición).
Contrariamente con los esfuerzos internacionales para reducir las emisiones gaseosas con efecto invernadero. Es así, que durante el primer semestre de 2016, el promedio en la concentración de CO2, marcó 403 ppm (partes por millón en volumen)[9] [8], registro que ha excedido los límites de seguridad determinados en las Conferencias sobre el Calentamiento global, gases de Efecto invernadero y Cambio climático.
En consecuencia, para evitar que continúen aumentando principalmente las emisiones de CO2 es urgente reducirlas drásticamente, y lo más importante, es: ¿saber qué hacer con éstas?, interrogante que durante los últimos años ha originado varias propuestas tecnológicas de solución reflejo de las formas como se absorbe el CO2 en la naturaleza, por ejemplo: se está buscando imitar el proceso de fotosíntesis artificial[10], para la producción de combustibles. [8]
En otros casos se está buscando capturar las emisiones de CO2, absorbiendo el gas en compuestos orgánicos [9] (alcano aminas), o sobre compuestos inorgánicos (hidróxidos y carbonatos), esta segunda alternativa es conducente a conseguir la sedimentación y almacenamiento en forma de carbonatos, similar al proceso que se presenta en los océanos.
Simultáneamente con estas propuestas tecnológicas que son un reflejo de las formas como se absorbe el CO2 en la naturaleza, también se está buscando la manera de revertir en parte la reacción de combustión característica que tienen los combustibles fósiles (hidrocarburos), tomando en cuenta que el factor estequiométrico[11] para la producción de CO2, a partir de las reacciones de combustión relacionadas con el carbono fósil fijo, corresponde a:
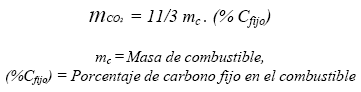
Para los combustibles usados frecuentemente en las transformaciones energéticas, el factor estequiométrico está alrededor de 1:3, es decir, que por cada unidad de masa de carbono fijo fósil combustionado se producen 3 unidades de masa de CO2. Incremento significativo en la masa y volumen gaseoso de CO2 que tiene un efecto particular sobre la atmósfera [2]. En consecuencia, se está tratando de encontrar una reacción química que permita obtener a partir del CO2, productos de utilidad y a la vez que mitiguen emisiones de este gas.
Temática que es considerada en el presente artículo desde la perspectiva de un sistema de transformación tecnológica innovador que extienda la reacción (mayor conversión a productos), proponga condiciones menos exigentes para la reducción del CO2 y que actuando sobre este compuesto, sea una alternativa económica para atenuar su efecto ambiental rápidamente.
Eligiendo para este propósito los siguientes sistemas de transformación tecnológica en desarrollo:
· La reducción electroquímica del CO2 en condiciones de catálisis heterogénea,
· Reacciones catalíticas heterogéneas y homogéneas aplicando variables presión- temperatura-naturaleza de los reactivos.
DESARROLLO
Antes de la evidencia sobre el incremento en la concentración de CO2 ambiental, las fuentes naturales de este gas establecían su procedencia mínima en la atmósfera (0,03% en volumen ≈ 260 ppmvv) [10] y en los manantiales de aguas minerales efervescentes de mediana y alta presión.
Para su obtención inducida, se utiliza cualquier fuente de carbón natural o derivada, que en exceso de aire y por el estímulo fotoquímico del (fuego o chispa), sigue la reacción[12] de oxidación representada por la ecuación siguiente:

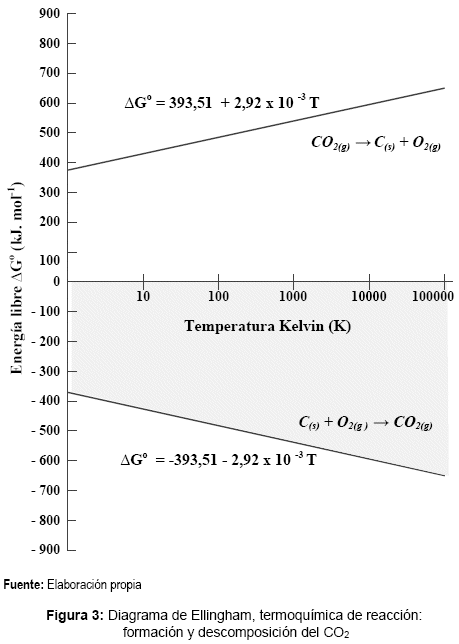
La termoquímica de esta reacción, representada por la ecuación de energía libre de formación ∆Go, muestra la espontaneidad de la reacción (energía libre negativa) en función del aumento de temperatura, y contrariamente para la reacción inversa la espontaneidad disminuye (energía libre positiva) con el aumento de temperatura.
En la figura 3, se grafica un diagrama de Ellingham para la formación y descomposición del CO2, en un rango amplio de temperaturas. Revelando que la molécula una vez formada, es muy estable, y difícil de descomponerse en sus elementos espontáneamente y por acción del aumento o disminución de la temperatura.
Con relación a los otros factores de reacción: presión, concentración de reactivos y catálisis[13], para establecer la influencia de sus efectos, es necesario confinar el CO2 en sistemas reactivos aislados de estudio, destacando entre estos sistemas: a) Celdas electrocatalíticas, b) Reactores catalíticos de alta (presión-temperatura).
a) Celdas electrocatalíticas:
Catálisis heterogénea y reducción electroquímica de CO2, sobre Electrodos de Difusión de Gas EDG
Presentado ante el mundo hace aproximadamente 35 años el problema ambiental del efecto invernadero y cambio climático asociado principalmente con el dióxido de carbono [11], la descomposición por espontaneidad de reacción (energía libre negativa) en relación con la temperatura, concluía que este gas es muy estable (ver figura 3), y la única vía importante y de menor costo corresponde a su descomposición a través de procesos naturales.[14]
Si bien la química experimental reporta reacciones de descomposición del CO2, éstas alcanzan rápidamente el equilibrio generando cantidades pequeñas de productos de reacción, marcando altas temperaturas y presiones, que demandan procesos de transformación costosos. Como es el caso de la siguiente reacción:
![]()
Que de acuerdo con la ecuación simplificada de energía libre de formación (espontaneidad), se produce por encima de los 2275,78 K. Con un rendimiento escaso de conversión.
![]()
Reacción que puede efectuarse con menores consumos energéticos a través de un proceso electroquímico que produce mezcla de monóxido de carbono CO e hidrógeno H2 (gas de síntesis o syngas) en un compartimento y oxígeno en otro. Aplicando densidades de corriente altas, debido a que utiliza Electrodos de Difusión de Gas (EDG), caracterizados por tener una elevada área activa y permitir una alimentación constante del gas reactivo.
La figura 4, muestra un esquema de montaje experimental frecuentemente utilizado para estudiar estas reacciones a través de las curvas de polarización que relacionan la corriente y el sobrepotencial o la corriente y potencial de un electrodo en particular, variables de mucha importancia en la cinética electroquímica, porque permiten establecer el mecanismo de reacción del proceso electroquímico en el electrodo de estudio.

Electrodos de Difusión de Gas EDG [12], [13]
La función principal de los EDG es aumentar la conductividad y conducir a los gases para su contacto con el catalizador, proporcionando: soporte para la capa del catalizador, buena resistencia mecánica y fácil acceso del gas hacia el catalizador, funciones que son atribuidas a la porosidad de estos materiales sólidos, que permite la difusión gaseosa,[15] involucrando tres fases que participan en la reacción: gas de reacción, electrolito y electrodo EDG conformado por dos capas: Capa de difusión que se encuentra en contacto con la fase gaseosa, cumple las funciones de colector de corriente y soporte de las otras capas.
Para su elaboración se utiliza papel carbón o malla metálica, negro de carbón y un aglomerante que hace hidrófoba la capa de difusión y la mantiene seca, para que el gas atraviese más rápidamente. Sobre la capa de difusión está la Capa activa en contacto con la disolución electrolítica y es donde se produce la reacción electroquímica. Para su conformado se mezclan negro de carbón, aglomerante, fibras de carbón y partículas metálicas (catalizador).
Estructura doble capa que se aprovecha para transportar las moléculas del gas reactivo desde el electrolito, hasta los centros catalíticos del EDG, a través de la: Disolución de moléculas gaseosas (gas-electrolito). Difusión de moléculas de gas disueltas, desde la zona de contacto gas-electrolito hasta la zona electrolito-electrocatalizador (la velocidad de difusión es mayor al disminuir el espesor de la película de líquido). Interacción del gas disuelto con la superficie del electrodo (adsorción en determinados casos), seguida de la transferencia electrónica.
Para favorecer a esta última etapa, los EDG tienen una gran superficie de contacto entre los centros activos del catalizador, el electrolito y las moléculas del gas reactivo, conformando así, un sistema dinámico sólido-líquido-gas, muy sensible a los cambios de presión del gas en los espacios intersticiales (poros) donde se alcanza el equilibrio entre la fuerza capilar y la presión del gas.
El comportamiento de los EDG, depende de los materiales usados en su preparación: (tipo de soporte, material que actúa como matriz, material aglomerante, y metales finamente divididos puros o mezclados, que intervienen como agentes catalizadores electroquímicos). Específicamente para la reacción representada por la (Ec. 1), en las tablas 1 y 2, se muestra parte de la recopilación efectuada por (Sánchez, 2004):
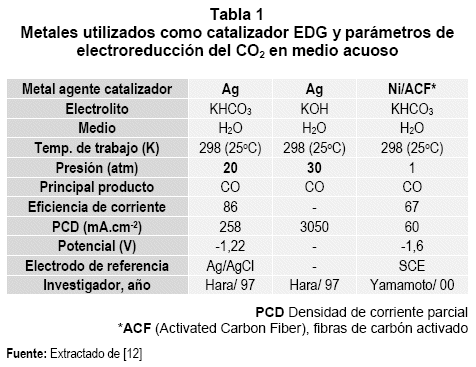
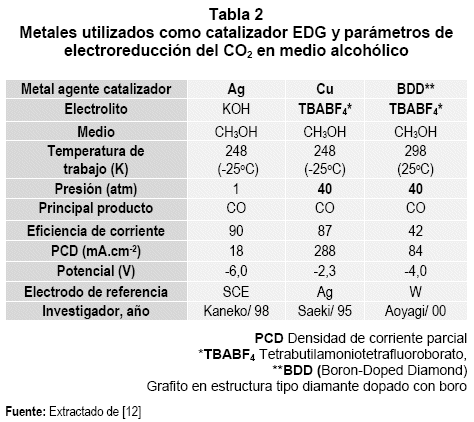
En ambas tablas los compuestos químicos utilizados como electrolito, condicionan aumentar la solubilidad del gas en el medio (H2O = 0,033 y CH3OH = 0,17 mol.L-1 a 298,15 K), aumentando también la conductividad electrolítica. La presión de trabajo, por lo general es alta y responde a un procedimiento que está relacionado con el aumento en la densidad de corriente, aun siendo limitada la solubilidad del gas, coadyuvando, a esta mejora el descenso de temperatura. Con relación al producto principal, si bien el CO e H2 presentan un porcentaje mayor, en conjunto con estos también se producen otras combinaciones en menor porcentaje: alcoholes, hidrocarburos, ácido fórmico, etc.
En cuanto a la eficiencia y la densidad de corriente, los resultados son diversos al igual que los potenciales de polarización. La presentación de los reportes investigativos (última fila tablas 1 y 2) que abarca la década de los 90 para la escuela japonesa, refleja las limitaciones del proceso para fijar la reacción a menor presión de alimentación.
Sin embargo (Imai, J., et-al, 1991) [14] y (Yamamoto, D., Fujishima. H., et-al, 2000) [15], reportan sobre un procedimiento para adsorber gases y partículas de catalizadores al interior de soportes porosos constituidos por Fibras de Carbón Activado (ACF) con dimensiones extremadamente pequeñas (nanotubos de diámetro ≤ a 10-9 m), dimensiones de pared que permiten elevar la presión interior a más de 200 atm (20 MPa). Alimentando CO2 a la presión atmosférica normal de 1atm.
Aplicando este procedimiento (Sánchez, C., 2004) [12], además de evaluar los efectos de la: química superficial, concentración del precursor metálico, naturaleza de la sal metálica y del pH, obtuvo los siguientes resultados de eficiencia de corriente. Ver figura 5. El EDG nano estructurado con partículas de metal catalizador níquel, produce H2 y CO en proporciones variables que se controlan a través del potencial aplicado sobre el EDG. Así, la obtención de gas de síntesis en proporción molar (H2/CO) 2:1, aplicando un potencial de trabajo –1,9 V al EDG, es útil para una variante de la síntesis catalítica posterior del metanol a partir del gas de síntesis o syngas (CO:2H2).

Otras investigaciones
Durante estos últimos años se han incrementado investigaciones sobre la reducción del CO2 aplicando procesos electroquímicos de catálisis heterogénea. La tabla 3, resume las siguientes:
Tabla 3
Procesos electroquímicos de catálisis heterogénea para la reducción del CO2
| [16] Centro de investigación y autores: 2016, Universidad de Ciencia y Tecnología de China Yongfu Sun, y colaboradores. Caracterización: Electroreducción catalítica heterogénea. Eficacia faradaica de más del 60% en 20 h. Catalizador: Capas de Co3O4 de 1,72 y 3,51 nm de espesor, por calentamiento rápido. El catalizador adsorbe abundantes sitios activos de CO2 para la reacción. Productos: Mezcla de combustibles líquidos. [13] Centro de investigación y autores: 2007, Asociación Argentina de Investigación Fisicoquímica, Tandil, Buenos Aires, Pasquale, M.A., Elissalde, M., Rodríguez Nieto, F.J. Caracterización: Electroreducción catalítica heterogénea. EDG – Cu, eficiencia de reducción cien veces mayor a la obtenida con un electrodo de cobre masivo. Catalizador: Partículas de Cu en suspensión de alcohol isopropílico y PTFE sulfonado (Nafion R) pulverizado sobre una matriz de carbón y posterior sinterizado. Productos de reacción: Gas de síntesis. [18] Centro de investigación y autores: 2005, Universidad de los Andes (ULA), Facultad de Ciencias, Departamento de Química, Laboratorio de Electroquímica, Martínez, I., Hernández, R., Salazar, E., Pérez, B., Márquez, O., Márquez , J.. Caracterización: Actividad electrocatalítica, voltametría cíclica en dos medios electrolíticos: oxalato de amonio y perclorato de litio, aplicación de voltametría y electrólisis potenciostáticas, análisis productos en fases gaseosa y líquida. Catalizador: Electrodo de platino modificado, primera modificación electrodo recubierto de una película de 1,3-dimetoxibenceno (1,3-DMB) y sobre ésta se realizó un segundo recubrimiento de cobre. Productos: CH4, C2H4, C2H6, H2. [18] Centro de investigación y autores: 2012, Instituto Tecnológico de Massachusetts, MIT, Cambridge - USA, Kimberly Hamad-Schifferli, Yang Shao-Horn, Zhichuan Xu Erica Lai. Caracterización: Electroreducción catalítica heterogénea. Electrodos con nanopartículas Au-Cu. La oxidación de AuCu se estudió en función de la composición y temperatura, a 110 °C el Au estabilizó al Cu. Las mediciones electroquímicas indican que el AuCu podría ser un catalizador que disminuya el sobrepotencial de reducción de CO2. Catalizador: Nano partículas de oro y cobre. Productos: Metanol y metano. [19] Centro de investigación y autores: Programa Marco de la Comisión Europea (VIPM). Proyecto específico ELCAT, Instituto Max Planck en Alemania, Universidades: Louis Pasteur Francia, Patras Grecia, coordinador de investigación profesor Gabriele Centi Universidad de Mesina, Italia. Caracterización: Electroreducción catalítica heterogénea, se utilizó luz solar (catalizador de titanio) fotoelectrólisis del agua, separando hidrógeno, electrones y oxígeno. En la segunda etapa, los electrones libres se utilizan para reducir el CO2 y unir átomos de carbono. Eficacia del uno por ciento a temperatura ambiente. Catalizador: Partículas de platino y paladio en nanotubos de carbono. Productos de reacción: Gasolina y diésel. |
Fuente: Elaboración propia, resumen de [16], [13], [18], [19]
Últimos avances sobre la electroreducción del CO2 utilizando nanoestructuras de carbón [20]
Los EDGs nanoestructurados, si bien, proporcionan cantidades importantes de gas de síntesis (mezcla de CO, H2), también producen cantidades menores de alcoholes (CH3OH metanol principalmente) y ácido fórmico (HOOCH), dependiendo del metal usado como catalizador. No descartando también la posibilidad de obtener etanol (C2H5OH) por electroreducción del CO2.
Al respecto, en la revista Chemistry Select 2016, 1,1–8, versión on line, se informa sobre una investigación efectuada en el Center for Nanophase Materials Sciences Oak Ridge National Laboratory Oak Ridge TN – USA,[16] referida con la conversión electroquímica de CO2 a etanol (C2H5OH) con electrodos catalíticos nano estructurados de cobre en medio acuoso a temperatura y presión ambiente, caracterizados por presentar una alta eficiencia de corriente faradaica (63% a -1,2 V frente a un electrodo de referencia RHE) y alta selectividad (84%).
El electrodo fue elaborado depositando nanopartículas de Cu sobre una película grafeno[17] de alta textura dopado con nitrógeno. Según el análisis electroquímico y los cálculos de la teoría de la densidad funcional (DFT) el mecanismo preliminar de reacción indica que tanto los sitios activos de las nanopartículas de Cu[18] y las nanoespigas de carbono trabajan en tándem, es decir, que simultánea o sucesivamente controlan la electroreducción del CO2. Produciendo una mezcla de compuestos en soluciones acuosas saturadas de dióxido de carbono CO2 con predominio de H2 a sobrepotenciales bajos. Especies CO y HCOO- a sobrepotenciales altos. Aplicando potenciales extremos, las especies son hidrocarburos y oxigenados multi-carbono.
Debido a la fuerte interacción de Cu-grafeno a través de sitios defectuosos [20]. Los primeros estudios revelaron que la superficie del electrodo estaba cubierta por CO adsorbido durante la reducción de CO2 y que el CO produce hidrocarburos y oxigenados multi-carbono en ausencia de CO2, pero aún se necesitan potenciales muy negativos (ver figura 6) para promover la reducción de CO sobre el H2. La alta selectividad de electrorreducción de CO2 a etanol como producto principal, se debe al recubrimiento de Cu derivado del óxido y caracterizado por el tamaño de grano depositado sobre el electrodo de grafeno dopado con nitrógeno que le otorga a la superficie unos pliegues agudos y desordenados, nanoespigas de carbono o CNS.
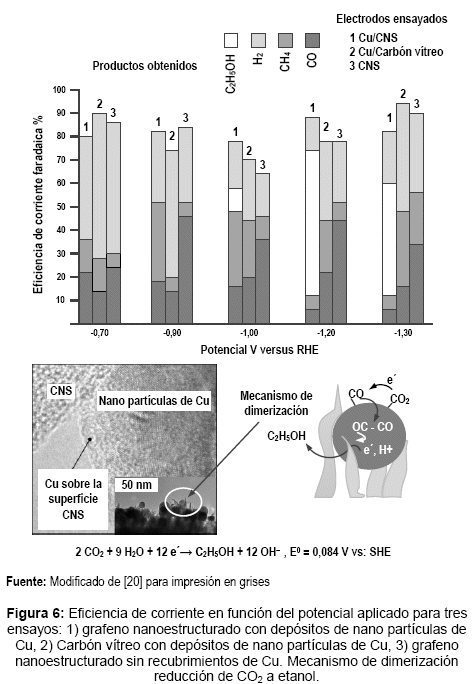
Bajo este tipo de estructura, el electrodo de carbono nanoespigado (CNS) con nanopartículas de Cu (Cu/CNS) tiene una selectividad mayor para la electrorreducción de CO2 que la evolución de H2, con alta eficiencia faradaica para producir etanol. Ver figura 6, potencial -1,2 V, y reacción global. Si bien el mecanismo de reacción aún no está totalmente explicado, la interacción entre los sitios catalíticos vecinos de Cu y CNS, por la forma estructural que adquiere el electrodo, es una posible causa del alto rendimiento en etanol.
b) Reactores catalíticos alta (presión y temperatura)
Conversión catalítica de CO2 a CH3OH [21], [22]
En contraposición con los procesos ordinarios de síntesis del metanol caracterizados por la baja conversión del CO2 y selectividad limitada del CH3OH, que aumentan el número de etapas de recuperación de reactivos no convertidos, por efectuarse entre 50 a 100 Atm.
El equipo de investigación dirigido por Atsushi Urakawa, del Instituto Catalán de Investigación Química ICIQ Tarragona, ha conseguido optimizar un proceso catalítico continuo de hidrogenación del CO2 en metanol, trabajando con altas presiones (hasta 500 Atm) y por encima de 250 ºC de temperatura, para conseguir un rendimiento del 95% y alta selectividad [21], ver figura 7.

Desarrollando para este propósito un sistema reactor que usa una bomba de jeringa Teledyne Isco 260D, acoplado a instrumental espectroscópico para seguir y medir el comportamiento de fase y las reacciones en condiciones de funcionamiento de alta presión y temperatura in situ.
El diseño tecnológico experimental y los resultados se muestran en la figura 8. La corriente de salida efluente del reactor se analizó por cromatografía de gas. Para este propósito, el reactor de laboratorio fue sustituido por una célula microrreactor de alta presión especialmente diseñada en materiales transparentes a la frecuencia de luz utilizada para la excitación. Ver figura 8 (horno de reacción). [22]
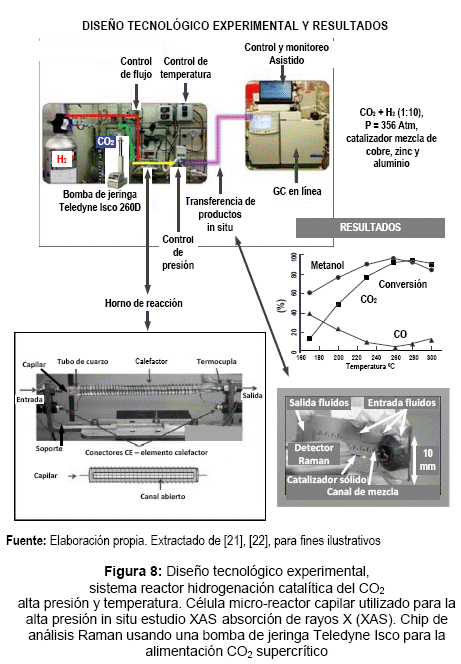
La bomba de jeringa de alta precisión Teledyne Isco 260D
Suministra CO2 líquido a una velocidad de flujo constante y presión de reacción exigida (controlada por un regulador de contrapresión). El CO2 dispensado desde la bomba se mezcla con hidrógeno de alta presión regulado por un controlador de flujo másico (no mostrado), y la mezcla se alimenta a un reactor que contiene un catalizador de Cu, Zn y Al. Proporciona el control del flujo de alimentación (caudal) para el H2 y CO2 con una precisión de 0,5% o más de un valor de consigna. Fijando el valor más bajo de operación en 2 L. min-1 de CO2 líquido[19] a través de una amplio rango de presiones menores a 500 Atm.
La bomba tiene incorporadas alarmas de seguridad[20] para detectar el caudal y la presión límite del sistema y activar su cierre eventual, así como para alertar al usuario sobre cualquier cambio anormal en la reacción de hidrogenación del dióxido de carbono.
La reacción catalizada a presión y temperatura alta
Un parámetro indicativo para medir la conversión del proceso y la eficiencia, es el rendimiento horario de peso (Weight Time Yield WTY), que para este caso se representa por la cantidad de producto (metanol) obtenido expresado en miligramos de CH3OH por gramo de catalizador por hora (mgmetanol. gcat-1. h-1) = WTY. Desde el punto de vista comercial, este ratio debe estar por encima de la unidad. Los resultados representativos de ensayos catalíticos se presentan en la tabla 4.
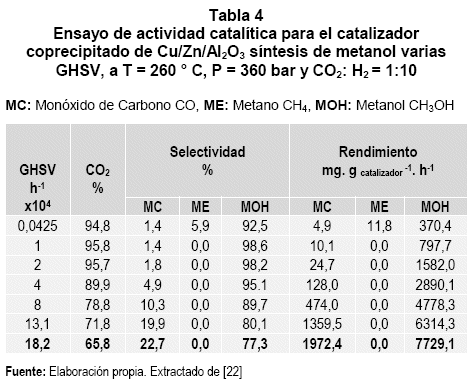
Experimentando con la relación CO2: H2 ,1:3 definida por la estequiometria, la conversión CO2 más alta obtenida fue del 37% con una selectividad de metanol del 72%. Incrementando la relación CO2: H2 ,1:10. La conversión de CO2 alcanzó el 95 % y la selectividad para el metanol llegó al 98%, y la formación de CO estuvo en una proporción despreciable. La capacidad de la bomba de jeringa para operar en una amplia gama de velocidades de flujo con alta precisión hizo posible variar las condiciones de GHSV[21] como se muestra en la tabla 3. Un aumento de la GHSV hasta 18,2x104h-1 dio lugar a una conversión del 65,8%, y una selectividad hacia metanol del 77,3. Bajo esta condición se obtuvo un WTY de 7,7 gmetanol.gcat -1.h-1, superior a cualquier valor WTY reportado hasta el momento [21]. En cuanto al comportamiento del catalizador, el estudio in situ XAS (Espectroscopia de difracción de rayos X) mostró que el cobre activo en el catalizador de síntesis de metanol permanece en el estado metálico en las condiciones de reacción [22]. Por otra parte el chip Raman, en el comportamiento de fase densa de CO2 puede ser estudiado, separando claramente rasgos característicos de los espectros Raman para el gas, líquido y estados supercríticos [22].
Catálisis homogénea
La electroreducción catalítica y la reducción catalítica del CO2, sigue dos formas de catálisis. La heterogénea o de contacto, que de acuerdo con lo expuesto en el artículo utilizan tanto electrodos metálicos sólidos, como partículas metálicas dispersadas sobre otros materiales. La otra forma, corresponde a la catálisis homogénea donde el catalizador se encuentra junto con los reactivos, (en la misma fase). Modalidad usada también en investigaciones recientes dirigidas a la reduccción del CO2. Como son los casos experimentales siguientes:
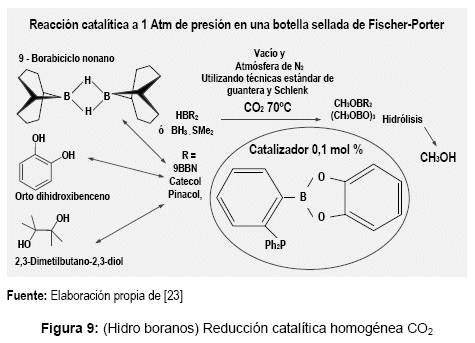
1) Catalizador de fosfina borano altamente activo para la reducción del CO2 a CH3OH utilizando hidro boranos, metodologías computacionales avanzadas de control y medios experimentales bajo condiciones muy exigentes para verificar la reacción. Universidades: Laval (Canadá) y Touluse (Francia) [23], ver figura 9.
2) Uso de complejos de rutenio fosfina hidrogenados como catalizadores homogéneos.
Investigadores de la universidad del Sur, California – USA, observando que los órganocatalizadores por encima de 150 ºC se inhiben, desarrollaron un órganocatalizador utilizando rutenio metálico que no se inactiva y es más estable en condiciones de altas temperaturas. En consecuencia, al ser termoresistente mantiene su actividad química y mezclado con otros compuestos auxiliares de reacción, puede convertir continuamente hasta el 79% del CO2 atmosférico en metanol [24].
CONCLUSIONES
Desde la perspectiva de un sistema de transformación tecnológica innovador que extienda la reacción (mayor conversión de un determinado producto), proponga condiciones menos exigentes para la reducción del CO2 y que actuando sobre éste, sea una alternativa económica para mitigar su efecto ambiental. Se llega a lo siguiente:
Efectuada la revisión de procedimientos experimentales significativos para la reducción del CO2 ambiental, se puede establecer que todos éstos, coinciden en la aplicación de reacciones catalizadas, donde la estabilidad termodinámica para las reacciones de este gas (conversión de reactivos a productos) se mantiene inalterada, pero por la presencia del catalizador se modifica el mecanismo de reacción, disminuyendo así la demanda energética para la formación de compuestos intermedios de vida media muy corta que rápidamente se descomponen dando finalmente los productos requeridos de acuerdo con la extensión de la reacción y el equilibrio químico.
Todas las reacciones consideradas y dependiendo del catalizador proporcionan principalmente: gas de síntesis, alcoholes e hidrocarburos. Mezcla de compuestos donde la proporción de un producto específico es variable. Por lo tanto, estas mezclas podrían ser utilizadas como combustibles de recirculación, generando un proceso de combustión (quema del combustible y producción de CO2) y posterior nueva conversión del gas a combustible, retirando continuamente una cantidad significativa de este gas del ambiente (oscilación del gas en forma similar a los procesos de fotosíntesis, respiración y descomposición natural).
En cuanto a los montajes experimentales de reacción, el conocimiento adquirido, después de un largo tiempo de experimentación muestra que se pueden usar procesos electroquímicos menos exigentes en demandas energéticas por aprovechar fenómenos de superficie y catálisis heterogénea sobre electrodos normales, y nano estructurados. Como también procesos de catálisis heterogénea y homogénea en montajes experimentales muy exigentes, limitados por la síntesis de precursores, uso de analizadores y altos costos de conversión.
Si bien, los resultados aún son diversos y solo a escala laboratorio (tecnologías en desarrollo), reflejan las investigaciones de la fisicoquímica experimental por resolver esta problemática ambiental lo antes posible.
BIBLIOGRAFÍA
[1] Kiely, G., 1999, Ingeniería ambiental, capítulo 8 Contaminación atmosférica, CO2 y vapor de agua, p: 487, Ed. Mc Graw – Hill, México,
[2] Grudner, C. E., 2010, Nucleones, isótopos y plasmas en la sustitución tecnológica de fuentes calefactoras para fluidos intermedios.., Revista Tecnológica ISSN: 1729 – 7532, Vol. 8 Nº 14, Facultad de Tecnología – UMSA, pp: 35, 37, La Paz – Bolivia,
[3] Encarta 2009, Cambio climático, DVD, Microsoft Corporation, USA,
[4] www.lenntech.es/.../historia-calentamiento-global.htm (Consulta 15/11/10),
[5] Ciência Hoje http://cienciahoje.uol.com.br, Seção Memória publicada na CH 238 (junho/2007) Vol. 40, Nº 238, Costa, F., Primórdios do aquecimento global, pp: 76, 77, (Consulta 15/11/10),
[6] www.promas.cl/cglobal.html, (Consulta: 12/11/10),
[7] http://www.esa.int/ y http://www-iup.physik.uni-bremen.de/deu//Satellite/SCIAMACHY.html, (Consulta 15/11/10),
[8] Estrucplan On Line, Boletín 1050, Alerta global por un récord de gases de efecto invernadero, boletines@estrucplan.com.ar,
[9] López, G. AB, 2013, Absorción de dióxido de carbono, a elevadas presiones parciales, por disoluciones acuosas de mezclas binarias de alcanolaminas, Tesis Doctoral, Universidad de Jaén, ISBN 9788484398424, Jaén – España,
[10] Gonzáles-Bonorino, F., 1972, Introducción a la Geoquímica, Capítulo 14 geoquímica de la atmósfera, Programa regional de desarrollo científico y tecnológico, OEA, Washington – USA,
[11] es.wikipedia.org/wiki/Protocolo_de_Kioto_sobre_el_cambio_climático (Consulta 15/11/10),
[12] Sánchez, S. CM., 2004, Distintos usos del dióxido de carbono en síntesis electroquímica, tesis doctoral Universidad de Alicante – España, on line
www.cervantesvirtual.com/.../distintos-usos-del-dioxido-de-carbono-en- sintesis-electroquimica--0/,
[13] Comunicación conicet, Pasquale, M.A., Elissalde, M., Rodríguez Nieto, F.J., 2007, www.conicet.gov.ar/new_scp/detalle.php?...id... Diseño y preparación de electrodos de difusión de gas aplicados a la reducción electroquímica del dióxido de carbono,/es:, Tandil, Buenos Aires – Argentina,
[14] Imai, J., Souma, M., Ozeki, S., Suzuki, T., Kaneko, K., J. Phys. , Reaction of dimerized NOx (x = 1 or 2) with sulfur dioxide in a restricted slit-shaped micropore space Chem., 1991, 95 (24), pp: 9955,9960, Publication Date: November 91 (Article) DOI: 10.1021/j100177a064, ,ISSN 1089 – 5639, USA,
[15] Yamamoto, T., Tryk, D.A., Fujushima, A., Ohata, H., Electrochemical Acta 47, 2002, Production of syngas plus oxygen from CO2 in a gas-diffusion electrode-based electrolytic cellOriginal, Research Article, pp: 3327-3334, ISSN 0013-4686 - Elsevier, USA,
[16] Shan Gao, Xingchen Jiao, Zhong Sun, Wenhua Zhang, et al, 2016, Ultrathin Co3O4 layers realizing optimized CO2 eletroreduction to formate, Angewandt Chemie International Edition, Vol. 55, Issue 2, pp: 698,702, January 11, 2016-11-18, ISSN1521-3773 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim – Alemania,
[17] Martínez, Y., Hernández, R., Salazar, E., Pérez, B., Márquez, O., Márquez, J., 2005, Reducción de CO2 sobre electrodo de platino modificado con una película conductora, Revista Ciencia, Vol. 13 Nº 3 08/05, ISSN 1315 – 2076, Maracaibo – Venezuela,
[18] Hamad-Schifferli, K., Zhichuan Xu, 2012, Compositional dependence of the stability of AuCu alloy nanoparticles, Electronic Supplementary Material (ESI) for Chemical CommunicationsThis journal is © The Royal Society of Chemistry, http://www.rsc.org/suppdata/cc/c2/c2cc31576a/c2cc, USA,
[19] Comisión Europea : CORDIS, 2013, VI Programa Marco de la Comisión Europea (VIPM), Una forma de transformar el dióxido de carbono (CO2) residual en combustible útil, proyecto específico de investigación focalizado (STREP), ELCAT, cordis.europa.eu/news/rcn/26343_es.html, Consulta: 25/06/16, EU,
[20] Yang Song, Rondinone, J. A., et – al, 2016, High-Selectivity Electrochemical Conversion of CO2 to ethanol using Copper Nanoparticle/N-Doped GrapheneElectrode,ChemistrySelect full papers 1,1 – 8, Published by Wiley-VCH Verlag GmbH & Co. KGaA,Supporting information for this article is available on the WWW under http://dx.doi.org/10.1002/slct.201601169, Deutschland,
[21] Bansode, A., Urakawa, A., 2014, Towards full one-pass conversion of carbon dioxide to methanol and methanol-derived products, Elsevier Journal Catalitic, ISSN 0021-9517 Volume 309, January 2014, 66,70, Available online at www.sciencedirect.com,
[22] Teledyne Isco, 2015, Catalytic CO2 conversion and in situ spectroscopy at high presure, Syringe pump application Note AN44, USA, IscoInfo@teledyne.com, USA,
[23] Courtemanche,M.A., Légaré, M.A., Laurent Maron, L., Fontaine, F.G., 2014, A highly active phosphine-borane organocatalyst for the reduction of CO2 to methanol using hydroboranes, Journal of the American Chemical Society,136 (30), pp: 10708, 10717, pub. Web 06/2014, DOI: 10.1021/ja404585p, USA,
[24] Kothandaraman, J., Goeppert, A., Czaun, M., Olah GA., Prakash, G. K. S., 2016, Conversion of CO2 from air into methanol using a polyamine and a homogeneous ruthenium catalyst, Journal of the American Chemical Society., 2016, 138 (3), pp: 778, 781, Supporting information, USA.
(*), Químico Industrial, Editor Revista Tecnológica, Facultad de Tecnología – UMSA.
NOTAS
[1] CloroFluorCarbonos. retienen una cantidad de calor superior a la que absorbe el CO2. y permanecen mayor tiempo en la atmósfera.
[2] Arrhenius, afirmaba que el equilibrio radiactivo de la Tierra dependía de la capa protectora de CO2, y de su control sobre la temperatura de la superficie terrestre para que ésta sea más cálida. Temperatura que ha tenido un efecto trascendental (efecto invernadero natural) en el desarrollo de la vida misma, evitando así, que los bancos de agua terrestres estén en estado sólido (hielo). [2]
[3] El calentamiento global causado por el efecto invernadero, expresa la elevación de la temperatura promedio de la atmósfera, los bancos de agua y masas terrestres. Sin embargo, no todos los lugares del mundo son afectados por el calentamiento con la misma intensidad, también se presentan lugares que se están enfriando notablemente. Por esta razón, el calentamiento global se relaciona con el término cambio climático No obstante, si se analizan en conjunto todas las mediciones locales, el planeta está calentándose de forma notable y hay muchas más zonas con calentamiento que con enfriamiento [3].
[4] Las transiciones entre los niveles de energía que favorecen la vibración corresponden a longitudes de onda que cubren la zona infrarroja del espectro, mientras que las transiciones entre los niveles de energía rotatorios corresponden a la zona de las microondas.
[5] Conjunto de especies de plantas, animales y otros organismos que ocupan un área determinada.
[6]Ciência Hoje http://cienciahoje.uol.com.br, Seção Memória publicada na CH 238 (junho/2007) Vol. 40, Nº 238, Costa, F., Primórdios do aquecimento global, pp: 76, 77, (Consulta 15/11/10)
[7] El carácter benévolo y primigenio del CO2 para la estabilización de la temperatura media del planeta, ha establecido que este gas no sea considerado como un contaminante agresivo de la troposfera (primera capa límite de la atmósfera) tan solo la calienta, mas donde actúa de manera negativa es en la estratosfera, enfriando en especial una zona exclusiva (capa de ozono) y donde esta disminución de temperatura favorece la reacción fotolítica entre el CO2 y el O3, produciendo monóxido de carbono y oxígeno. Provocando la consecuente disminución de la capa de ozono. [2]
[8] Aparato que produce separación de partículas o radiaciones siguiendo una determinada característica de: masa, carga, longitud de onda, etc., y mide su proporción.
[9] Según el Boletín que emite la Organización Meteorológica Mundial MMO - 2016. [8]
[10] La Fundación X Prize promete 20 millones de dólares al equipo de investigación que hasta el 2020 pueda convertir en algún producto útil el CO2 capturado de plantas eléctricas a carbón o gas. Centros que también están investigando intensamente son: la Universidad de Illinois – Chicago, el Centro Conjunto de Fotosíntesis Artificial Institute of Technology of San Francisco – California, entre otros más. [9]
[11] Medida de las cantidades según las cuales los elementos químicos se combinan a partir de la representación de símbolos y fórmulas en las ecuaciones químicas.
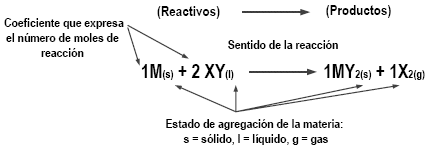
[12] Significado de una ecuación química:
[13] Cambios en la velocidad de una reacción química, provocada por una sustancia adicional, catalizador, que interviene por lo general disminuyendo el tiempo para que la reacción alcance el equilibrio, pero que no es parte de los productos de ésta. Jöns Jakob Berzelius (1779 - 1848) introdujo en química el término catalizador y conceptualizó sus principios con el término catálisis.
[14] Fotosíntesis y respiración (incremento de las zonas de vegetación), disolución acuosa y sedimentación, En el fondo de los océanos.
[15] Flujo material que se mueve desde una zona de mayor concentración a otra de menor concentración. la velocidad de difusión es proporcional al área de la sección transversal y al gradiente de concentración, temperatura o carga (cuando el gradiente es pequeño). También es proporcional a la difusividad o coeficiente de difusión. Por otra parte la cantidad de materia que se difunde en un tiempo determinado, o la distancia que recorre, es proporcional a la raíz cuadrada del tiempo y a la velocidad media de las moléculas.
[16] Equipo investigador: Yang Song, Rui Peng, Dale K. Hensley, Peter V. Bonnesen, Liangbo Liang, Zili Wu, Harry M. Meyer, Miaofang Chi, Cheng Ma, Bobby G. Sumpter, y Adam J. Rondinone.
[17] Grafeno: sustancia formada por carbono puro similar al grafito, con átomos que siguen un patrón regular hexagonal y laminar con un nano espesor de un átomo de carbono.
[18] El cobre Cu, es el catalizador metálico más conocido para la reducción electroquímica del CO2, produciendo más de 30 productos diferentes.
[19] En estado líquido la densidad de CO2 es muy sensible a las variaciones de temperatura. Por esta razón la bomba tiene una camisa externa alrededor de la jeringa para mantener la temperatura de los fluidos estable. En este caso 20 ºC, utilizando agua como refrigerante. A diferencia de las bombas de movimiento alternativo, el caudal suministrado por la bomba jeringa pulsa menos, garantizando la reproducibilidad de los resultados de la reacción. [22]
[20] Utilizando el controlador de LabVIEW de la bomba, es posible controlar ésta de forma remota y automatizada en un período de tiempo prolongado de semanas. Esta función de control remoto permite monitorear la seguridad en términos de apertura y cierre del sistema en el caso rebasamiento de la temperatura y/o el aumento de presión repentina, también en el software frente a un cambio anormal en los parámetros de la reacción, por ejemplo, rebasamiento de la temperatura y el aumento de presión repentina. [22]
[21] Gas Hourly Space Velocity (GHSV = Reactant Gas Flow Rate/Reactor Volume), Velocidad espacial horaria del gas (GHSV = Caudal de gas del reactivo / Volumen del reactor). Relaciona el caudal de gas reactivo con el volumen del reactor. El GHSV generalmente se mide a temperatura y presión estándar. Por ejemplo, un reactor con una velocidad espacial de 182000 h-1 es capaz de procesar alimentación equivalente a 182000 veces el volumen del reactor cada hora.