Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
Acta Nova
versión impresa ISSN 1683-0789
RevActaNova. v.8 n.1 Cochabamba mar. 2017
ARTÍCULO CIENTÍFICO
Floración algal nociva (FAN) producida por cianobacterias en la laguna Alalay, Cochabamba, Bolivia
Harmful algal bloom (HAB) produced by cyanobacteria in Alalay Shallow Lake, Cochabamba, Bolivia
Eduardo A. Morales, Sinziana F. Rivera, Luis H. Vildozo & Anelisse Pol
Herbario Criptogámico, Universidad Católica Boliviana San Pablo, Calle M. Márquez esq. Plaza Jorge Trigo s/n, P.O. Box 5381, Cochabamba, Bolivia
e-mail: edu_mora123@outlook.com
Recibido: 5 de noviembre 2016
Aceptado: 4 de enero 2017
Resumen: Se presentan datos recabados entre los meses de junio a agosto, 2016 de la floración algal nociva (FAN) ocurrida en la laguna Alalay (Cochabamba, Bolivia), que en marzo del mismo año causó la muerte masiva de peces y aves. Esta FAN estuvo dominada continuamente por Arthrospira fusiformis, Anabaenopsis milleri y Aphanocapsa sp., tres cianobacterias que se reportan en la literatura como altamente tóxicas y cuyas adaptaciones morfológicas, autecología, uso efectivo de nutrientes, espacio y luz, y las consecuencias de su actividad fisiológica en el ecosistema determinaron su prevalencia en la laguna. Los resultados físicos y químicos denotan el estado hipereutrófico de la laguna y un cambio en la limitación de la productividad en el ecosistema del nitrógeno hacia el fósforo. La incorporación de nitrógeno atmosférico y el reciclaje de nutrientes en la columna de agua y sedimentos así como la reutilización de la materia orgánica producida por las algas han resultado en una densidad algal pocas veces reportada en la literatura. Los análisis multivariados muestran que aunque solo poco más del 77% de la varianza en la abundancia algal es explicada por los parámetros físicos y químicos medidos durante el estudio, nitratos, fósforo total, carbonates, sulfatos y conductividad son las variables que determinan en mayor grado los patrones de variación espacio-temporal observados en los tres puntos de muestreo estudiados. Estas variaciones confirman resultados anteriores obtenidos con variables ambientales y comunidades de diatomeas que muestran que la laguna está afectada de manera distinta en los tres puntos de estudio por las actividades antrópicas en la cuenca. La identidad confirmada de Arthrospira fusiformis y Anabaenopsis milleri, su alta abundancia durante marzo y meses subsecuentes, las características del deceso masivo de animales y los datos físicos y químicos históricos, sugieren que ese deceso fue producido por cianotoxinas y no así por descensos en el tenor de oxígeno disuelto o la presencia de sulfuro de hidrógeno en la columna de agua. Los resultados aquí reportados tienen implicaciones para el desarrollo de protocolos de recuperación y manejo de la laguna, aspecto que se discute en el contexto de los datos recabados y de la literatura.
Palabras clave: algas nocivas, algas verdeazules, Cyanophyta, cianotoxinas, floraciones algales, lagos someros, lagos urbanos
Abstract: We present data collected during June to August, 2016 for the harmful algal bloom (HAB) developing in Alalay shallow lake, Cochabamba Bolivia; bloom that caused the massive kill of fish and birds early in March of the same year. The bloom was continuously dominated by Arthrospira fusiformis, Anabaenopsis milleri and Aphanocapsa sp., three cyanobacteria reportedly highly toxic and which morphological and autecological adaptations, effective use of nutrients, space and light, and the ecological consequences of their physiological activities determined their prevalence in the lake. Atmospheric nitrogen fixation and the recycling of nutrients from the water column and sediments, as well as the reuse of organic matter produced by photosynthetic organisms resulted in algal densities that are seldom reported in the literature. Water chemistry shows that the lake is hypereutrophic and that it has shifted from a nitrogen to a phosphorus limitation. Multivariate analyses showed that although only about 77% of the algal abundance variance is explained by measured water chemistry variables, nitrates, total phosphorus, carbonates, sulfatos, and conductivity are the parameters explaining observed variation in algal abundance in the three selected sampling sites. Such variations confirm previous results obtained by analysis of environmental variables and diatom assemblages, showing that the three sampling points are affected differently by anthropic activities in the drainage basin. The confirmed identity of Arthrospira fusiformis and Anabaenopsis milleri, their high abundance during March and subsequent months, the features of the fish and bird kills, and the historical water chemistry data suggest that the kills were produced by cyanotoxins and not by low dissolved oxygen and presence of hydrogen sulfide, as reported in the local and national press. The results shown here have implications for the development of recuperation and management protocols, aspects that are discussed in the context of our data and reports in the literature.
Keywords: Algal blooms, bluegreen algae, Cyanophyta, cyanotoxins, harmful algae, shallow lakes, urban lakes
1. Introducción
Las cianobacterias han poblado la tierra por mucho más tiempo que los homíninos (2,7 billones de años frente a 8 millones de años) y han desarrollado adaptaciones a un espectro amplio de condiciones ambientales salinas, salobres y de agua dulce. Desde los albores de la era industrial (siglo XIX), las actividades de Homo sapiens subsp. sapiens Mayr, la especie-subespecie más joven dentro de los homíninos, han alterado las condiciones de distintos ecosistemas alrededor del mundo, derivando en un creciente número de hábitats acuáticos eutrofizados y contaminados, a los cuales las cianobacterias también se han adaptado de manera muy rápida y efectiva. Muchas de las aproximadamente 2.700 especies conocidas [48] producen floraciones (blooms) y se estima que hasta un 75% de estas floraciones son tóxicas debido a la producción de metabolitos intracelulares denominados cianotoxinas [15] [25].
Las floraciones algales nocivas (FANs) producidas por cianobacterias en Sudamérica son cada vez más frecuentes y son de interés público debido a efectos sobre la salud de la población en contacto inmediato o indirecto con los ecosistemas afectados [28]. Aparentemente, según la Organización Mundial de la Salud (OMS), los únicos países para los que no se reportaron floraciones tóxicas son Bolivia y la Guyana Francesa [68]. Sin embargo, tomando en cuenta el grado de alteración general de ecosistemas, especialmente urbanos, con problemas de eutroñzación y contaminación, no resulta extraño que la falta de reportes se deba más bien a una carencia de estudios y a las magras políticas de salud pública que a la ausencia de floraciones de cianobacterias nocivas en esos países.
Las cianotoxinas se han clasificado, por su estructura química, en péptidos cíclicos, alcaloides y lipopoliscáridos, mientras que por el efecto tóxico que tienen, se las ha dividido en hepatotoxinas (generalmente afectan el hígado), neurotoxinas (con efectos sobre el sistema nervioso), dermo/citotoxinas (producen lesiones en la piel) y endotoxinas (producen una serie de respuestas del sistema inmunológico)[20][23][26][49][62][67]. En los últimos años, se ha identificado otro tipo de metabolitos tóxicos en distintas especies de cianobacterias. Este es un campo activo de investigación que en un tiempo corto ha producido un gran volumen de conocimiento y varios nuevos descubrimientos [40].
Las hepatotoxinas son péptidos cíclicos que actúan a nivel de citoesqueleto, abriendo espacios en el tejido hepático que son llenados con sangre, causando un shock hipovolémico en otros órganos, como ríñones, bazo, intestino y pulmones. Estas toxinas también atacan a tejidos reproductores, y causan disfunciones cognitivas. Además, son promotoras de tumores en hígado y ríñones [40] [60].
Las neurotoxinas son alcaloides que tienen una estructura molecular muy parecida a la del neurotransmisor acetilcolina, un mediador de la actividad sináptica (conexión entre neuronas) producido después de la recepción de un estímulo. Las neurotoxinas se ligan químicamente a la acetilcolina y no permiten que la respuesta nerviosa se interrumpa, de manera que el sistema nervioso se agota y paraliza al poco tiempo [40]. Otras neurotoxinas bloquean los canales proteicos de sodio a nivel de membrana celular, causando, entre otros, problemas cognitivos y de locomoción [14].
Las dermo/citotoxinas son alcaloides, agentes inflamatorios y activadores de la proteína quinasa C. Esta proteína controla una serie de procesos de excitación, secreción, reabsorción y vaso/bronco constricción en los sistemas nervioso, muscular, digestivo, urinario, reproductivo e integumentario. Por tanto, los alcaloides causan disrupciones en todos estos sistemas [14].
Las endotoxinas son lipopolisacáridos, componentes de la pared celular de las cianobacterias y que producen respuestas tóxicas, especialmente en mamíferos. Los síntomas son vómitos, diarrea, hipotensión y fiebre debido a la inflamación e irritación de tejidos que producen estas toxinas [16] [30] [34] [40].
Las consecuencias ecológicas de las FANs son variables y dependen de la magnitud de la floración y de su persistencia y la de las toxinas en el ecosistema afectado [17]. Los efectos más visibles se manifiestan a través de muertes masivas de peces y aves, principalmente, lo cual significa una disrupción de la cadena trófica y del flujo energético en el ecosistema. La sobreproducción de biomasa algal se constituye en una fuente de nutrientes que dan continuidad a las condiciones que favorecen la persistencia de una floración y modifican el hábitat, ocasionando la desaparición de especies sensibles [27] [33]. También se produce una acumulación de cantidades importantes de cianotoxinas en los consumidores primarios, que luego pueden transferir las toxinas a niveles superiores de la red trófica [18] [22] [29] [72]. También, la acumulación de toxinas en los sedimentos podría tener consecuencias a largo plazo a través de un efecto continuo sobre la biota [58]. Algunas formas de microcistina permanecen estructuralmente intactas en sedimentos lacustres de más de 200 años de edad y se ha probado la difusión de microcistinas del sedimento a la fase acuosa [54] [70] [70] [71].
El efecto de las FANs es agravado por la difusión de cianotoxinas, especialmente microcistina, a la atmósfera [8] [24] y por su transporte aéreo hacia zonas circundantes, originando una serie de síntomas en los humanos que viven o realizan actividades (incluso recreacionales) en dichas zonas [7]. Si bien la cianotoxinas inhaladas se pueden hallar en concentraciones mínimas en sangre y secreciones humanas, y tales concentraciones no se consideran patológicas, la exposición por periodos largos y el carácter promotor de procesos tumorales cancerosos de las cianotoxinas generan riesgos que ameritan consideración y mayor estudio [8].
El 10 de marzo, 2016 la prensa boliviana reportó la muerte de miles de platinchos (Oligosarchus schindleri Menezes & Géry) y pejerreyes (Odontesthes bonariensis Valenciennes) en la laguna Alalay, la laguna urbana más grande del país. En días subsecuentes se reportó la muerte de carpas (Cyprinus carpio Linnaeus) y aves de varias especies. Ocho semanas después, las aves continuaban muriendo y las aguas de la laguna seguían verdes a nivel superficial y la floración algal se extendía por todo el espejo de agua. El aspecto verde-azulado intenso, lechoso, a manera de manchas aceitosas, era más evidente en las costas donde el material algal se acumulaba por la incidencia del viento y los movimientos del agua. En aguas abiertas, la floración se evidenciaba a través de flóculos, como hojuelas, que flotaban en la superficie. La falta de acciones concretas por parte de las autoridades locales favoreció la persistencia de la floración que aún continua hacia finales del 2016.
Reportamos aquí la dinámica de la FAN en Alalay a tres meses de su comienzo hasta agosto de 2016. Se presentan estudios morfológicos y ecológicos de las algas así como la evidencia indirecta de la presencia de cianotoxinas en la laguna y se discuten sus posibles consecuencias para la salud de la población cochabambina.
Estos datos son importantes como inicio de estudio de la FAN que a principios del 2017 todavía prevalecía en Alalay.
2. Materiales y Métodos
2.1 Área de estudio y condiciones pre-FAN
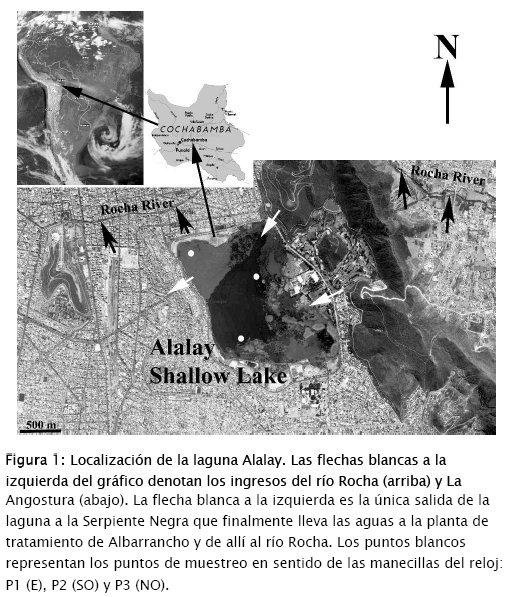
La laguna Alalay es un ecosistema natural, urbano, localizado en la ciudad de Cochabamba, Bolivia (17°23'43" S, 66°09'35" O) (Fig. 1). Con un área de 230 ha y una profundidad entre 0.5 a 3 m, es la laguna somera más grande de los Valles Secos Interandinos en Bolivia. La laguna fue profundizada en 1930 y conectada con el río Rocha mediante un canal, con la finalidad de minimizar las inundaciones producidas por este río, el principal sistema lótico que cruza la ciudad. Alalay está también conectada con la represa de La Angostura (embalse localizado al sur de la laguna), mediante un canal que desemboca en la parte este de la laguna, aunque el ingreso de sus aguas ha sido restringido debido a la alta carga de sedimentos. Una única salida que se mezcla con agua de alcantarillado, exporta agua en exceso fuera de la laguna nuevamente hacia el río Rocha.
El acelerado crecimiento urbano alrededor de la laguna ha cambiado dramáticamente el uso de la tierra en la microcuenca. En la actualidad, la laguna está completamente rodeada por la ciudad, con tan solo una franja estrecha de vegetación terrestre como perímetro, aunque incompleto en muchas zonas. En la misma laguna existen crecimientos extensos de las macrófitas emergentes Schoenoplectus californicus subsp. tatora (Kunth) T. Koyama y Typha dominguensis Pers. Desde el 2013 hasta fines del 2015, la macrófita sumergida Potamogeton pectinatus L., con crecimientos profusos de la epífita Rhizoclonium sp. dominaban el espejo de agua. Sobre Rhizoclonium sp. crecía, a su vez, una comunidad epífita conformada por diatomeas y algas verdes [45]. Dependiendo de la época del año y de las condiciones climáticas imperantes, han existido otras macrófitas sumergidas y flotantes, más notablemente floraciones de Azolla filiculoides Lam. y Vistia stratiotes L. [4] [5] [13] [45]. Se han observado en la laguna blooms aislados de euglenoides y de la cianobacteria Microcystis aeruginosa Kütz. aunque no se tienen registros sistemáticos de su ocurrencia [46].
Aún en condiciones altamente eutróficas, la laguna hospeda una comunidad diversa de zooplanctontes, insectos, anfibios, reptiles y aves aunque no existe un catálogo florístico y faunístico integral. La laguna también está contaminada como resultado de varias actividades antrópicas, tales como descargas de aguas servidas, escorrentía cargada de basura doméstica y efluentes clandestinos de fábricas de plástico y ropa. En época de lluvia, aproximadamente de noviembre a mayo, el río Rocha también acarrea desechos agrícolas, industriales y domésticos. Estudios del sedimento de la laguna muestran que existen contenidos altos de metales pesados, como zinc, hierro, cobre, cromo y mercurio, pero los efectos en la biota no han sido estudiados [53].
Los primeros estudios en la laguna Alalay comenzaron en 1979 y desde entonces se han llevado a cabo varios estudios sobre la limnología y biología del cuerpo de agua pero ninguno de ellos ha derivado en un programa continuo y efectivo de recuperación y manejo [2] [6] [9] [11] [12] [19] [21] [36] [37] [38] [39] [41] [42] [44] [55] [56] [61] [63].
2.2 Colecta de muestras, determinaciones físicas y químicas
Se muestrearon 3 zonas de la laguna (P1, P2 y P3, localizadas al E, SO y NO), todas severamente afectadas por la floración (Figs 1 y 2), en 5 fechas diferentes: 8 y 22 de junio, 6 de julio y 1o y 22 de agosto de 2016 (muestreos designados como M1-M5). Las muestras biológicas se colectaron directamente a unos 5 a 10 cm por debajo de la superficie del agua, utilizando una pipeta grande de boca ancha, llenando frascos de 250 mL, los cuales fueron transportados al laboratorio para su fijación con aproximadamente 5 mL de solución Lugol y su posterior análisis. No se pudo utilizar la red de plancton para la colecta debido a que la biomasa algal rápidamente obstruía la red. Para las determinaciones químicas se hizo un prefiltrado de las muestras colectadas de agua, utilizando un embudo y varias capas de gasa que, a pesar de su porosidad, quedaba rápidamente obstruida. La finalidad de esta filtración fue la de determinar en lo posible los parámetros químicos del agua libre de la biomasa.

Los valores de temperatura (T), pH, conductividad (Cond. en mS cm-1) y oxígeno disuelto (OD en mg L-1), fueron medidos in situ al momento de la colecta de las muestras biológicas. Los análisis de nutrientes, amonio (mg N-NH4 L-1), carbonatos (mg L-1), nitratos (mg N-NO3 L-1), nitritos (mg N-NO2 L-1), fósforo soluble (Psol, mgP-PO4-3L-1), fósforo total (Ptot, mg P-PO4L-1) y sulfatos (mgSO4-2 L-1) fueron determinados en laboratorio a partir de muestras colectadas en frascos plásticos de 1 L y transportadas en conservadoras con hielo.
Adicionalmente, se colectaron muestras de plancton en los tres puntos anteriormente citados, con ayuda de una pipeta plástica grande y muestras de agua colectada en la costa, directamente hundiendo por debajo de la superficie un frasco de 250 mL. Ambos grupos de muestras se obtuvieron los días 16, 18 y 24 de marzo de 2016, después de la muerte masiva de peces y aves. Estas muestras se trasladaron inmediatamente al laboratorio para su observación en fresco.
Para el presente trabajo se utilizaron también los datos de concentración de cloruros determinados en 2013 a partir de muestras colectadas en 8 puntos diferentes de la laguna (dos por cada punto cardinal) de la misma forma que se obtuvieron las muestras actuales. Estas determinaciones se habían hecho a fin de determinar la salinidad de la laguna.
Las fotografías en campo se tomaron con una cámara Sony Cyber-shot HD AVCHD Progressive con un lente Sony Lens G de 20X de aproximación.
2.3 Identificación y contaje
Las muestras fueron analizadas no más de tres horas después de su colecta. Se examinaron preparaciones acuosas utilizando una gota de Lugol, para aumentar el contraste, utilizando aumentos de hasta 1250X en un microscopio Zeiss Universal equipado con óptica Nomarski y una cámara fotográfica digital JenoptikProgRes CF USB. Las imágenes fueron capturadas electrónicamente y las láminas se montaron utilizando Adobe Photoshop CS3, ver. 10.0.
Para la determinación del número de células por mL en las muestras de plancton se utilizó una cámara de Sedgewick Rafter; se contaron 10 campos al azar bajo un aumento de 200X, según metodología y recomendaciones de Wetzel & Likens [65].
2.4 Tratamiento estadístico
Los datos ambientales y de abundancias de especies se procesaron en EXCEL. Para el análisis de correspondencia canónica (CCA) se utilizó el programa CANOCO ver. 4.5. Las correlaciones, varianzas y valores eigen fueron extraídos de los archivos de solución de CANOCO. Los diagramas de cajas se produjeron utilizando el programa estadístico R ver. 3.2.
3. Resultados y Discusión
Los datos ambientales presentados en la Tabla 1 muestran que la laguna Alalay es un ecosistema hipereutrófico con valores muy superiores a aquellos presentados en la literatura [66]. Al haberse cortado el ingreso de las aguas del río Rocha (cargadas de contaminantes y nutrientes) ya desde el año 2015, planteamos que actualmente la mayor parte de los nutrientes en la laguna provienen de la escorrentía superficial y subsuperficial, así como de los sedimentos y reciclaje de la biomasa autóctona[43]. Esto tiene implicaciones directas sobre los protocolos de manejo y recuperación de la laguna que deben concentrarse en el manejo de sedimentos y gestión de la cuenca (basura, efluentes, alcantarillado, etc.). Las altas concentraciones de nutrientes posiblemente desencadenaron la FAN observada en la laguna. Las concentraciones de células están por encima de valores reportados en ambientes eutróficos y que muy pocas veces se presentan en la literatura (número de células por mL superior al millón, Tabla 2). El efecto de la evaporación del agua por las altas temperaturas persistentes desde finales del 2015 y de la sequía atípica del año 2016 (influenciada por el Niño), ha sido el de concentrar nutrientes (ver por ejemplo los valores de amonio, nitratos, fósforo total y carbonatos en la Tabla 1 hacia el final del estudio) y de aumentar aún más la biomasa algal, incrementando las tasas reproductivas (ver los elevados números de células hacia el final del estudio en la Tabla 2).

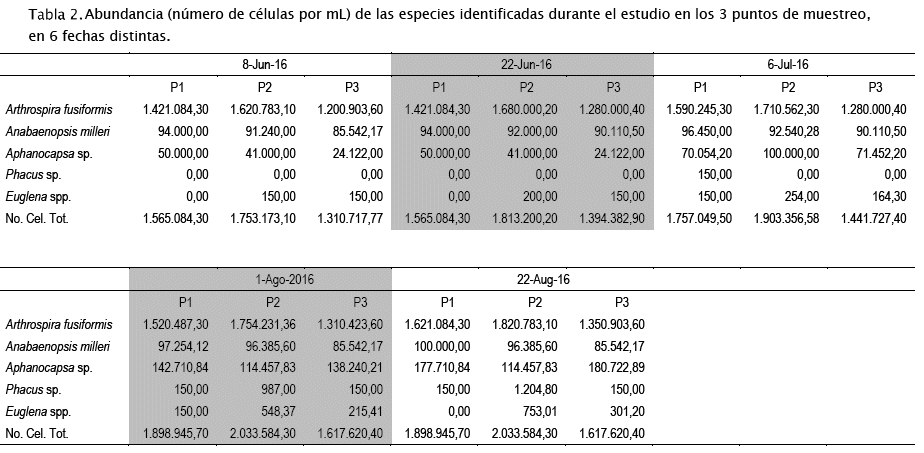
El bloom no ha cedido durante el periodo de estudio y ha estado permanentemente dominado por Arthrospira fusiformis (Voronikhin) Komárek & J.W.G. Lund (Tabla 2, Figs 3A-D). Esto se debe a la autecología del alga (alcalifila, halófila y eutraféntica) y a la efectividad con la que esta alga se reproduce por vía asexual ya sea por hormogonios (filamentos móviles, cortos) (Fig. 3D), o por acinetos (células de dormacia grandes) (Fig. 3F). También, el alga está asociada con Anabaenopsis milleri Voronikhin (Figs 3E y 3F), otra cianobacteria de autecología similar a la de A. fusiformis, la cual también se reproduce asexualmente y fija nitrógeno atmosférico mediante heterocitos terminales (Figs 3E y 3F). La actividad diazotrófica de esta segunda cianobacteria, junto a la de las bacterias acompañantes (Fig. 3E), parece haber cambiado el balance de nutrientes en la laguna. Esto debido a que ahora los nitratos y amonio son muy abundantes comparados con situaciones previas al bloom [44]. También, una especie no identificada de la cianobacteria Aphanocapsa Nägeli (Fig. 3C) ha ido incrementando su abundancia paulatinamente en los 3 puntos de muestreo (Tabla 2). La densidad de Phacus sp. y Euglena sp., dos organismos flagelados que generalmente prefieren ambientes con altas cargas de materia orgánica, ha sido menor.
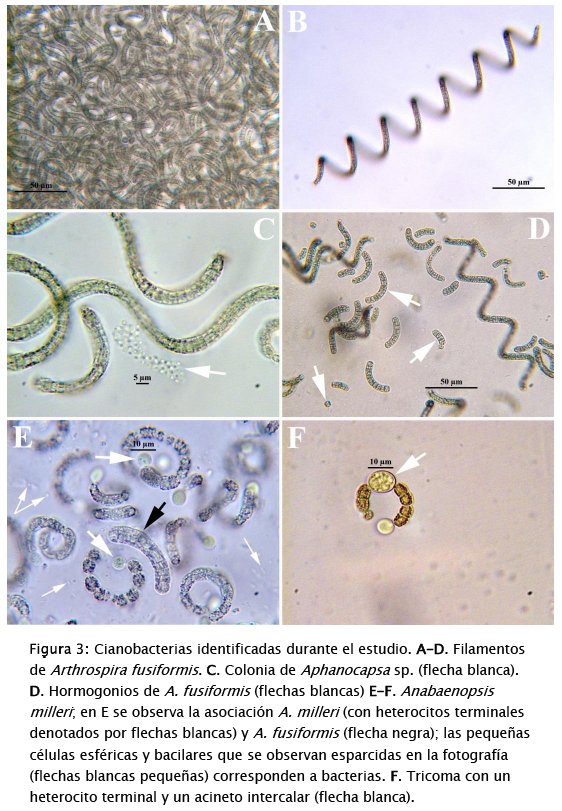
Adicionalmente, la dominancia de A.fusiformis y A. milleri se ve favorecida por la presencia en el citoplasma de aerotopos, vesículas gaseosas que les permiten mantenerse en la parte superior de la columna de agua, bloqueando la penetración de la luz y por ende, el desarrollo de cualquier otro tipo de alga en grandes cantidades [50] [64]. Aphanocapsa sp. no posee aerotopos pero debido a su pequeño tamaño puede mantenerse suspendida entre las colonias de las otras dos cianobacterias o apoyada sobre el mucilago que estas producen (Fig. 3C). Las algas eucariontes, generalmente, no resisten la alta intensidad de la radiación solar que llega a la parte superior de la columna de agua pero en las cianobacterias los tilacoides (estructuras alargadas que contienen a los pigmentos fotosintéticos, incluyendo carotenoides y estructuras proteicas complejas denominadas ficobilisomas) están dispuestos en varias capas por debajo de la membrana celular. Estas capas constituyen una especie de quitasol que protege los contenidos celulares, evitando la fotooxidación de la clorofila [57].
Las tres cianobacterias identificadas en Alalay son tóxicas. Arthrospira fusiformis secreta neurotoxinas (anatoxina-a y homoanatoxina-a) y hepatotoxinas (microcistinas); A. milleri y Aphanocapsa sp. producen hepatotoxinas (microcistinas)[17][40]. Las dos primeras especies han sido asociadas con muertes masivas de peces, aves [10] [35][47] y humanos [69]. La inexistencia de laboratorios especializados en Bolivia y la dificultad de enviar muestras líquidas o liofilizadas al exterior, nos impidieron constatar directamente la presencia de las cianotoxinas en agua y sedimentos. Ante la abundancia de las algas tóxicas, su toxicidad reportada en la literatura y las características de los órganos internos de peces y aves muertas (Dr. Vet. E. Alandia com. pers.), es lógico concluir que tal deceso fue principalmente producido por efecto de las cianotoxinas, más que por otras causas como el descenso de los niveles de oxígeno disuelto o la presencia de sulfuro de hidrógeno (ver discusión abajo).
Con respecto a la variación de los factores ambientales y su influencia en la distribución de especies (Fig. 4), el primer eje de correspondencia canónica está fuertemente relacionado (correlaciones ponderadas entre 0,6-0,95) con nitratos, fósforo total, carbonates, sulfatos y conductividad, en orden de importancia decreciente. El segundo eje, por otra parte, está débilmente relacionado (correlaciones ponderadas entre 0,250,46) con el fósforo soluble y el pH. Factores como oxígeno disuelto, amonio y temperatura tienen muy poca influencia en el patrón de distribución observado.
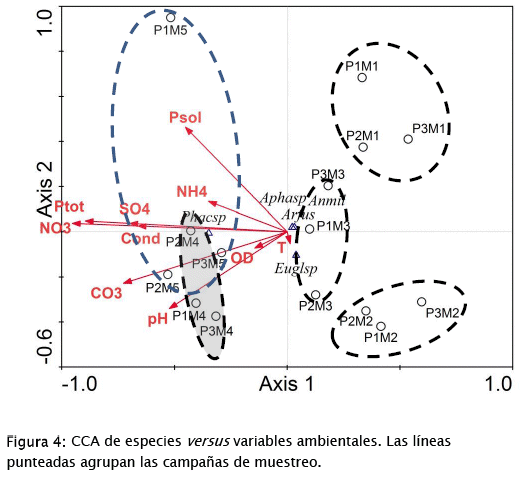
Solamente 77,3% de la varianza porcentual de las especies es acumulada por los dos primeros ejes (65,5% por el primer eje y para el tercer eje sigue siendo 77,3), significando que hay un residual de la distribución de los datos de especies que no es explicado por los factores ambientales medidos durante el estudio. También, los valores eigen son bajos para los dos primeros ejes canónicos (0,07 para el eje 1 y 0,012 para el eje 2), mostrando que ambos ejes no representan gradientes muy fuertes. Es posible que factores como radiación solar, espacio, N2 atmosférico, salinidad, entre otros, puedan contribuir a una mejor explicación del patrón de distribución de especies y muestras observado.
Los nitratos son una forma de nitrógeno altamente biodisponible y probablemente provienen de la descomposición de la materia orgánica, mediada por microorganismos. Los nitritos se hallaron por debajo de niveles de detección (y por ello no fueron incluidos en el análisis) probablemente debido a su rápida oxidación en un ambiente sobresaturado de oxígeno fotosintético. El amonio se halla en bajas cantidades en relación a los nitratos y estos últimos son absorbidos de manera preferencial por los organismos fotosintéticos; es posible también que las bacterias estén oxidando el amonio a nitritos, los que luego se oxidan a nitratos.
Las concentraciones de nitratos previas al bloom fueron bajas y se consideraba a la laguna como un ecosistema limitado por nitrógeno. Los ingresos de nitrógeno eran probablemente absorbidos rápidamente por la vegetación ribereña, dejando muy poco de este nutriente disponible en la zona pelágica [44] [46] [55]. El desarrollo inicial de A. fusiformis a finales del año 2015 (A.M. Romero, com. pers.) puede haberse debido, entonces, a la capacidad de las cianobacterias de secretar enzimas que degradan materia orgánica extracelularmente [52] [59] y a la presencia de bacterias no foto sintéticas que poseen la misma capacidad. Adicionalmente, ya en marzo 2016 observamos las primeras colonias de A. milleri en la parte este de la laguna que para abril ya se habían expandido a toda la laguna. A través de los heterocitos, este alga fija nitrógeno atmosférico. La diazotrofía es una fuente importante de nitrógeno que incorpora el nutriente al ecosistema [66] y propicia el desarrollo algal. Una vez en el ecosistema, el nitrógeno se recicla internamente, mientras cantidades extras del nutriente siguen ingresando al ecosistema por la continua fijación por parte de A. milleri.
El fósforo total representa todo el fósforo disponible en la columna de agua, incluyendo aquel que está contenido en las células; por tanto y dado el profuso desarrollo algal, no es sorprendente que sus concentraciones sean altas en la laguna. Es interesante notar que el fósforo soluble no haya tenido correlación con la abundancia de las especies y esto puede deberse a la rápida incorporación del fósforo biodisponible en la columna de agua por parte de la biomasa, dejando muy poco de este fósforo disuelto en el agua. Haciendo una relación de la concentración de nitratos y de amonio con la de fósforo soluble, descubrimos que durante el bloom algal, la laguna es un sistema limitado por fósforo y no por nitrógeno como era antes del bloom (Tabla 1).
Los carbonatos poseen concentraciones altas en la laguna y pueden proceder de varias fuentes, entre ellas el proceso fotosintético que, al remover el CO2, los precipita y también de la roca madre sedimentaria sobre la que se asienta la laguna y que es rica en carbonates. El carácter alcalino favorece la prevalencia del ión carbonato en la columna de agua y, al mismo tiempo, las sales carbonatadas funcionan como tampón previniendo los cambios del pH. De hecho, el pH ha variado poco y se ha mantenido alto durante el periodo de estudio (entre 8,310,1 en toda la laguna y con menor variación dentro de cada punto).
La concentración de sulfatos es muy alta en la laguna y esto se puede deber no solo al reciclaje interno y carga en los sedimentos sino también a los aportes desde las canchas de fútbol situadas en la zona este. La utilización de productos sulfatados (sulfato agrícola) como mecanismo de control del césped es muy común en estos campos deportivos como pudimos evidenciar visualmente. Las interacciones entre el mecanismo enzimático de las cianobacterias y el azufre son muy complejas, existiendo reservas internas y externas de este elemento para la construcción de proteínas constitutivas e integrantes de diversos procesos metabólicos [3].
Con las concentraciones altas de nutrientes registradas para las tres zonas de muestreo, no es sorprendente que la conductividad sea alta pero en el caso de Alalay, este parámetro también está señalando la presencia de otras sales, incluyendo cloruros, que se habían hallado en concentraciones altas en la laguna antes del bloom (300330 mg L-1 en 8 diferentes puntos), lo cual indica su carácter salobre. La presencia de sales en la laguna se hace evidente en las zonas costeras donde la disminución del agua deja depósitos blanquecinos sobre el sedimento seco.
Se observó que el oxígeno disuelto muestra variaciones amplias de una hora a la siguiente, debido a la actividad fotosintética. Este factor no tiene gran influencia sobre los organismos fotosintéticos en sí, los cuales pueden generar y acumular el oxígeno necesario para su propia respiración celular, liberando solo el excedente al medio circundante. Cuando ese excedente es agotado por otros organismos (como las cianobacterias), se produce un estado de anoxia, la cual afecta de manera adversa a invertebrados y vertebrados. Para los primeros, hemos observado que no existen zooplanctontes en zonas de aguas abiertas, donde la actividad bacteriana en general es mucho mayor, pero sí se han observado esporádicamente rotíferos en zonas costeras, donde el oleaje del agua favorece una mayor oxigenación. Obviamente, bajo estas condiciones la presión por herbivoría es muy baja en la laguna.
Se deduce entonces que la dominancia de las cianobacterias está dada por la efectiva y rápida incorporación del fósforo soluble a las células, lo que impide un mayor desarrollo de otros fitoplanctontes. Esta dominancia también es favorecida por las condiciones anóxicas creadas principalmente por la respiración algal nocturna que impide la sobrevivencia de consumidores/depredadores en aguas abiertas.
Con respecto a los vertebrados, cabe hacer notar que los decesos masivos de peces muy probablemente no fueron causados por bajas de oxígeno disuelto en el agua como se había hipotetizado inicialmente ante la prensa local y nacional (p.e. ANF/ABI [1], Hugarte [31], Jaramillo [32]). Esto porque también murieron aves y porque registros históricos del oxígeno disuelto [44] [55] mostraron descensos incluso mayores a los registrados alrededor del 10 de marzo de 2016 pero sin que se produjeran decesos masivos de la fauna acuática. Además, la identificación inicial de las dos cianobacterias tóxicas fue positiva y constatada por expertos internacionales ([43]). La presencia continua de las cianobacterias tóxicas ha sido sincrónica con el deceso continuo de aves y peces, como se constató durante todo el periodo de estudio. Es de esperar que las bajas concentraciones de oxígeno disuelto no estén uniformemente repartidas en la laguna y que esta posea muchos microhábitats, algunos de los cuales puedan actuar como refugios para peces (entre la vegetación emergente de Schoenoplectus y Typha, por ejemplo). Es decir, el comportamiento activo de los animales evita los sitios desprovistos de oxígeno e incluso es frecuente observar que los peces de Alalay (no se ha determinado si todas las especies hacen esto) salen a la superficie de la laguna y toman "bocanadas" de aire, lo cual podría ser también un comportamiento que contrarreste la asfixia.
Tampoco las muertes observadas en marzo de 2016 se debieron a supuestos altos niveles de sulfuro de hidrógeno (H2S) como había sido señalado por el Ministerio de Medio Ambiente y Agua [1]. Los niveles reportados no excedían los 0,19 mgL-1 cuando los niveles encontrados en aguas superficiales y subterráneas son de hasta 5 mg L-1 y las concentraciones riesgosas (no necesariamente letales) están por encima de los 10 mg L-1 [51] [66]. Además, bajo las condiciones de oxigenación de la laguna, a raíz de las altas tasas fotosintéticas diurnas, el sulfuro de hidrógeno que se hubiera podido producir durante el proceso de descomposición anóxica (por la noche) se oxidaría rápidamente para producir sulfatos [66] y esta podría ser una fuente adicional de las altas concentraciones de sulfatos halladas en la laguna.
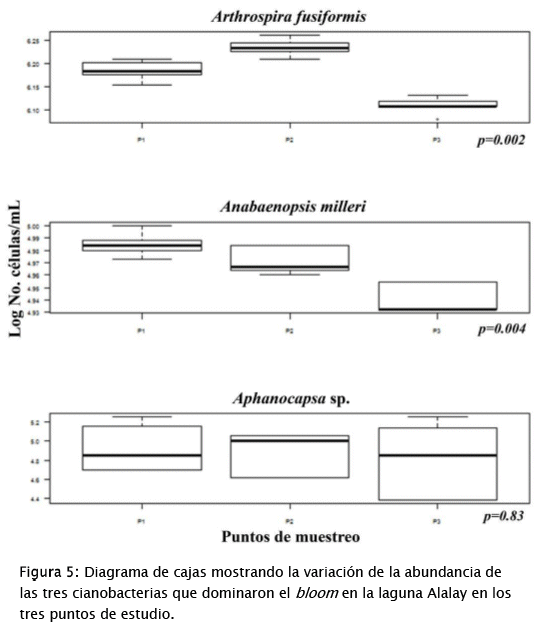
Los resultados del CCA y del diagrama de cajas presentado en la Fig. 5, muestran que la zonación de la contaminación/eutrofía de la laguna [44] continúa aún en la situación actual. En el gráfico resultante del CCA, los 3 puntos de cada campaña de muestreo aparecen asociados, pero mayormente separados entre campañas. El diagrama de cajas muestra que los 3 puntos se comportan de manera diferente y esto se expresa no solamente en los valores de las variables ambientales sino también en las abundancias de las especies halladas durante el estudio. De hecho, la Fig. 5 muestra que las tres especies dominantes del bloom se comportan de manera distinta en cada uno de los puntos de muestreo aunque solamente en el caso de A.fusiformis y A. milleri (que contribuyen más a la densidad total -Tabla 2) las diferencias son significativas. Esta carencia de uniformidad en las condiciones de la laguna tiene claras implicaciones para su manejo y recuperación, siendo necesaria la aplicación de protocolos de manejo diferenciados y enfocados a subsanar los problemas específicos de cada zona.
Por lo pronto, no es recomendable el uso de oxigenadores tipo spray y splash en la laguna ya que favorecen la atomización del agua y de las cianotoxinas y su expulsión hacia la atmósfera. Así mismo, debe abandonarse el uso de piscinas costeras (cuya finalidad no es clara) expuestas al aire libre, a través de las cuales las tasas de evaporación y la exposición de animales y personas a las toxinas son mayores, ya que existe una probada acumulación de microcistinas por inhalación. Los riesgos para la salud del personal municipal en las oficinas apostadas en la ribera y del personal que trabaja directamente en la laguna son obvios y es recomendable la utilización de ropa y zapatos adecuados así como de mascarillas. Finalmente, debido a que la laguna alimenta aguas subterráneas en la zona, es muy probable que el agua de pozo también contenga cianotoxinas y, por ello, se deben hacer análisis regulares a fin de establecer protocolos adecuados de manejo de aguas subterráneas de la zona y zonas aledañas.
Tampoco se recomienda un nuevo establecimiento de "humedales flotantes" como los que se hicieron en junio de 2016, especialmente si esto implica la introducción de plantas foráneas (como Eichhornia crassipes (Mart.) Solms) que podrían establecerse y causar problemas graves en la laguna. De hecho, ya se han visto pequeños retoños de esta planta que escaparon de los compartimentos construidos para contenerlas. Los humedales se secaron pronto por un shock osmótico, debido a que las Eichhornia provenientes de un ambiente de agua dulce (Coña-Coña) se trasladaron a un sistema salobre como lo es Alalay. El establecimiento de estos humedales también significó el ingreso de numerosos microorganismos no autóctonos a la laguna, cuyas consecuencias son inciertas.
Morales & Rivera [45] elaboraron una lista de las macrófitas de Alalay, las cuales representan los posibles sucesores autóctonos del bloom actual, una vez que este haya cedido. En función de esta información, ya es posible anticipar posibles problemas futuros y establecer los protocolos más adecuados para el manejo de la laguna.
4. Conclusiones
La laguna Alalay se hallaba en un estado hipereutrófico en el periodo de estudio y corresponde actualmente a un ecosistema limitado por fósforo. La densidad algal producida es muy alta y excede la mayoría de los reportes en la literatura. Esta densidad es producida principalmente por tres especies de cianobacterias pero está visiblemente dominada por A. fusiformis. El bloom fue persistente debido a la utilización de nutrientes que ingresan de la cuenca o se hallan en la columna de agua y sedimentos, pero también debido a la capacidad de flotación de las cianobacterias que forman una capa densa en la superficie y no permiten el ingreso de la luz a estratos inferiores de la columna del agua y a la supresión de los herbívoros zooplanctontes a través de la intoxicación por cianotoxinas, así como por el agotamiento del oxígeno disuelto por la respiración algal nocturna.
Las cianobacterias aquí reportadas se conocen como tóxicas en la literatura y, por tanto, las muertes masivas de peces y aves desde marzo de 2016 muy probablemente se deben a sus toxinas y no a la carencia de oxígeno ni tampoco a la presencia de sulfuro de hidrógeno en el agua.
Desde el cierre de ingresos del río Rocha y La Angostura en 2015, la sobrecarga de nutrientes en la laguna se debe a la producción autóctona, almacenamiento en sedimentos e ingresos por escorrentía superficial y subsuperficial desde la cuenca. En la laguna, como se había determinado en estudios anteriores, los factores ambientales y la contaminación no son uniformes y esto se debe a que las zonas este, noroeste y noreste están afectadas por actividades antrópicas diferentes.
El manejo de la laguna debe ser zonificado y se debe apuntar primero al manejo de la cuenca y luego a la columna de agua y los sedimentos. Los protocolos de manejo deben establecerse con base en estudios previos y datos reales y actuales de lo que sucede en la laguna. No se pueden utilizar más oxigenadores, piscinas costeras o introducir plantas foráneas de autecología diferente a las condiciones de la laguna, por ejemplo. El establecimiento de medidas de seguridad para el personal que trabaja en contacto con la laguna y para la población que puede estar siendo afectada son aspectos primordiales que deben tomarse en cuenta de manera urgente.
Agradecimientos
Agradecemos a Paul B. Hamilton, Canadian Museum of Nature por el soporte financiero para los análisis físico-químicos. A Ricardo Echenique, Universidad de La Plata, Argentina y Saúl Blanco, Universidad de León, España por su ayuda con la identificación de las cianobacterias. A Nora I. Maidana, Universidad de Buenos Aires por la corrección del texto y sugerencias de mejora de varias partes del mismo. A Eric Martínez, Comité para la Recuperación, Manejo y Protección de la laguna Alalay-CREMPLA, Gabriel López, Alcaldía Municipal de Cochabamba y Rodrigo Aguayo, Gobernación de Cochabamba por las discusiones e intercambio de información sobre la laguna durante y fuera del periodo de estudio.
Referencias
[1] ANF/ABI. 2016. Mueren patos en la Alalay y autoridades se culpan entre ellas. El Deber. Edición 16/03/2016. http://www.eldeber.com.bo/bolivia/mueren-patos-alalay-y-autoridades.html. Consultada 01/10/2016. [ Links ]
[2] Arias, S. 1998. Proyecto: Conservación de la Ornitofauna de la Laguna Alalay. CUEMAD-UMSS. 57 p. [ Links ]
[3] Ariño, X.; Ortega-Calvo, J.; Hernandez-Marine, M. & Saiz-Jimenez, C. 1995. Effect of sulfur starvation on the morphology and ultrastrucuture of the cyanobacterium Gloeothece sp. PCC 6909. Archives of Microbiology 163: 447–453.
[4] Arrazola, V. 2000, Estudio de comunidades vegetales acuáticas de seis lagunas de los pisos mesotropical, supratropical y orotropical de Cochabamba. Tesis de Licenciatura en Biología. Universidad Mayor de San Simón, Cochabamba. 106 p. [ Links ]
[5] Ayala, R., Castro, M., Bayro, Acosta & Rejas, D. 2006. Interacciones fitoplancton-zooplancton en una laguna eutrofizada del valle del Cochabamba (Bolivia). Ciencias y Tecnología. Facultad de Ciencias y Tecnología. Revista Facultativa 5: 43–50.
[6] Ayala, R.; Acosta, F. & Rejas, D. 2007. Management of Laguna Alalay: a case study of lake restoration in Andean valleys in Bolivia. Aquatic Ecology 41: 621–630.
[7] Backer, L.C.; Carmichel, W.; Kirkpatrick, B.; Williams, C.; Irvin, M.; Zhou, Y.; Johnson, T.B.; Nierenberg, K.; Hill, V.R.; Kieszak, S.M. & Cheng, Y.S. 2008. Recreational exposure to low concentrations of microcystins during an algal bloom in a small lake. Marine Drugs 6: 389–406.
[8] Backer, L.C.; McNeel, S.V.; Barber, T.; Kirkpatrick, B.; Williams, C.; Irvin, M.; Zhou, Y.; Johnson, T.B.; Nierenberg, K.; Aubel, M.; LePrell, R.; Chapman, A.; Foss, A.; Corum, S.; Hill, V.R.; Kieszak, S.M. & Cheng, Y.S.
2010. Recreational exposure to microcystins during algal blooms in two California lakes. Toxicon 55: 909–921.
[9] Balderrama, J.A.; Sahonero, R. & Arias, S. 1998. Charadriiformes de la laguna Alalay (Cochabamba, Bolivia). Revista Boliviana de Ecología y Conservación Ambiental 3: 73–78.
[10] Ballot, A.; Krienitz, L.; Kotut, K.; Wiegand, C.; Metcalf, J.S.; Codd, G.A. & Pflugmacher, S. 2004. Cyanobacteria and cyanobacterial toxins in three alkaline Rift Valley lakes of Kenya-Lakes Bogoria, Nakuru and Elmenteita. Journal of Plankton Research 26: 925–935.
[11] Barra, C.; del Castillo, M.; Maldonado, M. &Sahonero, R. 1983. Sinopsis limnólogica de la laguna Alalay (Cochabamba-Bolivia). Informe Técnico. Departamento de Biología, Universidad Mayor de San Simón. 41 p. [ Links ]
[12] Barra, C.; Cadima, M.; Maldonado, M.; Goitia, E. & Acosta, F. 1993. Diagnóstico limnológico de la laguna Alalay (Cochabamba-Bolivia). Publicaciones Facultad de Ciencias y Tecnología. Universidad Mayor de San Simón. Serie Científica 3: 73–78.
[13] Bayro, V. 2000. Interacción de la macrofitia y el fitoplancton en la laguna Alalay (Cochabamba-Bolivia). Tesis de Licenciatura en Biología. Universidad Mayor de San Simón, Cochabamba. 102 p. [ Links ]
[14] Bláha, L.; Babica, P. & Maršálek, B. 2009. Toxins produced in cyanobacterial water blooms – toxicity and risks. Interdesciplinary Toxicology 2(2) 36–41.
[15] Bláhová, L.; Babica, P.; Adamovský, O.; Kohoutek, J.; Maršálek, B. & Bláha, L. 2008. Analyses of cyanobacterial toxins (microcystins, cylindrospermopsin) in the reservoirs of the Czech Republic and evaluation of health risks. Environmental Chemistry Letters 6: 223–227.
[16] Bláhová, L.; Adamovský, O.; Kubala, L.; Šinderová, L.S.; Zounková, R. & Bláha, L. 2013. The isolation and characterization of lipopolysaccharides from Microcystis aeruginosa, a prominent toxic water bloom forming cyanobacteria. Toxicon 76: 187–196.
[17] Bonilla, S. (Ed.). 2009. Cianobacterias planctónicas del Uruguay. Manual para la identificación y medidas de gestión. Programa Hidrológico Internacional de la UNESCO para América Latina y el Caribe. Documento Técnico No. 16. UNESCO, Montevideo. 96 p.
[18] Briand, J-F.; Jacquet, S.; Bernard, C. & Humbert, J-F. 2003. Health hazards for terrestrial vertebrates from toxic cyanobacteria in surface water ecosystems. Veterinary research 34: 1-17. [ Links ]
[19] Cadima, M. 1998. Algas y macrófitas de la laguna Alalay (Cochabamba-Bolivia). Revista Boliviana de Ecología y Conservación Ambiental 3: 35–46.
[20] Carmichael, W.W. 2001. Health effects of toxin-producing cyanobacteria: “The CyanoHABs”. Human and Ecological Risk Assessment 7 (5), 1393–1407.
[21] Castellón, D. 2001. Estrategias de manipulación de la laguna Alalay (Cochabamba). Tesis de Maestría en Ciencias Ambientales. Universidad Mayor de San Simón, Cochabamba. 90 p. [ Links ]
[22] Chen, J. & Xie, P. 2008. Accumulation of hepatotoxic microcystins in freshwater mussels, aquatic insect larvae and oligochaetes in a large, shallow eutrophic lake (Lake Chaohu) of subtropical China. Fresenius Environmental Bulletin 17: 849–854.
[23] Chen, J.; Xie, P.; Li, L. & Xu, J. 2009. First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage. Toxicological Sciences 108(1): 81–89.
[24] Cheng, Y.S.; Zhou, Y.; Irvin, C.M.; Kirkpatrick, B & Backer, L.C. 2007. Characterization of aerosols containing microcystin. Marine Drugs 5: 136–150.
[25] Chorus, I.; Falconer, I.R.; Salas, H.J. & Bartram, J. 2000. Health risks caused by freshwater cyanobacteria in recreational waters. Journal of Toxicology and Environmental Health B. Critical Reviews 3(4): 323–347.
[26] Dawson, R.M. 1998. The toxicology of microcystins. Toxicon 36(7): 953–962.
[27] De Leon, L. & Yunes, J.S. 2001. First report of a microcystin-containing bloom of the cyanobacteriumMicrocystisaeruginosa in the La Plata River, South America. Environmental Toxicology 16(1): 110–112.
[28] Dorr, F.A.; Pinto, E.; Soares, R.M. & Azevedo, S.M.F.O. 2010. Microcystins in South American aquatic ecosystems: occurrence, toxicity and toxicological assays. Toxicon 56: 1247–1256.
[29] Ferrão-Filho, A. d. S.; Kozlowsky-Suzuki, B. & Azevedo, S.M.F.O. 2002. Accumulation of microcystins by a tropical zooplankton community. Aquatic Toxicology 59: 201–208.
[30] Giannuzzi, L.; A. Colombi, T.; Pruyas, A.; Aún, M.; Rujana, M.; Falcione & Zubieta, J. 2009. Cianobacterias y cianotoxinas: identificación, toxicología monitoreo y evaluación de riesgo. MogliaImpresiones. Corrientes, Argentina. 238 p.
[31] Hugarte, H. 2016. Miles de peces mueren en la laguna Alalay. Los Tiempos. Edición 03/10/2016. http://www.lostiempos.com/actualidad/local/20160310/miles-peces-mueren-laguna-alalay. Consultada 01/10/2016.
[32] Jaramillo, D. 2016. Denuncian mortandad de peces en laguna Alalay. El Deber. Edición 03/10/2016. http://www.eldeber.com.bo/bolivia/denuncian-mortandad-peces-laguna-alalay.html. Consultada 01/10/2016.
[33] Karjalainen, M.; Engström-Öst, J.; Korpinen, S.; Peltonen, H.; Pääkkönen, J-P.; Rönkkönen, S.; Suikkanen, S. & Viitasalo, M. 2007. Ecosystem consequences of cyanobacteria in the Northern Baltic Sea. Ambio 36(2-3): 195–202.
[34] Kuiper-Goodman, T.; Gupta, S.; Combley, H. & Thomas, B.H. 1994. Microcystins in drinking water: risk assessment and derivation of a possible guidance value for drinking water. En: Steffensen, D.A. & Nicholson, B.C. (Eds.). Toxic Cyanobacteria - A Global Perspective. p. 17–23. Australian Centre for Water Quality Research, Salisbury.
[35] Lanaras, T. & Cook, C.M. 1994. Toxin extraction from an Anabaenopsis milleri-dominated bloom. The Science of the Total Environment 142: 163–169.
[36] Maldonado, M. & Goitia, E. 1993. Bases limnológicas para la recuperación de la laguna Alalay (Cochabamba). Publicaciones Facultad de Ciencias y Tecnología. Universidad Mayor de San Simón. Serie Científica 3: 1–35.
[37] Maldonado, M.; Van Damme, P. & Roja, J. 1998. Estrategias para la recuperación y la conservación de la laguna Alalay (Cochabamba, Bolivia).Revista Boliviana de Ecología y Conservación Ambiental 3: 3–9.
[38] Meneses, L. 1996. Descripción taxonómica y composición de la comunidad de Cladóceros (Crustacea) de la laguna Alalay. Tesis de Licenciatura en Biología. Universidad Mayor de San Simón. 70 p. [ Links ]
[39] Meneses, L. 1998. Estructura de la comunidad de Cladóceros en la laguna Alalay (Cochabamba, Bolivia). Revista Boliviana de Ecología y Conservación Ambiental 3: 47–58.
[40] Metcalf, J.S. & Codd, G.A. 2014. Cyanobacterial toxins (cianotoxins) in water. Foundation for Water Research, Marlow, U.K. 46 p. [ Links ]
[41] Morales, E.A. 1993. La comunidad de fitoplancton en la laguna Alalay (Cochabamba, Bolivia). Tesis de Licenciatura en Biología. Universidad Mayor de San Simón: 124 p. [ Links ]
[42] Morales, E.A. & Trainor, F. 1996. Phytoplankton community of Alalay Pond, Cochabamba, Bolivia. Algae (The Korean Journal of Phycology) 11(2): 207–215.
[43] Morales, E.A. 2016. Floraciones de cianobacterias en la laguna Alalay como causantes del deceso de peces y aves en el periodo marzo-abril, 2016. Herbario Criptogámico, Universidad Católica Boliviana “San Pablo, Cochabamba-Bolivia. 10 p.
[44] Morales, E.A. & Rivera, S.F. 2012. Choice of macrophyte substrate in the use of diatoms as indicators of water quality assessment: preliminary data on the case of Alalay Pond (Cochabamba, Bolivia). Lakes, Reservoirs and Ponds 6(1-2): 20–42.
[45] Morales, E.A. & Rivera, S.F. 2013. Macrófitas poco frecuentes o desconocidas de la laguna Alalay, Cochabamba, Bolivia. Acta Nova 6(1-2): 36–52.
[46] Morales E.A., Rivera S.F., Wetzel C.E., Hamilton P.B., Bicudo D.C., Amils, P.R. &Ector, L. 2015. Hipótesis: la agrupación Microcystis aeruginosa Kütz.-Nitzschia palea (Kütz.) W. Sm.-bacterias en la laguna Alalay, Cochabamba, Bolivia es de tipo simbiótico. Acta Nova 7: 120–140.
[47] Moustaka-Gouni, M; Michaloudi, E.; Katsiapi, M. & Genistaris, E. 2007. The coincidence of an Arthrospira-Anabaenopsis bloom and the mass mortality of birds in Lake Koronia. Harmful Algae News 35: 6–7.
[48] Nabout, J.C.; Rocha, da S.B.; Carneiro, M.F. & Sant´Anna, L.C. 2013. How many species of cyanobacteria are there? Using a discovery curve to predict the species number. Biodiversity Conservation 22: 2907–2918.
[49] Ohtani, I.; Moore, R.E. & Runnegar, M.T.C. 1992. Cylindrospermopsinea potent hepatotoxin from the blue-green-alga Cylindrospermopsisraciborskii. Journal of the American Chemical Society 114(20): 7941–7942.
[50] Oliver, R.L. & Ganf, G.G. 2002. Freshwater blooms. En: Whitton, B.A. & Potts, M. (Eds.). The Ecology of Cyanobacteria, their diversity in Time and Space. Kluwer Academic Publishers. USA. pp. 149-194.
[51] OSHA-Occupational Safety and Health Administration, United States Department of Labor. 2016. HydrogenSulfide. https://www.osha.gov/SLTC/hydrogensulfide/hazards.html. Consultada: 01/10/2016. [ Links ]
[52] Pandey, V.D. & Parveen, S. 2011. Alkaline phosphatase activity in cyanobacteria: physiological and ecological significance. Indian Journal of Fundamental and Applied Life Sciences 1(4): 295-303. [ Links ]
[53] Pérez, M. 2005. Especiación de metales pesados en sedimentos de la laguna Alalay. Tesis de Maestría en Ingeniería Ambiental. Universidad Mayor de San Simón, Cochabamba: 90 p.
[54] Pick, F.R. 2015. Blooming algae: a Canadian perspective on the rise of toxic cyanobacteria. Canadian Journal of Fisheries and Aquatic Sciences 73: 1149–1158.
[55] Rivera, S.F. 2012. Desarrollo de una herramienta de diagnóstico ambiental para ecosistemas acuáticos lénticos: adecuación de índices diatomológicos para la determinación del
estado trófico de la laguna Alalay, Cochabamba-Bolivia. Tesis para la obtención del grado de Licenciatura en Ingeniería Ambiental. Universidad Católica Boliviana “San Pablo”, Cochabamba, Bolivia. 163 pp.
[56] Romero, A.M.; Van Damme, P. & Goitia, E. 1998. Contaminación orgánica en el río Rocha (Cochabamba, Bolivia). Revista Boliviana de Ecología y Conservación Ambiental 3: 11–23.
[57] Seckbach, J. & Oren, A. 2007. Oxygenic photosynthetic organisms in extreme environments: possibilities and limitations. En: Seckbach, J. (Ed.). Algae and cyanobacteria in extreme environments. p. 5–25. Springer. Dordrecht, Holanda.
[58] Song, H.; Coggins, L.X.; Reichwaldt, E.S. & Ghadouani, A. 2015. The importance of lake sediments as a pathway for microcystin dynamics in shallow eutrophic lakes. Toxins 7: 900–918.
[59] Stuart, R.K.; Mayali, X.; Boaro, A.A.; Zemla, A.; Everroad, R.C.; Nilson, D.; Weber, P.K.; Lipton, M.; Bebout, B.M.; Pett-Ridge, J. & Thelen, M.P. 2016. Light regimes shape utilization of extracellular organic C and N in a cyanobacterial biofilm. mBio 7(3): e00650-16. doi:10.1128/mBio.00650-16. [ Links ]
[60] Svirčev, Z.; Drobac, D.; Tokodi, N.; Vidovic, M.; Simeunovic, J.; Miladinovmikov, M. & Baltić, V. 2013. Epidemiology of primary liver cancer in Serbia and possible connection with cyanobacterial blooms. Journal of Environmental Science and Health Part C: Environmental Carcinogenesis and Ecotoxicology Reviews 31: 181–200.
[61] UMSS-Universidad Mayor de San Simón. 1990. Informe final técnico de la laguna Alalay. Cochabamba, Bolivia. 120 p. [ Links ]
[62] van Apeldoorn, M.E.; van Egmond, H.P.; Speijers, G.J.A. & Bakker, G.J.I. 2007. Toxins of cyanobacteria. Molecular Nutrition & Food Research 51(1): 7–60.
[63] Van Damme, P.A.; Romero, A.M.; Goitia, E.; Rojas, J.; Cadima, M.; Arce, F. & Romero, M. 1997. Evaluación de estrategias actuales y alternativas para la recuperación de la laguna Alalay (Cochabamba). Centro de Medio Ambiente y Recursos Renovables CEMAR. Universidad Mayor de San Simón. Cochabamba. 91 p. [ Links ]
[64] van den Hoek, C.; Mann, D.G. & Jahns, H.M. 1995. Algae. An Introduction to Phycology. Cambridge University Press, USA. 623 pp. [ Links ]
[65] Wetzel, R.G. & Likens, G.E. 1991. Limnological Analyses. Second Ed. Springer-Verlag, Nueva York. 391 p.
[66] Wetzel, R.G. 2001. Limnology. Lake and river ecosystems. Third Ed. Elsevier, Academic Press, Boston. 1006 p.
[67] Wiegand, C. & Pflugmacher, S. 2005. Ecotoxicologicaleffects of selected cyanobacterial secondary metabolites a short review. Toxicology and Applied Pharmacology 203(3): 201–218.
[68] World Health Organization. 2003. Algae and cyanobacteria in Freshwaters. En: WHO (Ed.). Guidelines for safe recreational water environments. Volume 1: Coastal and fresh waters. Chapter 8. p. 136-158. WHO, Ginebra.
[69] Zanchett, G. & Oliveira-Filho, E.C. 2013. Cyanobacteria and cyanotoxins: from impacts on aquatic ecosystem and human health to anticarcinogenic effects. Toxins 5: 1896–1917.
[70] Zastepa, A.; Pick, F.R. & Blais, J.M. 2014. Fate and persistence of particulate and dissolved microcystin-LA from Microcystis blooms. Human and Ecological Risk Assessment 20: 1670–1686.
[71] Zastepa, A.; Pick, F.R.; Blais, J.M. & Saleem, A. 2015. Analysis of intracellular and extracellular microcystin variants in sediments and pore waters by accelerated solvent extraction and high performance liquid chromatography – tandem mass spectrometry. AnalyticaChimica Acta 872: 26–34.
[72] Zhang, J.; Wang, Z.; Song, Z.; Xie, Z.; Li, L. & Song, L. 2012. Bioaccumulation of microcystins in two freshwater gastropods from a cyanobacteria-bloom plateau lake, Lake Dianchi. Environmental Pollution 164: 227–234.