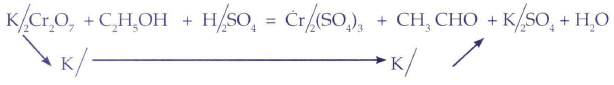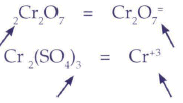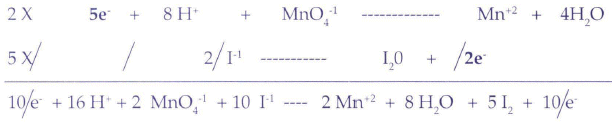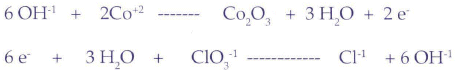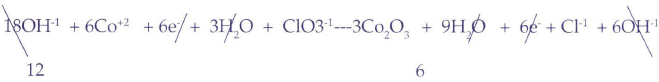Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
EduCiencias - Revista Científica de Publicación del Centro Psicopedagógico y de Investigación en Educación Superior
versión impresa ISSN 1490-2351
Rev Cient CEPIES v.1 n.1 La Paz mayo 2009
MODELO ALTERNATIVO PARA LA ENSEÑANZA DE LA QUÍMICA EN EL TEMA: "IGUALACIÓN DE ECUACIONES"
Mg.Sc. José Gustavo Calderón Valle
Universidad Mayor de San Andrés
Resumen
La Universidad Mayor de San Andrés, es definitivamente la Universidad donde los estudiantes van a encontrar grandes desafíos durante sus años de estudios, que les permitirán demostrar sus grandes logros, a veces desconocidos por la mayoría pensante en nuestro país. Ahora se trata de presentar un nuevo método para igualar ecuaciones, que le permite al estudiante por primera vez, utilizar un método basado en una de las más grandes premisas de la educación moderna: El estudiante debe aprender todo lo que a él le gustaría aprender..... En lo que se refiere a igualación de ecuaciones, ya no se aceptaran imposiciones de métodos como redox, ión electrón o el mismo método algebraico. Ahora existe la posibilidad de analizar un método que se identifica con la juventud, por la raíz misma de su concepción. El método "CALDEROX" es desde todo punto de vista, el método mas novedoso que se dispone en la Universidad.
MÉTODO "CÁLCULOS REDUCCIÓN - OXIDACIÓN"
Introducción
Durante los estudios de una licenciatura que incluya en su programa la asignatura de "Química General e Inorgánica", en una de las Universidades acreditadas del Sistema Universitario Boliviano, veremos fácilmente que existe un capítulo muy temido por los jóvenes estudiantes, que es el tema de Estequiometría (Balance de materia), que incluye un capítulo denominado "Igualación de Ecuaciones Químicas" (Longo, 1975). Sobre la base de la Ley de la Conservación de la materia se plantean ecuaciones químicas que deben igualarse, para demostrar precisamente esta ley: "Nada se crea, nada se destruye, todo se transforma", que también puede expresarse de otras dos maneras diferentes: "La materia no se crea ni se destruye, solo se transforma", o también: "La sumatoria de las masas de los reactivos, siempre debe ser igual a la sumatoria de las masas de los productos". Solo la teoría de la Relatividad propuesta por Albert Einstein ha puesto en duda la validez de esta Ley, que actualmente se enseña en muchos de los lugares donde hay transmisión de conocimientos, referidos a este campo (Umland, Bellama, 2000).
Si bien desde mucho tiempo atrás han existido varios métodos, comenzando por el método simple de tanteo, el método algebraico, el método Redox y el método del ión electrón, entre otros, todos estos han "defraudado" por diversos motivos que se explican en este artículo.
Primeramente, podemos decir que con el método del tanteo simple es muy difícil, casi imposible, llegar a igualar ecuaciones complejas que contengan varios compuestos. Existen demasiadas probabilidades de varios números diferentes, para poder tener éxito con este método. Nos referiríamos al método Redox, solamente y al método Ión electrón, que son los métodos que tradicionalmente se enseñan en los colegios, especialmente de la ciudad de La Paz. Después de haber experimentado con el método Redox durante varios años en unidades educativas del país, se puede llegar a una conclusión que es lapidante para este método. El primer paso es realmente difícil para un joven estudiante de ciclo medio de nuestro país. "Escribir las valencias de los elementos en la parte superior de estos".... Consideremos la existencia de más de cien elementos en la Tabla periódica y si bien no son más de cincuenta los elementos que participan dentro del programa de nivel secundario, para un joven estudiante bisoño, es muy difícil memorizar todas las valencias de estos elementos. Como ha tenido que memorizar estas valencias en el nivel secundario, de una manera conductista y repetitiva, cuando llega a nivel universitario, se hace muy difícil recordar las valencias de tantos elementos, por la sencilla razón que su aprendizaje no ha sido funcional, menos significativo. Cuando el primer paso es difícil, el estudiante está condenado de antemano a fracasar. Peor si es el caso donde aparecen elementos no muy utilizados en secundaria, como Tecnecio o Ytrio. Para poder utilizar el método redox, es necesario que el joven estudiante domine las valencias de la mayor cantidad de elementos.
En lo que se refiere al método ión electrón, el primer paso lamentablemente para los estudiantes, es el más difícil de todos: "Radicalizar los compuestos que participan en una ecuación química", Eso significa dominar de memoria el capítulo denominado "Radicalización": La formación de los radicales hipo... .oso, oso, ico, perico, La formación de los radicales peroxo, tio radicales y peroxi radicales. Radicales de los ácidos polihidratados, como los meta, piro y orto radicales. Anomalías de los radicales polihidratados (Calderón, 1994). Es muy difícil sinceramente que el estudiante novato pueda encontrar los radicales que se piden en una ecuación, sin fallar por lo menos en uno de ellos. Esto es suficiente para que no pueda igualar una ecuación.
Método "Calderox"
A través de los años, al haber elegido la Cátedra de Química como ejercicio profesional, pude darme cuenta de que había que considerar al alumno de una manera completamente opuesta a la tradicional, de una forma distinta, o sui géneris; tal vez muy diferente a la forma que estamos acostumbrados. Tendríamos que querer tanto al alumno, a tal punto de enterarnos y tomar en cuenta todos sus problemas, considerar todas sus actividades. En el campo de la Química tomar como base, sustento para la enseñanza, aquello que a él le gusta, y no precisamente acerca de la materia sino aquello que le gusta en sus actividades normales, cotidianas, que aparentemente no tienen algo que ver con química.
No hay joven, por ejemplo, al que no le llamen la atención los cambios, las novedades, en todo lo que se le presente en la vida. Aquello que precisamente les parece bien a los adultos conservadores, justamente no les gusta a los jóvenes, y se les vuelve detestable o viceversa ya que lo que le parece bien a la juventud causa desazón en el entender de las buenas costumbres y la moral de los conservadores. Por ejemplo: Todos alaban la vestimenta pulcra, sin remiendos ni perforaciones, pero los jóvenes visten ahora ropa perforada, exhibiendo partes desnudas de su cuerpo, justamente lo que antes causaba una sensación desagradable, ahora es perfectamente normal y preferido entre los jóvenes. Las camisas bien abotonadas antes era una exigencia de rigor, ahora mientras menos botones queden en su lugar, tanto más adecuada la ropa a la moda actual.
A la juventud le gusta precisamente lo contrario de lo que parece ser lo más adecuado y normal. Los aretes que lucen ahora los jóvenes nos revelan la situación de que "no sólo los aretes son para las mujeres", sino para todo aquel que quiera lucirlos. Si es varón, mejor. "Los aretes son de las señoritas", muy bien, ahora los jóvenes se perforan las orejas y los usan. Siempre podíamos escuchar lo bien que se ve una pareja de baile, es decir, un hombre y una mujer, perfecto, ahora los jóvenes bailan por su lado y las señoritas por el suyo. Basta de ejemplos, ¿no?
En la materia de Química General e Inorgánica, hay muchos temas que son difíciles para nuestros estudiantes actuales y otros que por especiales circunstancias son fáciles para nuestros jóvenes. El nuevo modelo alternativo de enseñanza de la Química y otras materias, apunta a los temas considerados "difíciles", tomando en cuenta mi punto de vista como educador con algunos años de experiencia.
Hablemos por ejemplo del capítulo "Igualación de Ecuaciones". Este simple capítulo exige de manera rotunda el conocimiento de la Nomenclatura Química Orgánica e Inorgánica. Supone un dominio completo de la Tabla de valencias. Los métodos tradicionales que se tienen que enseñar son "Reducción-oxidación" (Whitten, 1999) e "Ión electrón" (Brown, 1993). El grave problema que se presenta es el siguiente: El primer paso del método "REDOX" (Reducción-oxidación) exige un conocimiento completo de todas las valencias de los 100 y tantos elementos que se conocen en la actualidad (118 según la Tabla MERCK). Pedirle este requisito a un joven parlanchín, bonachón y distraído (en sus cosas), equivale a condenarlo al fracaso. Pocos jóvenes podrán recordar sin errores todas las valencias involucradas en los elementos químicos estudiados. Como el método REDOX exige en su primer paso el dominio de las valencias, los resultados son funestos cuando un joven trata de igualar alguna ecuación. De entrada está "liquidado" porque el mayor esfuerzo debe realizar al comienzo.
En cuanto se refiere al método Ión-electrón, otro tanto ocurre, en vista de que el primer paso que exige este método es fulminante. Se pide radicalizar los compuestos participantes en una ecuación, esto es terrible por lo que en verdad se está pidiendo, es grave: el dominio de un número grande de radicales que forman todos los elementos conocidos hasta la fecha. El joven tiende a "ridiculizar" a diferencia del pedido original.....Sin ser muy pesimista, podría indicar que se manda a un alumno novato, bisoño e inexperto a escalar un nevado muy peligroso, dándole simplemente algunas lecciones de alpinismo o tal vez un manual sobre el ascenso de cerros. Los resultados ya son imaginables, el desenlace es, obviamente terrible. Y además ni siquiera le consultamos si sabe escalar montañas o si le gusta ese deporte. Simplemente le imponemos algo que a la postre, el joven comienza a rechazar. Tal vez es emprendedor y sigue con ansias el camino, pero como es difícil (sólo los expertos podrán hacerlo), es muy posible que fracase. No es que sea muy pesimista, lo que hablo y escribo es la realidad de 20 años de trabajo. Ahora pensemos lo contrario, enseñarle a un joven a perfeccionar lo que le gusta, ¡a utilizar lo que siempre a efectuado toda su corta vida!.
¿Qué es esto?, ¿Será posible igualar ecuaciones tomando en cuenta sólo lo que a un joven le gusta hacer como tal?
Primeramente establecí que es lo que le gusta hacer a un joven de los años actuales. Por demás está decir que lo que más le gusta es bailar y salir con sus amigos a encontrar novedades o como ellos dicen a "chequear". Estas respuestas las conseguí clasificar luego de efectuar varios "sondeos" o "encuestas" a un nutrido, grupo de jóvenes de distintas universidades. El gran desafío estaba planteado. Había que relacionar una igualación de ecuaciones (algo considerado aburrido y difícil por muchos jóvenes) con lo que más le gusta hacer.
En el año 1994 nace el método "Cálculos reducción-oxidación", como una respuesta a este desafío por demás inusual.
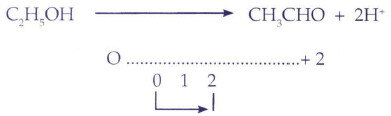
Primer paso: El primer paso de este método tiene como palabra clave "bailar". El paso de baile es uno a la izquierda y dos a la derecha, y esto se interpreta de la siguiente manera: En la mayoría de los compuestos participantes en una ecuación química apreciamos tres elementos, uno será separado a la izquierda mediante una diagonal y los otros dos quedarían separados a la derecha.
Ejemplo:
![]()
De esta manera se radicalizaban los compuestos de una manera totalmente diferente y fácil a la vez. Se evitaría escribir las valencias de los elementos (REDOX) y/o radicalizar (ION-ELECTRON). Pero surgen algunas dificultades con algunos compuestos que no se separan como los óxidos, compuestos orgánicos y también había que considerar a los elementos "sueltos" que se hallan como sustancias puras. Esto quedó solucionado considerando un símil humano: ¿Quiénes no bailan en una celebración?. Obviamente los que no tienen pareja, los elementos sueltos (elementos puros), los que son demasiado viejos (los óxidos, u elementos oxidados) y los que desgraciadamente se hallan en estado inconveniente (estado etílico) que representarían a los compuestos orgánicos.
El joven estudiante por primera vez encuentra en lo que le gusta una nueva forma de comenzar con cierto éxito una igualación de ecuaciones.
Ejemplo:
Con estas simples diagonales el primer paso estaba dado: un elemento a la izquierda y dos a la derecha, menos en el caso de los elementos puros, óxidos y compuestos orgánicos.
Segundo paso: El segundo paso de este método tiene como palabra clave "chequear" (abrir los ojos y mirar el horizonte) es decir, encontrar los cambios que existen en la ecuación (los jóvenes se identifican con los cambios). ¿Cuáles son estos cambios?
Volvamos a la misma ecuación:
(No cambió nada, luego no sirve de nada)
Pero atención:
Este es un gran cambio apreciable, digno de anotarse:
(Se encontró una semirreacción)
Porque de las cargas: Los radicales ubicados a la izquierda tienen carga positiva, los radicales ubicados a la derecha tienen carga negativa. No es necesario saber en la mayoría de los casos las valencias de los radicales de memoria, ya que estos se hallan escritos como en el caso del dicromato:
O en el caso del sulfato crómico:
Otro cambio:
(Carga cero para ambos porque no se radicalizan)
No existen otros cambios más, por lo tanto quedamos como:
El tercer y cuarto paso son idénticos a los que menciona el método ION ELECTRON, pero lo importante es haber llegado hasta el segundo paso que casi nunca se conseguía con los otros métodos. ¿Cómo se hizo posible todo esto? Simplemente tomando en cuenta algo que los jóvenes aprecian.
Tercer paso: Igualar el número de átomos y luego el número de electrones, entonces tendremos en medio ácido:
Cuarto paso: Nada más fácil que trasladar los coeficientes encontrados a la ecuación original y efectuar el tanteo final.
¡Se encuentra igualada!
La sigla que identifica el método "CALCULOS REDUCCION-OXIDACION" es "CALDEROX" por la siguiente razón:
Las flechas indican el cambio de electrones:
REDUCCION (A LA IZQUIERDA)
OXIDACION (A LA DERECHA)
Otro ejemplo:
Igualar por cualquier método (menos tanteo) la siguiente ecuación química, que se encuentra en medio ácido (sulfúrico).
Primer paso: Palabra clave "Bailar". Separar un elemento a la izquierda y dos a la derecha menos en el caso de óxidos, elementos puros y compuestos orgánicos. Si son dos elementos se separarán por el medio.
Segundo paso: Palabra clave "Chequear". Cuáles de los elementos o compuestos están sufriendo cambios de valencia o de estructura, anotándolos aparte, como semirreacciones.

Los "cambios" son fáciles de apreciar: MnO4 no se repite de la izquierda a la derecha, sólo hay Mn (en el segundo paso no nos interesan los oxígenos, hidrógenos y moléculas de agua). Luego I en la izquierda, que no se repite como tal en la derecha, puesto que sólo hay I2, anotamos como segunda semireacción. En cuanto a las cargas, debemos indicar que afortunadamente la mayoría de los elementos que se hallan a la izquierda en esta reacción y en muchas otras, son monovalentes, por lo tanto, si el permanganato MnO4 se halla al lado del potasio K +1, entonces su carga será -1 (MnO4-1 para que la sumatoria de cargas salga igual a 0) . De la misma manera para el yoduro I, que se halla al lado de un potasio K+1, su carga será -1 I-1 (así -1 +1 = 0). Como el yodo molecular no está combinado, entonces obviamente su carga es cero I20, y en forma general para todos los que no "bailan".
Tercer Paso: Palabra clave "igualar", primeramente el número de átomos, utilizando en el caso de medio ácido, moléculas de agua y protones o simples coeficientes (números), si se trata de medio básico se pueden utilizar moléculas de agua y oxidrilos o simples coeficientes (números).
Igualación de átomos:
Igualación de cargas:
De +7 a +2 = Reducción (ganancia de 5 electrones)
Abajo:
De -2 a O = Oxidación (pérdida de 2 electrones)
Multiplicamos en "cruz", los electrones de abajo por los de arriba y viceversa.
Los electrones se pueden simplificar en este caso
Cuarto paso: Palabra clave "trasladar". Los coeficientes encontrados a la ecuación original y efectuar el tanteo final.
El número seis sale como producto del tanteo final.
Ejemplo medio básico:
Igualar por cualquier método (menos tanteo) la siguiente ecuación química que se halla en medio básico (hidróxido de potasio):
Primer paso:
Segundo paso:
Tercer Paso:
Para la primera semirreacción: Como se trata de medio básico (por la presencia de hidróxidos, en este caso KOH), el número de oxígenos que faltan a la izquierda se anotan en forma duplicada como Oxidrilos y la mitad de ese número en forma de aguas a la derecha.
Para la segunda semirreacción: Hay tres oxígenos a la izquierda, por lo tanto anoto seis oxidrilos a la derecha y tres aguas a la izquierda.
La igualación de las cargas:
De - 2 a 0, oxidación con 2 electrones
De -1 a -7, reducción con 6 electrones
Multiplicamos por 6 arriba y por 2 abajo ( o mejor por 3 arriba y 1 abajo simplificando)
Cuarto paso:
El número 13 para el KC1, se lo obtiene mediante el tanteo final.
CONCLUSIONES
El método Calderox es una posibilidad interesante comparada con otros métodos. No solamente la experiencia de un profesor que ha intentado inculcar por mucho tiempo otros métodos puede validar la rigurosidad científica de este nuevo método. Debe ser motivo de un estudio cualitativo y cuantitativo profundo para determinar si este nuevo método, basado en lo que le gusta hacer al estudiante, será lo suficientemente riguroso como para ser utilizado en los centros educativos del país. Mientras tanto muchos profesores ya lo aprecian y lo están desarrollando en las aulas de nuestro país.
BIBLIOGRAFÍA
Whitten, K.; Gailey K.; Davis R. (1992) Química General. Editorial McGraw-Hill, Tercera Edición. México. 884 p. [ Links ]
Umland, J.; Bellama, J. (2000) Química General. Editorial Thomson, Tercera Edición. México. 1016 p. [ Links ]
Calderón, G. (1994) Prácticas de Química General. Editorial Escuela Naval Militar. Bolivia. [ Links ]
Burns, R. (1996) Fundamentos de Química. Editorial Prentice Hall. Segunda Edición. México. 664 p. [ Links ]
Brown, T.; Lemay, E.; Bursten, B. (1993) Química: la ciencia central. Editorial Prentice Hall. Quinta Edición. México. 1159 p. [ Links ]
Longo, F. (1975) Química General. Editorial McGraw-Hill. Primera Edición. Colombia. 493 p. [ Links ]