Servicios Personalizados
Articulo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares en SciELO
Similares en SciELO
Bookmark
BIOFARBO
versión impresa ISSN 1813-5363
BIOFARBO v.16 n.1 La Paz dic. 2008
Validación del método analítico para la cuantificación de alcaloides quinolínicos del extracto de Galipea longiflora Krause Kallunki
Analytic method validation for the cuantification of quinolinical alkaloid in extracts from Galipea longiflora Krause Kallunki
Vania Herrera1, Juan Carlos Ticona1 , Enrique Udaeta1, Rogelio Chuqui2 y Alberto Giménez1
1Instituto de Investigaciones Fármaco Bioquímicas
2Comunidad de Santa Rosa de Maravilla
Dirección para correspondencia: Vania Herrera MSc.Instituto de Investigaciones Fármaco Bioquímicas. Av. Saavedra 2224. 2do Piso. Miraflores , La Paz, Bolivia.
Tel : 2229021
E mail : vaniaceciliaqf@yahoo.es
RESUMEN
El presente artículo describe la validación de un método de cuali-cuantificación de alcaloides quinolínicos por espectrofotometría UV con máximos de absorción de 330-335nm de longitud de onda. Para su cuantificación el extracto de alcaloides es disuelto en ácido clorhídrico 1N, al 0,05 %p/v y se preparan 12 diluciones 1:2. El método cumple con los requerimientos de exactitud y precisión con límites de detección y cuantificación entre 0,567-7,81 μg/mL y 1,72-7,81 μg/mL para los alcaloides quinolínicos respectivamente. Se obtuvieron respuestas lineales entre 0,244–7,81 μg/mL con un coeficiente de determinación de 0,997. Se verificó la robustez del procedimiento aplicando tres variables, temperatura, luz UV y pH.
Palabras Clave: Plantas medicinales, alcaloides, validación, espectrofotometría.
ABSTRACT
In order to have an exact and specific method, a study of validation of quinolinics alkaloids by UV spectrophotometry with peak of absorption at 330-335nm of wavelength was carried out. For the quantification of alkaloids these are dissolved in hydrochloric acid 1N to 0,05 %p/v of which 12 dilutions 1:2 had to get prepared. . The method is exact and precise with limits of detection and quantification between 0,567-7,81 and 1,72-7,81 μg/mL respectively for the total alkaloids. The linear relation is between 0,244-7,81 μg/mL with a coefficient of determination of 0,997, also, its robustness was verified applying three variables: temperature, UV light and pH.
Key Words: Medicinal plants, alkaloids, validation, spectrophotometry
INTRODUCCIÓN
En el Instituto de Investigaciones Fármaco Bioquímicas (IIFB) se están desarrollando investigaciones sobre nuevos fármacos para el tratamiento de la leishmaniasis, a partir de extractos vegetales que contienen alcaloides quínolínicos1.
Durante el desarrollo de un extracto estandarizado, consistente en una mezcla de sustancias relacionadas, es imprescindible la aplicación de un método analítico que permita cuantificar el o los componentes mayoritarios, en el extracto total2,3. En el estudio de los alcaloides, se ha determinado, por métodos espectroscópicos que más del 90% de alcaloides presentes en la Galipea longiflora representa una mezcla de cinco alcaloides quinolínicos, entre los que la 2-fenilquinolina representa cerca del 50% de los mismos. Las estructuras que contiene el esqueleto de la quinolina, presentan un excelente cromóforo para su cuantificación por métodos de absorción espectrofotométrica, en la región comprendida entre las longitudes de onda de 200 a 400nm4.
Para la obtención de resultados exactos y precisos con alto grado de seguridad es indispensable realizar la validación del método analítico, que se utilizará en la cuantificación del extracto de alcaloides quinolínicos, con el fin de asegurar la confiabilidad y establecer una evidencia documentada del procedimiento.
En el presente trabajo se consideran parámetros de validación como: a) la exactitud que expresa el grado de proximidad de los resultados obtenidos por el método, con relación a los verdaderos valores5,6,7; b) la precisión, que indica el grado de concordancia entre los resultados de una prueba individual cuando el método es aplicado repetitivamente a múltiples lecturas de una muestra homogénea5, en dos términos: 1) repetibilidad, es decir, la precisión de los valores, obtenida bajo las mismas condiciones de operación en un intervalo corto de tiempo (mismo día), por un mismo analista, en la misma muestra homogénea y en el mismo equipo y 2) precisión intermedia que a diferencia de la anterior, expresa la variación dentro del laboratorio, en diferentes días, diferentes analistas o en diferentes equipos. c) El límite de detección, que permite encontrar la concentración más baja en una muestra que puede ser detectada por una única medición con un nivel de confianza determinado5; d) el límite de cuantificación que permite medir la cantidad más pequeña en una muestra que puede ser cuantitativamente determinada con aceptable exactitud y precisión; d) la especificidad, relacionada con la presencia de interferencias o errores sistemáticos, e) la linealidad, parámetro que permite expresar la capacidad del método analítico para dar resultados directamente proporcionales a la concentración del analito en la muestra y tiene como parámetros a r que es el coeficiente de correlación y r2 el coeficiente de determinación considerándose el método lineal, cuando r es mayor a 0,9997 y r2 mayor o igual a 0,9975; f) la sensibilidad del método, que se expresa en unidades de respuesta sobre unidades de concentración del extracto, a mayor pendiente mayor sensibilidad7; y g) la robustez, que permite expresar la capacidad del método analítico para permanecer inalterado por ligeras pero deliberadas variaciones que son introducidas en los parámetros del método.
MATERIAL Y MÉTODOS
Preparación del extracto de alcaloides quinolínicos. Para la determinación de los parámetros de validación del método analítico se prepararon 12 diluciones 1:2 a partir de una solución madre de 0,5% p/v de alcaloides quinolínicos suministrado por el área de fitoquímica del Instituto de Investigaciones Fármaco Bioquímicas, en HCl 1N, por cuadruplicado, mezclados por 1 minuto en vortex.
Medidas de Exactitud. Para la determinación de este parámetro se eligieron las diluciones 6,7 y 8 consideradas representativas de los espectros de la batería de diluciones, de las cuales se realizó un barrido espectral de 200 a 400 nm de longitud de onda, según las absorbancias obtenidas pudimos determinar errores sistemáticos. La International Conference on Harmonization (ICH)2,3, recomienda que la exactitud debe ser evaluada usando un mínimo total de nueve determinaciones sobre al menos, tres niveles de concentración y se aplica la siguiente ecuación:

dónde ER es el Error relativo y C es concentración
Medidas de Precisión. Para la determinación de este parámetro se tomaron en cuenta tres diluciones 6,7 y 8 a partir de una solución madre al 0,5 % p/v en HCl 1 N a condiciones normales de trabajo en dos días diferentes para repetibilidad y en tiempos diferentes en un mismo día para precisión intermedia de los que se calculó el coeficiente de variación, desviación estándar. La precisión del método analítico es expresado como la desviación estándar o desviación estándar relativa (coeficiente de variación) de una serie de medidas.
![]()
donde D.S. es la desviación estándar, N es el número de datos, x los valores obtenidos y x la media de los valores.
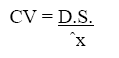
Medidas de Linealidad. Para la linealidad se eligieron las diluciones 6,7,8,9,10,11, por encontrarse dentro de los límites establecidos para métodos espectrofotométricos para el cumplimiento de la ley de Lamber y Beer y por la ausencia de distorsión en el espectro, de las mimas se realizó un barrido de 200 a 400 nm, y se estudió la relación de absorbancia y concentración con la que se obtuvo la curva de calibración y se aplicó regresión lineal y se determinó los parámetros siguiendo la fórmula general de la recta.
![]()
Donde y es la absorbancia, a es el intercepto b es la pendiente y x la concentración.
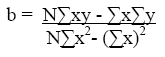
donde N es el número de datos observados.
El intercepto se calcula de acuerdo a la siguiente fórmula

Para comprobar la linealidad se realiza el cálculo de coeficiente de correlación múltiple y de determinación:

y el coeficiente de determinación es:
![]()
Para confirmar la linealidad del método analítico se realiza el cálculo del coeficiente recorrelación, coeficiente de determinación de la regresión lineal y un valor de F calculado de la regresión lineal muy superior al valor crítico según el tamaño de la muestra.
Medidas de límites de detección y de cuantificación. Estos parámetros se determinaron en las diluciones 6,7,8,9,10,11. Se aplicó la ecuación obtenida en la regresión lineal a estos seis niveles de concentración, para obtener la concentración experimental con la que se calculó los dos límites.
Límite de Detección (LD):
![]()

Límite de cuantificación (LC):
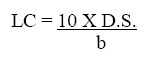

Medidas de Robustez. A seis niveles de concentración (diluciones 6,7,8,9,10,11), se introdujeron tres variables, temperatura, pH, luz UV y se analizaron las gráficas de barrido de 200 a 400 nm de longitud de onda, aplicando análisis de varianza.
RESULTADOS
Se tomó en cuenta mediciones de las absorbancias de luz de ultravioleta entre 330-335nm de los alcaloides quinolínicos a las diferentes concentraciones especificadas en cada prueba.
Exactitud. Se consideraron los datos a 3 niveles de concentración por cuadruplicado (diluciones 6,7,8) de los cuales se realizó el cálculo de la desviación estándar y el error relativo.
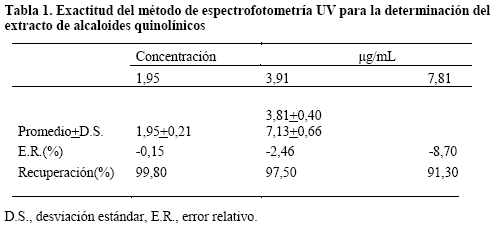
Se pudo observar desviaciones estándar inferiores a 1 a tres niveles de concentraciones, errores relativos superiores a mayores concentraciones e inferiores a ±2 a 1,953μg/mL considerado óptimo6 para métodos analíticos, además de porcentajes de recuperación cercanos a 100% (Tabla 1).
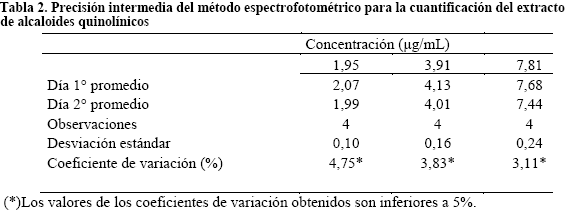
Precisión. Fue establecida la precisión intermedia al comparar los resultados de 4 mediciones obtenidas en diferentes tiempos (diferente día) a tres niveles de concentración de alcaloides quinolínicos, además se obtuvieron coeficientes de variación inferiores al 5% (Tabla 2).
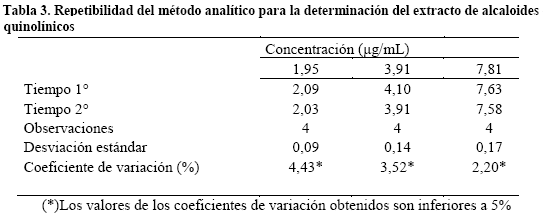
Y la repetibilidad fue establecida al comparar los resultados de 4 mediciones obtenidas en diferentes tiempos (mismo día) a tres niveles de concentración de alcaloides quinolínicos, y sus coeficientes de variación son inferiores a 5% (Tabla 3).
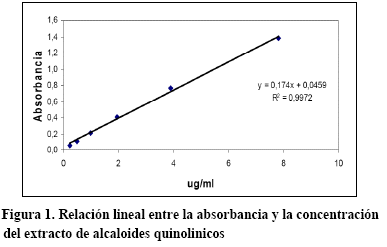
Linealidad. Para el cálculo de linealidad se realizaron mediciones de absorbancia de seis diluciones, por cuadruplicado con las cuales se calculo: el intercepto, la pendiente y el coeficiente de correlación (Tabla 4).

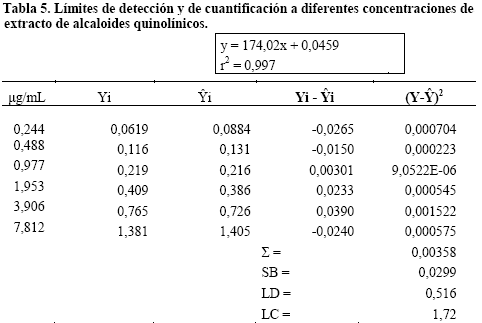
Límite de detección y de cuantificación (LD y LC). Se tomaron en cuenta seis diluciones ( 6,7,8,9,10 y 11) y se aplicó la ecuación de la recta calculada en la linealidad para el cálculo de las concentraciones (Tabla 5).
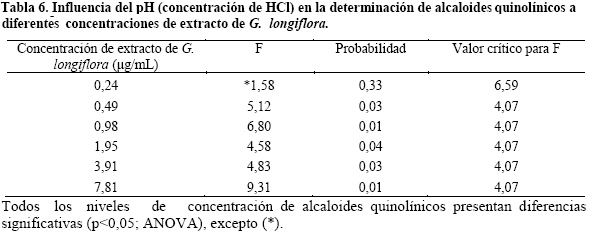
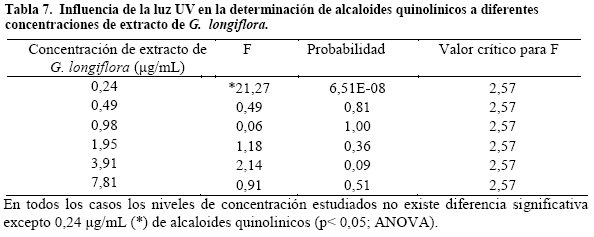
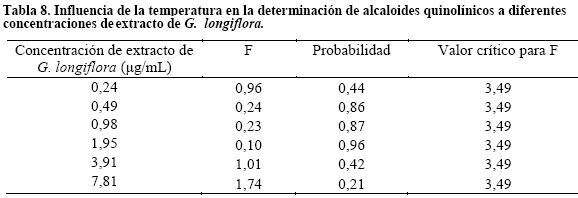
Robustez. Se realizó el análisis estadístico de los promedios de las lecturas obtenidas a diferentes concentraciones de ácido y a diferentes concentraciones de soluto (Tablas 6,7 y 8).
DISCUSIÓN
El estudio de exactitud excluye la existencia de errores sistemáticos, al obtener datos próximos al valor verdadero con porcentajes de recuperación cercanos o iguales a 100%6.
En términos de precisión intermedia el método es preciso a tres niveles de concentración diferentes necesarias para la determinación de estos parámetros8 con las medidas realizadas en dos días consecutivos además de presentar coeficientes de variación inferiores al 5% y una desviación estándar inferior a 2 considerada aceptable para los métodos espectrofotométricos. En términos de repetibilidad los resultados demuestran la existencia de precisión por no presentar diferencias significativas en muestras analizadas durante un mismo día por un mismo analista en el mismo laboratorio con los mismos equipos y reactivos6.
La linealidad del método evaluado en el intervalo de concentración teórica comprendido entre 0,244-7,81μg/mL con un coeficiente de correlación de 0.999 y un coeficiente de determinación de 0,997 (cercanos a la unidad) que indica la existencia de una proporcionalidad lineal7,6entre las concentraciones de extracto de alcaloides quinolínicos respecto a la absorbancia, con un grado de probabilidad del 95% como el que fue encontrado en otros métodos empleados para la determinación de moléculas quinolínicas9. Además de obtener la ordenada al origen que pasa por cero con un α de 0.05, obteniéndose una diferencia altamente significativa de la regresión lineal en el análisis de varianza.
En cuanto a los límites de detección y cuantificación los valores demuestran una detección del equipo a partir de 0,57μg/mL y una cuantificación a partir de 1,7μg/mL con una exactitud y precisión aceptable lo cual demuestra la factibilidad del método10.
En el estudio de robustez los análisis de varianza que se realizaron para cada variación presentaron una diferencia significativa cuando se cambia el pH del solvente a concentraciones de 3,125 a 1,953μg/mL y en cuanto a variaciones de temperatura e irradiación con luz UV no presentaron diferencias significativas entre 0, 977 y 3,125μg/mL lo cual demuestra la fiabilidad del método espectrofotométrico en las condiciones descritas6. Donde la exposición a la radiación ultravioleta y a temperaturas hasta la ebullición no altera las lecturas de absorbancia de alcaloides quinolínicos, pero sí la variación de pH observando desplazamiento batocrómico a menor pH.
Por lo cual el método descrito para la determinación de extracto de alcaloides quinolínicos mediante espectrofotometria UV-VIS aplicado de forma efectiva a la cuantificación de otros alcaloides11, es efectivo para la cuali-cuantificación de alcaloides quinolínicos de la Galipea longiflora debido a que posee precisión y exactitud adecuadas, relación lineal con un coeficiente de correlación cercano a la unidad entre 0,244-7,81μg/mL, es selectivo para detectar concentraciones mayores a 0,57μg/mL y cuantificar con precisión y exactitud concentraciones de extracto de alcaloides quinolínicos superiores a 1,7μg/mL.
AGRADECIMIENTOS
Al DSF-IRD de Francia por las becas de estudios de Maestría, a la Agencia Internacional de Cooperación de Suecia, por el apoyo en el programa UMSA-ASDI-SAREC, al CIPTA por el permiso de colecta de especies medicinales Tacana, a la UMSA por el apoyo a las investigaciones de Farmacopeas Tradicionales y a la Cátedra de Control de Medicamentos por facilitar la bibliografía para el desarrollo de este trabajo.
REFERENCIAS
1. Ticona Huallpara JC. Estudio comparativo de métodos de extracción de alcaloides quinolínicos de Angostura longiflora K. Kallunki (Evanta) con actividad leishmanicida. [tesina para licenciatura]. La Paz-Bolivia: Universidad Mayor de San Andrés; 2005. [ Links ]
2. Harmonised Tripartite Guideline. Validation of analytical procedures part I, Definitions and methodology . International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. [Monografía en Internet] Europe, Japan and USA; 1994 [actualizada octubre de 2005; acceso 1 agosto de 2006]. Disponible en: http://www.ich.org/LOB/media. [ Links ]
3. Harmonised Tripartite Guideline. Validation of analytical procedures part II, Methodology . International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. [Monografía en Internet] Europe, Japan and USA; 1996 [actualizada noviembre de 2005; acceso 1 agosto de 2006]. Disponible en: http://www.ich.org/LOB/media. [ Links ]
4. Giménez A., Avila J.A., Ruiz G., Paz M., Udaeta E., Ticona JC, et al. Estudios químicos, biológicos y farmacológicos de Galipea longiflora Krause. Rev Bol Quim. 2005; 22(1): 94-107. [ Links ]
5. United States Pharmacopeial convention, INC. Validation of Compendial Methods. The United States Pharmacopeia 27. Rockville: National Publishing, Philadelphia, PA; 2004. 2622-2625. [ Links ]
6. Ministerio de Salud de Costa Rica. Guía de validación para métodos analíticos. [Monografía en Internet]. Costa Rica; 1998 Disponible en : http:// www. ministeriodesaludo.go.cr/ protocolos/guía validaciónmetodos analiticos. [ Links ]
7. Castillo B, González R. Protocolo de validación de métodos analíticos para la cuantificación de fármacos. Rev Cubana Farm. 1996;30(1): 1-7. [ Links ]
8. Jing Q, Shen Y , Ren F, Chen J, Jiang Z , Peng B , LengY , Dong J. HPLC determination of anethole trithione and its application to pharmacokinetics in rabbits. J Pharm Biomed Anal. 2006; 42: 613–617. [ Links ]
9. Lal J, Mehrotra N, Gupta RC. Analysis and pharmacokinetics of bulaquine and its major metabolite primaquine in rabbits using an LC-UV meted-a pilot study. J Pharm Biomed Anal. 2003; 32:141-150. [ Links ]
10. Quino I, Choque R, Cáceres LF. Validación de una nueva determinación espectrofotométrica para dipirona en fármacos. Rev Bol Quím. 2005;22(1):64-70. [ Links ]
11. Lastra H, Rodríguez E, Ponce de León H, González ML. Método analítico para la cuantificación de taninos en el extracto acuoso de romerillo. Rev Cubana Plant Med. 2000; 5(1): 1-10. [ Links ]












