Serviços Personalizados
Artigo
Indicadores
Links relacionados
 Citado por SciELO
Citado por SciELO
 Similares em SciELO
Similares em SciELO
Bookmark
Revista de Enfermedades Infecciosas y Tropicales
versão impressa ISSN 2074-4625
Rev. enferm. infecc. trop. v.1 n.1 Santa Cruz 2009
ACTUALIZACIONES
Paracoccidioidomicosis
Jorge Vargas1, Raquel Vargas2
1Médico Dermatólogo-Micólogo CENETROP, 2Médico Tropicalista
RESUMEN
La paracoccidioidomicosis (PMC) es una micosis sistémica progresiva con un desenlace fatal si no es tratada a tiempo; es la más importante y frecuente en América Latina, fue descrita por primera vez en 1908 en San Pablo-Brasil por Adolfo Lutz. Es causada por un hongo dimórfico Paracoccidioides brasiliensis, su hábitat en la naturaleza no esta totalmente definido, en los últimos años se aisló el hongo a partir de vísceras de tatú y se ha descrito el primer caso canino, sin embargo la transmisión interhumana y de los animales al hombre o viceversa no esta reportada. Es endémica en las zonas húmedas tropicales y subtropicales de Latinoamérica, el 80% de los casos informados corresponden al Brasil. La infección es adquirida en las primeras décadas de la vida, en la mayoría de los casos el hongo ingresa al organismo por inhalación de esporas de la fase filamentosa (forma infectante) y luego en los pulmones se transforma en la fase levaduriforme (forma parasitaria), condición indispensable para el establecimiento de la infección. Las formas clínicas son la PMC infección, PMC enfermedad que se divide en aguda y crónica, esta ultima en unifocal y multifocal y la PMC latente post tratamiento. El diagnóstico clínico debe ser confirmado por pruebas laboratoriales que pueden ser directas e indirectas, dentro de las directas esta el examen directo micológico que es la prueba "gold standard", las indirectas son el estudio serológico y la paracoccidioidina. A diferencia de otros hongos patógenos, P. brasiliensis es sensible a la mayoría de los medicamentos antifúngicos incluidas las sulfas, por lo tanto, se utilizan en el tratamiento de la PMC la Anfotericina B, la combinación Sulfametoxazol-Trimetoprim los derivados azólicos y triazólicos (Ketoconazol e Itraconazol).
DEFINICIÓN
La paracoccidioidomicosis (PCM) conocida también con el nombre de blastomicosis sudamericana, es una micosis sistémica granulomatosa progresiva con un desenlace fatal si no es tratada a tiempo; se adquiere por la inhalación de esporas de la fase micelial del hongo responsable, es la más importante y frecuente en América Latina, representa un importante problema de salud pública por su alto potencial de incapacidad y la cantidad de muertes prematuras que provoca en grupos poblacionales específicos (trabajadores rurales). Fue descrita por primera vez en 1908 en San Pablo-Brasil por Adolfo Lutz 1, 8.
ETIOLOGÍA
La paracoccidioidomicosis es causada por un hongo dimórfico térmico llamado Paracoccidioides brasiliensis, que a 37 ºC crece en forma de levadura y a 25 ºC se desarrolla en forma micelial, su hábitat en la naturaleza no esta totalmente definido, se cree que son los suelos de cultivos y cría de ganados, debido a que se han reportado muy pocos aislamientos del hongo a partir de estas fuentes, el reservorio natural de P. brasiliensis se encuentra todavía en estudio, en los últimos años en Brasil y Colombia, en varias regiones geográficas se aisló el hongo a partir de vísceras de tatú o armadillo de nueve cintas (Dasypus novemcinctus); por otra parte se ha descrito en Londrina, Brasil el primer caso canino y estudios serologicos demuestran presencia de anticuerpos anti - P. brasiliensis en perros sin lesiones. Antes de los descubrimientos científicos señalados se consideraba al hombre como el único huésped del hongo. Estos hechos permitieron mejorar los conocimientos de la epidemiología de la micosis, sin embargo la transmisión interhumana y de los animales al hombre o viceversa no esta reportada. 4, 9, 13, 15, 18, 24.
EPIDEMIOLOGÍA
La paracoccidioidomicosis es una enfermedad endémica, principalmente de las zonas húmedas tropicales y subtropicales de Latinoamérica, zonas caracterizadas por sus relaciones climáticas y biológicas especiales.
La extensión geográfica donde se presenta se conoce como la "reservaría" de la paracoccidioidomicosis, se sitúa entre los 30º de latitud Sur y 34º Norte, con precipitación pluvial de 500 a 2.000 mm. y altitud de 500 a 2.000 metros sobre el nivel del mar y una temperatura media de 18 a 23 ºC. Cerca del 80% de los casos informados corresponden al Brasil, país al que siguen a gran distancia Venezuela, Colombia Argentina y Ecuador. En el Brasil la incidencia anual oscila entre 1-3 casos por 100.000 habitantes 8, 9, 10, 11, 15, 16, 26.
Es mas frecuente en el sexo masculino con una relación de 13 a 1 respecto al femenino, esta marcada diferencia entre los sexos se asocia a la presencia de receptores 17-b- estradiol en el citoplasma de P. brasiliensis, esta hormona femenina inhibe in vitro y en las mujeres la transformación micelial a levadura del hongo, condición indispensable para que se establezca la infección 1, 8, 9, 17, 23.
El rango de edades oscila desde la niñez y adolescencia 6 -16 años, hasta los 30-60 años, donde puede alcanzar su mayor incidencia en los hombres que se encuentran en la fase más productiva de la vida provocando un alto impacto social y económico 8, 9, 10, 16 .
El grupo ocupacional mas comprometido en todos los países con áreas endémicas es el dedicado a las labores rurales (agricultores, ganaderos, etc.) 23.
PATOGENIA
La infección es adquirida en las primeras décadas de la vida cuando los pacientes son jóvenes, la puerta de entrada del hongo es todavía controversial, en la mayoría de los casos ingresa al organismo por inhalación de esporas de la fase filamentosa (forma infectante) y luego en los pulmones debido a la temperatura del cuerpo se transforma en la fase levaduriforme (forma parasitaria), las levaduras se multiplican en el parénquima, induciendo una respuesta en el huésped caracterizada por un complejo clínico llamado primoinfección "broncoalveolitis" en general asintomática, seguida por la formación de granulomas, los cuales pueden permanecer "inactivos" por años o progresar a enfermedad recién en la edad adulta como reactivación de foco endógeno latente dependiendo de la respuesta inmune del huésped 2, 3, 5, 11, 19, 22.
En vista de la frecuencia de las lesiones muco cutáneas en las regiones oral y anal, éstas también fueron consideradas como puertas de entrada del hongo por ser rutas para la inoculación directa de material contaminado con esporas (madera, hojas de plantas, tierra, etc.), finalmente se señala a la vía digestiva como puerta de ingreso (alimentos contaminados) 1, 8, 16, 17.
Algunos aspectos de la historia natural de la enfermedad son pobremente entendidos. El nicho ecológico de la fase saprofítica es desconocido. La forma micelial, se presume, crece en la tierra, agua y plantas a temperatura ambiente, y se considera como la forma infecciosa. El hombre parece ser resistente a la infección por P. brasiliensis, ya que la enfermedad es usualmente observada como casos aislados entre los miembros de una población que está en contacto directo con la naturaleza ambiental, especialmente agricultores y ganaderos 2, 5, 19 .
El principal componente antigénico de P. brasiliensis es una glicoproteína de 43 Kd llamada GP43, que se une a la pared y participa en la adhesión, invasión y patogénesis del hongo. Los anticuerpos (anti-gp43) dirigidos contra este antígeno son detectados en el suero de todos los pacientes con paracoccidioidomicosis 5, 11, 22, 23.
Las manifestaciones clínicas son las de una enfermedad granulomatosa que compromete el pulmón, áreas mucocutáneas y otros órganos. La morfogénesis de la reacción granulomatosa no está bien establecida. La inmunidad mediada por células ha sido descrita como el mecanismo de defensa más importante del huésped contra el hongo, esto explica porque la forma clínica aguda está asociada con depresión de la inmunidad celular y altos niveles de anticuerpos específicos. La revisión bibliográfica de los aspectos relacionados con la respuesta inmune en la paracoccidioidomicosis es relevante para profundizar nuestros conocimientos, entender la patogénesis de la misma y los mecanismos que causan la inmunodepresión en las formas clínicas crónicas granulomatosas. Este conocimiento nos podría permitir desarrollar en un futuro terapias más eficientes, las cuales ayudarían a los pacientes en la lucha contra esta infección 2, 3, 5, 19.
CLÍNICA
Diversas clasificaciones de las formas clínicas de la PCM fueron propuestas y publicadas desde la primera descripción de la enfermedad, se basaron en diferentes criterios: topografía de la lesiones, gravedad de la enfermedad, resultado de las pruebas serológicas, procedencia de zona endémica, etc. Con el objeto de tener una clasificación fácil de emplear, en especial para el clínico, previo consenso se presentó en el Coloquio Internacional de la paracoccidoidomicosis realizado en Medellín en 1986, la siguiente clasificación basada en datos clínicos y la historia natural de la enfermedad y que se mantiene vigente hasta nuestros días 7, 8, 9, 10, 23 .
1.- Paracoccidioidomicosis infección
2.- Paracoccidioidomicosis enfermedad
2.1 forma aguda/subaguda
2.2 forma crónica
2.2.1 unifocal
2.2.2. multifocal
3.- Paracoccidioidomicosis residual latente post-tratamiento
PARACOCCIDIOIDOMICOSIS INFECCIÓN
Se determina mediante la positividad de la prueba intradérmica paracoccidioidina en individuos sin lesiones.
FORMA AGUDA/ SUBAGUDA (TIPO JUVENIL)
Esta forma de presentación clínica es responsable del 3 a 5 % de los casos, afecta niños, adolescentes y adultos jóvenes, eventualmente se presenta en individuos hasta los 35 años de edad, tiene un periodo de incubación corto, su distribución es semejante en niños de ambos géneros.
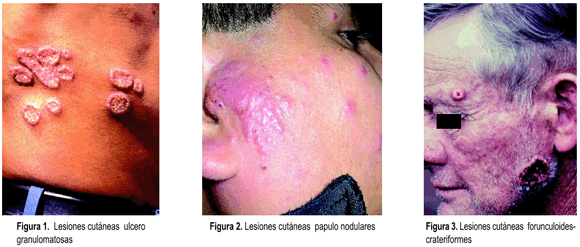
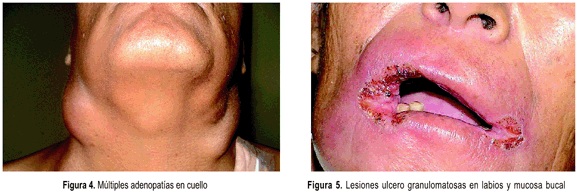
Las principales manifestaciones clínicas son: rápido compromiso del estado general (fiebre, pérdida de peso, anorexia, etc.), poliadenopatías en varias regiones (cervical, axilar, inguinal, cadenas paravertebrales y peritoneales), lesiones polimorfas en piel en diversas localizaciones (nodulares, forunculoides, verrucosas, ulcero granulomatosas, etc.), compromiso digestivo (hepatoesplenomegalia y ascitis), lesiones osteoarticulares, muy escaso compromiso pulmonar y de mucosas. P. brasiliensis muestra un considerable tropismo por el tejido linfático 8,10,11,23.
FORMA CRÓNICA (TIPO ADULTO)
Esta forma clínica corresponde a más del 90 % de los pacientes y se presenta principalmente entre los 30 y 60 años, predominando en el sexo masculino (proporción 13/1) se han descrito períodos de incubación hasta de 20 años.
La micosis de inicio progresa lentamente en forma silenciosa, pudiendo pasar años antes de que sea diagnosticada. Las manifestaciones pulmonares están presentes en el 90% de los pacientes.
Se denomina unifocal cuando solamente afecta un órgano, siendo los pulmones el único órgano afectado en un 25% de los casos. Generalmente afecta más de un órgano simultáneamente (presentación multifocal), los pulmones, la mucosa orofaríngea, los ganglios linfáticos y la piel son las zonas de mayor predilección.
Las principales manifestaciones clínicas son: compromiso insidioso del estado general (fiebre, pérdida de peso y astenia), lesiones pulmonares (infiltrado moteado bilateral y adenopatía hiliar) que provocan tos, expectoración, disnea, hemoptisis, lesiones mucosas, localizadas en boca y faringe, son ulcero granulomatosas (estomatitis moriforme) provocan dolor a la masticación y deglución, cuando se localizan en encías dan lugar a gingivitis que afloja los dientes. Por extensión las lesiones afectan la laringe y traquea dando lugar a disfonía, en casos avanzados hay destrucción del velo del paladar y la epiglotis, en piel y ganglios linfáticos las lesiones son similares a las descritas en la forma aguda.
Otras localizaciones menos frecuentes son esófago, estomago, páncreas, suprarrenales, huesos, articulaciones, hígado y sistema nervioso central1, 8, 10, 11, 17, 23.
FORMA RESIDUAL LATENTE POST TRATAMIENTO
Comprende aquellos casos aparentemente curados donde la enfermedad se mantiene en estado latente, en los cuales pueden quedar como secuelas: fibrosis, calcificaciones o nódulos pulmonares. La inmunidad celular debe estar recuperada y los anticuerpos circulantes ausentes o presencia de títulos muy bajos son considerados como "cicatriz serológica". Es importante señalar que la PMC no cura totalmente, permanece latente y puede reactivarse en el futuro en función del estado inmunitario del huésped 1, 23.
La paracoccidioidomicosis puede presentarse asociada a otras enfermedades infecciosas y no infecciosas, entre las primeras se destaca la tuberculosis con porcentajes de 5 a 10%, también se asocia con hansen, sida, leishmaniosis, enteroparasitosis, sífilis, chagas, otras micosis (dermatofitosis, candidiosis, histoplasmosis, criptococosis). Entre las patologías no infecciosas figura la enfermedad de Hodgkin y carcinomas 1,6,12,15,23,25.
DIAGNÓSTICO
Clínico
Por ser la PMC una micosis sistémica, cualquier órgano puede ser comprometido, la atención del clínico debe dirigirse en primer lugar a valorar al estado general del paciente que siempre esta deteriorado, luego a la búsqueda de los signos y síntomas de los órganos mas frecuentemente atacados (pulmones, piel, ganglios linfáticos y mucosa orofaringea) según se trate de la variedad clínica aguda o crónica 9, 11, 17.
En la forma aguda se debe buscar adenopatías en cadenas superficiales y profundas, estas últimas mediante ecografías y tomografías, presencia de hepato y esplenomegalia, lesiones dérmicas y osteoarticulares, signos de compromiso suprarrenal (astenia, adelgazamiento, hipotensión arterial, etc.) y del sistema nervioso central (cefalea, síndrome convulsivo, etc.) 1, 23.
En las formas crónicas al margen del análisis del estado general, el examen físico debe enfocarse a los signos y síntomas de compromiso pulmonar (tos, disnea, expectoración muco purulenta o sanguinolenta) solicitar radiografías de tórax, en piel (lesiones polimorfas) en mucosas (lesiones ulcero granulomatosas, odinofagia, disfagia) en linfáticos (adenomegalias en diferentes estadíos) y de otras localizaciones (suprarrenales, sistema nervioso central, etc.) 11, 16, 23.


Laboratorio
En virtud de las diversas lesiones que provoca, es decir, el marcado polimorfismo clínico y del ataque a numerosos órganos y sistemas, solo puede ser diagnosticada con certeza mediante exámenes de laboratorio.
La prueba "gold standard" para el diagnóstico de la Paracoccidioidomicosis es el examen directo, puesto que permite en la mayoría de los casos la observación de la forma parasitaria del hongo.
Las muestras biológicas utilizadas para el estudio micológico son: esputo, exudados de lesiones ulcero granulomatosas, pus obtenido de punción de adenopatías, raspado de lesiones en mucosas, escamo-costras de lesiones de piel, líquido cefalorraquídeo, fragmentos de biopsias de órganos internos, orina y sangre.
El examen directo se realiza colocando una gota de la muestra líquida en portaobjetos o utilizar solución de KOH en caso de muestras solidas; las muestras positivas permiten observar levaduras esféricas u ovales de doble pared, de 30 a 60 µm de diámetro y con gemaciones múltiples. En el interior de las levaduras se distinguen claramente el contenido citoplasmático, las levaduras pueden estar solas, agrupadas o formando cadenas de 4 a 12 elementos, algunas veces la levadura de mayor tamaño adopta una disposición en rueda de timón u orejas del ratón "Mickey". El reconocimiento de estas estructuras fúngicas es fácil, por dicha razón el examen directo es la maniobra mas útil en el diagnóstico de esta micosis. El cultivo en los medios tradicionales usados rutinariamente (Sabouraud, etc.) es de difícil obtención 8, 9, 16, 23.
Ante la imposibilidad de realizar el estudio micológico, se puede emplear la histopatología, en lesiones de piel y mucosas se observa hiperplasia de la epidermis con hiperqueratosis, espongiosis y microabscesos de polimorfonucleares, mezcla de infiltrados inflamatorios agudo y crónico formados por linfocitos, histiocitos, plasmocitos, células gigantes y de cuerpo extraño, las estructuras parasitarias del hongo se observan con hematoxilina eosina, se visualizan mejor con las tinciones de PAS y Grocott Gomorri 1, 11, 12 .
La paracoccidioidina es una prueba intradérmica cuyo antígeno se prepara a partir de la fase levaduriforme del hongo, se inyecta en el antebrazo 0,1 mL y la lectura se realiza a las 48 horas. Se considera positiva cuando la induración supera los 5 mm. Se utiliza como arma epidemiológica para la determinación de áreas endémicas (infecciones asintomáticas). La paracoccidioidina preparada con la GP43 es mas específica y los resultados mas fidedignos 1, 6.
La reacción serológica más útil es la inmunodifusión (cualitativa y cuantitativa), tiene una sensibilidad del 90% y especificidad del 100% si se realiza con antígeno de la fase levaduriforme, se presentan 1 a 3 bandas de precipitación, las bandas 1 y 2 son específicas, la 3 tiene reacción cruzada con Coccidioidomicosis, estas bandas desaparecen cuando hay curación, por dicha razón la prueba es empleada para seguimiento del tratamiento mas que para diagnóstico. Otras pruebas utilizadas son la fijación de complemento, inmunoelectroforesis, inmunoensayo enzimático (ELISA) e inmunoelectro transferencia (Western Blot) 4, 19, 23, 28.

DIAGNÓSTICO DIFERENCIAL
La PMC se caracteriza por presentar lesiones con marcado polimorfismo, por dicha razón son numerosas las patologías que pueden ser confundidas con la micosis, entre las más frecuentes se encuentran1, 8, 11:
Forma aguda: linfomas, leucemia
Forma crónica: tuberculosis pulmonar, ganglionar y cutánea, leishmaniasis histoplasmosis, coccidioidomicosis, criptococosis cutánea y pulmonar, actinomicosis, rinoescleroma, esporotricosis, cromomicosis, epiteliomas, enfermedad de Wegener.
TRATAMIENTO
A diferencia de otros hongos patógenos, P. brasiliensis es sensible a la mayoría de los medicamentos antifúngicos incluidas las sulfas, por lo tanto, se utilizan en el tratamiento de la PMC la Anfotericina B, la combinación Sulfametoxazol-Trimetoprim, los derivados azólicos y triazólicos (Ketoconazol e Itraconazol) 1, 8, 17 .
Para las formas leves y moderadas de la enfermedad, donde se puede realizar tratamiento ambulatorio, la droga de elección es el Itraconazol, como segunda opción esta el Trimetoprim+Sulfametoxazol, en tercer lugar el Ketoconazol, en las formas graves que requieren internación hospitalaria, el antifúngico de elección es la Anfotericina B.14, 20, 23 .
La dosis recomendada de Itraconazol para adultos es de 200 mg/día en una sola toma, en niños 5 a 10 mg/kg/día, para el Trimetoprim+Sulfametoxazol adultos 160/800 mg cada 12 horas, niños 8-10/40-50/mg/kg cada 12 horas, respecto al Ketoconazol adultos 400 mg diarios, niños 10 a 20 mg/kg/día, La Anfotericina B se administra vía endovenosa disuelta en suero glucosado, la dosis es inicialmente de 0,25 mg/kg con aumento progresivo hasta alcanzar 1 mg/kg, se administra cada 2 a 3 días, 2 a 4 meses, la dosis total esta relacionada con la respuesta clínica, pudiendo llegar de 2 a 3 gramos 1, 9, 20, 21, 23, 27, 29 .
En general, cualquiera sea la elección del antifúngico, el tratamiento es largo, de 6 a 24 meses, el tiempo se basa en los criterios de curación que son clínico, radiológico y serológico. El clínico se basa en la cicatrización de las lesiones y desaparición de los síntomas, el radiológico en la estabilización del patrón de imágenes reveladoras de cicatrización pulmonar y el serológico en la negativización de la inmunodifusión o la estabilización de los títulos bajos que se consideran como cicatriz serológica 14, 23.
Se considera que a pesar de realizar una terapia antifúngica adecuada y haber logrado los criterios de curación no se consigue erradicar totalmente a P. brasiliensis del organismo; obteniéndose un equilibrio entre el parásito y el huésped que permite la recuperación de la inmunidad celular; los pacientes quedan con un riesgo potencial de presentar una reactivación postratamiento, por lo que se debe realizar cada año controles clínicos y serológicos y frente a una eventual reactivación reiniciar tratamiento 11, 16, 21.
REFERENCIAS
1. Arenas R. Micología Médica Ilustrada, segunda edición, Editorial: Mc Graw Hill, México, 2003: 173-179 [ Links ]
2. Borges-Walmsley M.I, Chen D, Shu X, Walmsley AR. The pathobiology of Paracoccidioides brasiliensis. Trends Microbiology, 2002, 2: 80-87. [ Links ]
3. Camargo Z.P, Franco M.F. Current knowledge on pathogenesis and immunodiagnosis of paracoccidioidomycosis. Rev Iberoam Micol 2000; 17: 41-48. [ Links ]
4. Corredor G.G., Castaño J.H., Peralta L.A. y cols. Isolation of Paracoccidioides brasiliensis from de nine-banded armadillo Dasypus novemcinctus, in an endemic area for Paracoccidioidomycosis in Colombia, Rev. Iberoam. Micol. 1999, 16: 216-220 [ Links ]
5. Ferreira, MS, Queiroz-Telles F. Imunopatogênese e Patologia en Tratado de Infectologia, 3ª. edición, Editorial Atheneu, São Paulo, 2005: 1374-1378, [ Links ]
6. Fornajeiro N., Ferrarezi Maluf M.L., Takahachi G. y cols. Inquerito epidemiológico sobre a paracoccidioidomicose utilizando a gp43 em dois municipios do noroeste do Paraná, Brasil. Rev. Soc. Bras. Med. Trop. 2005, 38: 191-193 [ Links ]
7. Franco M, Montenegro M.R, Mendes, R.P, y cols. Paracoccidioidomycosis: a recently proposed classification of its clinical forms. Rev. Soc. Bras. Med- Trop. 1987: 20: 129-132
8. Lacaz C.S, Porto E, Martins J.E.C. et al. Paracoccidioidomicose, en Tratado de Micología Medica Lacaz. 9na edición: Editorial Sarvier Publishers, Sao Paulo 2002: 639-729.
9. Marques S.A. Paracoccidioidomicose - Atualizaçao Epidemiologica, Clinica e Terapeutica, Anais Bras. Derm., 2003, 78: 135-150 [ Links ]
10. Marques S.A. Paracoccidioidomicose, Anais Bras. Derm. 1998, 73: 455-469 [ Links ]
11. Mendes R.P, Shikanai-Yasuda M.A. Paracoccidioidomicose. en Medicina Tropical, 1ª edición, Editorial: Atheneu, Sao Paulo, 2003: 505-545 [ Links ]
12. Negroni R. Micosis sistemicas tropicales asociadas al sida. Rev. Enfermedades emergentes 2003, 5: 27-40 [ Links ]
13. Ono M.A., Bracarense A.P.F.R.L. Morais H.A.S. y cols. Canine Paracoccidioidomycosis: a seroepidemiological study, Med. Mycol. 2001, 39: 277-285
14. Queiroz-Telles F. Tratamento da Paracoccidioidomicose, en Tratado de Infectologia, 3ª edición, editorial: Atheneu, São Paulo, 2005: 1395-1402 [ Links ]
15. Restrepo A., McEwen JG, Castañeda E. The habitat of Paracoccidioides brasiliensis: how far from solving the riddle? Med Mycol 2001, 39: 232-241
16. Restrepo-Moreno A. Paracoccidioidomycosis. en Clinical Mycology. Editorial: Oxford University Press, New York, 2003: 328-345 [ Links ]
17. Restrepo, A., Benard, G. Paracoccidioidomycosis. Capítulo 202 en Pediatric Infectious Diseases, 5a edicion, editorial WB Saunders. 2004; 2592-2601 [ Links ]
18. Ricci G., Mota F.T., Wakamatsu A. y cols. Canine Paracoccidioidomycosis, Med Mycol. 2004, 42: 379-383
19. San-Blas G, Niño-Vega G, Iturriaga T. Paracoccidioides brasiliensis and paracoccidioidomycosis: molecular approaches to morphogenesis, diagnosis, epidemiology, taxonomy and genetics. Med Mycol 2002; 40: 225-242. [ Links ]
20. Shikanai-Yasuda M.A, Higaki, Y, Del Negro G.B, y cols. Randomized therapeutic trial with Itraconazole, Ketoconazole and Sulfadiazine in Paracoccidioidomycosis. Medical Mycology 2002, 40: 411-417
21. Shikanai-Yasuda M.A. Pharmacological management of Paracoccidioidomycosis. Expert Opinion Pharmacotherapy 2005, 6: 385-397 [ Links ]
22. Shikanai-Yasuda M.A, Kono A, Magri M.M. Imunologia das Micoses. en Tratado de Infectologia, 3ª. edición, Editorial Atheneu, São Paulo, 2005: 1313-1340 [ Links ]
23. Shikanai-Yasuda M.A., De Queiroz Telles Fihlo F., Poncio Mendes R. y cols. Consenso em Paracoccidioidomicose, Rev. Soc. Bras. Med. Trop. 2006, 39: 297-310
24. Silva-Vergara M.L.,Martinez R., Camargo Z.P. y cols. Isolation of Paracoccidioides brasiliensis from armadillos (Dasypus novemcinctus) in an area where the fungus was recently isolated from soil. Med Mycol. 2001, 39: 233-241
25. Silva-Vergara M.L, Teixeira A.C, Curi V.G, y cols. Paracoccidioidomycosis associated with human immunodeficiency virus infection. Report of 10 cases. Medical Mycology, 2003: 41: 259-263.
26. Torrado E, Castañeda E, de la Hoz F, Restrepo A. Paracoccidioidomicosis: definición de las áreas endémicas de Colombia. Biomédica, 2000, 20: 327-334
27. Valle A.C.F, Wanke B, Wanke N, y cols. Tratamento da paracoccidioidomicose. Estudo retrospectivo de 500 casos. Avaliação dos resultados terapêuticos com sulfanilamídicos, Anfotericina B, associação Sulfametoxazol-Trimetoprima, Cetoconazol e Miconazol. Anais Bras. Derm. 1993, 66: 65:70
28. Valle A.C.F, Costa R.L.B, Monteiro P.C.F, y cols. Interpretation and clinical correlation of serological tests in Paracoccidioidomycosis. Medical Mycology 2001, 39: 373-377
29. Vargas J. Recacoechea M., Ketoconazole in the treatment of Paracoccidioidomycosis (South American Blastomycosis) experience in 30 cases in Bolivia Mykosen, 1988, 31: 137-147